心脏型脂肪酸结合蛋白(H—FABP)检测试剂(免疫层析法)产品技术要求万孚
- 格式:docx
- 大小:14.75 KB
- 文档页数:1

心型脂肪酸结合蛋白校准品产品技术要求中生北控心型脂肪酸结合蛋白校准品适用范围:本产品与本公司生产的心型脂肪酸结合蛋白测定试剂盒配套使用,用于临床检验实验室心型脂肪酸结合蛋白项目定量检测的系统校准。
1.1规格冻干粉型:1mL×6(6个浓度)1.2主要组成成分本产品由以19 mmol/L,pH7.2的三羟甲基氨基甲烷盐酸盐缓冲液为基质,并添加了心型脂肪酸结合蛋白(重组人源)及2%牛血清白蛋白的冻干粉组成。
校准品定值范围:浓度①: 0.00~0.50 ng/mL;浓度②:0.51~8.00ng/mL;浓度③:8.01~20.00ng/mL;浓度④:20.01~40.00ng/mL;浓度⑤:40.01~80.00 ng/mL;浓度⑥:80.01 ~120.00ng/mL(每批定值,详见值单)。
2.1 外观本校准品应为浅黄色冻干粉,复溶后应为浅黄色透明溶液,无混浊,无未溶解物。
2.2 准确度中生试剂和已上市同类试剂分别测定40个在测定范围内不同浓度的样本,计算两组数据的相关系数(r)及测值的偏差,要求r≥0.975;在[2.5,20]ng/mL范围内,绝对偏差应不超过±2.0ng/mL;在(20,120]ng/mL范围内,相对偏差应不超过±10%。
2.3瓶间差瓶间差的变异系数(CV)应≤5%。
2.4含水量含水量应≤5%。
2.5稳定性2.5.1效期稳定性原包装校准品在2℃~8℃条件下贮存,有效期为12个月。
在有效期满后3个月内,校准品性能应符合2.1、2.2、2.3的要求。
2.5.2复溶稳定性复溶后校准品在2℃~8℃条件下密闭避光保存,稳定期为7天。
在稳定期满后1天内,校准品性能应符合2.1、2.2、2.3要求。
2.6 溯源性校准品溯源性应符合GB/T 21415-2008的要求,并提供相关溯源过程, 本校准品溯源至工作校准品并经与已上市产品比对赋值。
附录A心型脂肪酸结合蛋白校准品溯源说明1 校准品溯源情况本公司生产的心型脂肪酸结合蛋白校准品采用同类产品比对赋值。

心脏型脂肪酸结合蛋白(h-FABP)胶体金快速检测试剂盒使用说明书(仅供专业人员体外诊断使用)用途心脏型脂肪酸结合蛋白(h-FABP)检测试剂盒是应用免疫胶体金层析技术建立的快速、特异、操作简便的一步法定性检测方法,用于定性检测人血清或血浆中的心脏型脂肪酸结合蛋白(h-FABP)。
可用于急性心肌梗塞(AMI)的辅助诊断。
简介用于早期诊断急性心肌梗塞(AMI, Acute Myocardial infarction)的指标主要有肌酸激酶异构酶(CK-MB)、肌钙蛋白I(Troponin I)、肌钙蛋白T(Troponin T)和肌红蛋白(Myoglobin)等,但它们对于早期诊断AMI却很不理想,主要原因是:CK-MB、肌钙蛋白I、肌钙蛋白T缺乏敏感性,它们在胸痛后6-8小时才浓度上升;而肌红蛋白则缺乏特异性,它虽然在胸痛后2-3小时浓度上升,但不能区分骨骼肌和心肌损伤。
而心脏型脂肪酸结合蛋白(h-FABP)则克服了以上两缺点,对于早期诊断AMI具有特异性和敏感性,它是15KD的小分子,动力学特征类似于肌红蛋白,即在胸痛后2-3小时后浓度开始上升,在12-24小时内恢复到正常水平,在4-8小时内达到最高值;而且h-FABP的免疫性不同于其它类型的FABP(如小肠型FABP 和肝脏型FABP),具有特异性,不会发生交叉反应。
基于h-FABP以上特点使得其成为理想的AMI早期诊断生化指标。
检测原理心脏型脂肪酸结合蛋白(h-FABP)检测试剂盒是采用固相免疫胶体金层析技术,利用双抗体夹心法定性检测人血清或血浆中的h-FABP。
人血清或血浆扩散通过附着红色颗粒包被的抗体的滤膜,与滤膜中的包被抗体结合,在检测线(T)区域内,h-FABP-抗体复合物开始与包被在检测线区内的抗体接触,如果血清h-FABP浓度大于10ng/ml,在检测线区h-FABP-抗体复合物被抗-h-FABP的抗体捕获,并出现一条可见的红色条带。

心肌脂肪酸结合蛋白测定试剂盒(上转发光法)
适用范围:与本公司生产的上转发光免疫分析仪配套使用,用于体外定量测定人血清、血浆和全血样本中心肌脂肪酸结合蛋白(H-FABP)的含量。
1.1规格:20人份/盒和40人份/盒。
1.2组成:
2.1 外观
2.1.1 液体组分应澄清透明、无沉淀或絮状物,铝箔袋应无破损漏气现象。
2.1.2 液体试剂的净含量应不少于标示值。
2.1.3 试纸条宽度应为4.0±0.1nm。
2.1.4 液体移行速度应不低于10mm/min。
2.2准确性
检测心肌脂肪酸结合蛋白(H-FABP)的纯品,其回收率应在(85%~115%)范围内。
2.3线性范围
[2,100] ng/mL范围内,相关系数(r)应不低于0.9900。
2.4 精密度
2.4.1 批内变异系数(CV):分别检测(20±2)ng/mL、(5±0.5)ng/mL的
样本,批内
变异系数应均不高于15.0%。
2.4.2 批间变异系数(CV):检测(5±0.5)ng/mL的样本,批间变异系数应
不高于15.0%。
2.5空白检测限
试剂盒空白检测限应不大于1ng/mL。
2.6 特异性
与人血清白蛋白(HSA)、胆红素无显著交叉反应。
表1 与其它物质的交叉反应数据
2.7 稳定性
本产品有效期18个月,取到效期产品在2个月内进行检测,测定结果应符合
上述2.1、2.2、2.3、2.4.1、2.5、2.6项要求。
术语: 无。

心脏型脂肪酸结合蛋白校准品适用范围:与该公司生产的心脏型脂肪酸结合蛋白测定试剂盒(胶乳免疫比浊法)配套使用。
用于临床检验心脏型脂肪酸结合蛋白项目的系统校准。
1.1 包装规格0.5mL/瓶×5(5个水平)1.2 组成成分抗人心脏型脂肪酸结合蛋白、20mmol/L Tris-HCl缓冲液(pH7.5)、人血清(含量5%)标示值范围:水平1:(5.0±0.7)μg/L,水平2:(10.0±1.5)μg/L,水平3:(20.0±3.0)μg/L,水平4:(80.0±12.0)μg/L,水平5:(160.0±24.0)μg/L,批特异,具体浓度见瓶签。
2.1 外观无色澄清液体。
2.2 装量试剂盒内液体装量应不低于瓶签标示装量。
2.3 重复性重复测定各水平校准品,其结果变异系数(CV)应≤10%。
2.4 准确度采用万泰德瑞心脏型脂肪酸结合蛋白测定试剂盒(胶乳免疫比浊法)和已上市试剂盒同时测定至少40例血清样本,[2.5,160.0]μg/L范围内,线性回归的相关系数应不小于0.990;[2.5,15.0]μg/L浓度线性绝对偏差不超过±2.25μg/L,(15.0,160.0]μg/L浓度线性相对偏差应不超过±15%。
2.5 稳定性2.5.1效期稳定性原包装校准品在2℃~8℃密闭保存,有效期为24个月。
有效期满后两个月内,性能指标应符合2.3、2.4之规定。
2.5.2 开瓶稳定性校准品开瓶后在2℃~8℃密闭避光保存可稳定14天。
到后期检测结果应符合2.4之规定。
2.6溯源性按照GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和质控物质赋值的计量学溯源性》要求,该校准品溯源至本公司内部工作校准品,通过与已上市的两家公司生产的胶乳免疫比浊法的心脏型脂肪酸结合蛋白测定试剂盒比对赋值。

心型脂肪酸结合蛋白(H-FABP)测定试剂盒(磁微粒化学发光法)适用范围:该产品用于体外定量测定人血清样本中的心型脂肪酸结合蛋白(H-FABP)含量。
1.1 包装规格100测试/盒50测试/盒。
1.2 主要组成成分试剂盒由试剂1号、试剂2号、磁分离试剂、校准品和质控品组成。
试剂1号(R1):含有FITC标记的H-FABP抗体(浓度1.0 µg/mL)、保护剂和防腐剂的磷酸盐缓冲液。
试剂2号(R2):含有ALP标记的抗H-FABP抗体(浓度0.5µg/mL)、保护剂和防腐剂的磷酸盐缓冲液。
磁分离试剂(M):含包被有抗FITC抗体的磁性微粒(浓度1.0mg/mL)、保护剂的Tris缓冲液。
校准品(STD):6个水平,含一定浓度H-FABP抗原和牛血清白蛋白的磷酸盐缓冲液配制而成。
校准品的目标浓度分别为0.00ng/mL,5.00ng/mL,25.00ng/mL,50.00ng/mL,100.00ng/mL和200.00ng/mL。
质控品(QC):2个水平,含一定浓度H-FABP抗原和牛血清白蛋白的磷酸盐缓冲液配制而成。
质控品的目标浓度为 10.00ng/mL和 100.00ng/mL,质控品浓度具有批特异性,详见每批的质控单。
2.1外观2.1.1试剂盒各组分应齐全、完整、液体无渗漏;2.1.2磁分离试剂摇匀后为均匀悬浊液,无明显凝集;2.1.3液体组分应澄清,无沉淀或絮状物;2.1.4包装标签应清晰,易识别。
2.2线性在[1.00,200.00]ng/mL的测量范围内,试剂盒的相关系数(r)应≥0.9900。
2.3空白限应不高于0.30ng/mL。
2.4准确度回收率应在85.0%~115.0%范围内。
2.5重复性批内变异系数(CV)应不大于10.0%。
2.6批间差批间变异系数(CV)应不大于15.0%。
2.7质控品的赋值有效性质控品的测量值应在质控范围内。
2.8特异性试剂盒与表1中规定浓度的物质应无显著的交叉反应。

心脏型脂肪酸结合蛋白检测试剂盒(胶体金免疫层析法)适用范围:本产品适用于对人血清/血浆/全血中心脏型脂肪酸结合蛋白进行体外定性检测。
1. 产品型号/规格及其划分说明1.1产品型号产品型号及分类如下表1:表1 产品型号及分类U系列(卡型)G系列(条型)宽度(mm)U2 G2 2.5U3 G3 3.3U4 G4 4.0U5 G5 5.0注:产品相同系列不同型号间除试剂条宽度外,其余完全一致。
U系列是在G系列试剂条的基础上加卡壳,其余完全一致。
1.2包装规格卡型:1人份/袋;条型:100人份/盒、50人份/盒、25人份/盒、1人份/袋。
1.3主要组成成分(1)检测试剂卡/条由样品垫、金结合物垫(金垫上固定胶体金标记的心脏型脂肪酸结合蛋白鼠源单克隆抗体)、硝酸纤维素膜(T线包被心脏型脂肪酸结合蛋白鼠源单克隆抗体,C线包被有羊抗鼠IgG抗体)、吸水纸、PVC胶板构成。
(2)干燥剂。
2. 性能指标2.1 物理性状2.1.1 外观a) 试剂盒的外观应平整、边缘无毛刺;包装完整、标签清晰可辨;b) 测试块与基底片固定应紧密、不能有缺损或脱落;c) 测试块外观整齐、色泽均匀、不能有色斑或污渍。
2.1.2 膜条宽度试纸条宽度应U2、G2不小于2.5mm;U3、G3不小于3.3mm;U4、G4不小于4.0mm;U5、G5不小于5.0mm。
2.1.3 液体移行速度液体移行速度不得低于10mm/min。
2.2 临界值及重复性临界值为6.0ng/ml;用浓度为7.0ng/ml的h-FABP质控液重复检测次数≥20,检测结果的阳性率应≥95%,且显色一致;用浓度为5.0ng/ml h-FABP 质控液重复检测次数≥20,结果的阴性率应≥95%,且显色一致。
2.3 准确性用浓度为7.0ng/ml的心脏型脂肪酸结合蛋白(h-FABP)阳性质控品重复检测3次,检测结果应均为阳性。
2.4 HOOK效应用浓度为1100ng/ml h-FABP质控液重复检测3次,检测结果应不出现阴性。

产品描述:心脏型脂肪酸结合蛋白(h-FABP)胶体金快速检测试剂盒是应用免疫胶体金层析技术建立的快速、特异、操作简便的一步法定性检测方法,用于定性检测人全血、血清或血浆中的心脏脂肪酸结合蛋白(h-FABP),可用于急性心肌梗塞(AMI)的辅助诊断。
检验原理:H-FABP存在于心肌细胞质中,心肌缺血导致心肌细胞坏死时,H-FABP渗漏到血液中,从而使外周血浓度升高。
因此,它就成为AMI的早期检测指标。
产品特点:1.高灵敏度及二次检测灵敏性:有病正确诊断率高。
现有的肌钙蛋白和肌酸激酶异构酶,在发病6—8小时可检测出,而本品早在发病2小时即可检出,4—6小时达到峰值,12小时后浓度消退,是目前检测出时间最早的一类。
且对于短期的AMI二次发作检测灵敏度高。
2.高特异性:目前医院对于发病2小时左右的病人采用测肌红蛋白,但是由于肌红蛋白在骨骼肌中的含量是心肌的两倍,故在骨骼肌受损的情况下易造成假阳性。
而H-FABP大量存在于心肌细胞中,骨骼肌中的含量只有心肌的四分之一,故特异性高于肌红蛋白。
产品的使用方法:产品的适用科室:产品的制造工艺:病例讨论:对于发病6小时以内的病人检测H-FABP,其敏感性要高目前医院所使用的CK-MB和肌钙蛋白I1. 材料和方法1.1 选取急诊就诊及住院的病史资料完整的A MI患者46例。
诊断均符合WHO的标准(典型的胸痛持续时间超过30分钟;ST段抬高>2mm;血清心肌酶学升高超过正常上限两倍以上)。
异常者。
1.2 所有AMI患者于发病后半小时、1小时、2小时、4小时、6小时、12小时静脉采血,采血4ml注入已预先加入EDTA及抑肽酶的试管中,立即进行超高速离心20分钟后,分离出血浆,置于-70℃冰箱保存,避免反复冻溶。
待标本资料收集完整后,用采用固相夹心酶联免疫法测定H-FABP浓度。
1.3 统计学处理应用SPSS17.0统计软件,计量资料用均数±标准差()表示,计数资料用2表示;组间数据比较用独立样本t检验,各组间比较用重复测量资料的方差分析。

心脏型脂肪酸结合蛋白(H-FABP)测定试剂盒(荧光免疫层析法)适用范围:本试剂盒用于体外定量测定人血清、血浆或全血中心脏型脂肪酸结合蛋白(H-FABP)的含量。
1.1规格10人份/盒、20人份/盒、50人份/盒。
1.2主要组成成分注:1.质控品质控范围批特异,具体浓度详见标签。
2.1 物理性能2.1.1 外观检测卡应整洁完整、无毛刺、无破损、无污染;材料附着牢固。
2.1.2 膜条宽度膜条的宽度应不小于3mm。
2.1.3 移行速度液体移行速度应不低于10mm/min。
2.2 溯源性根据GB/T 21415-2008的有关规定,提供所用校准品的来源、赋值过程及测量不确定度等内容,溯源至企业工作校准品,并与已上市产品比对赋值。
2.3 空白限空白限应不高于2ng/mL。
2.4 准确度回收率应在85%~115%之间。
2.5 线性在线性范围[3,120]ng/mL内,相关系数(r)应不低于0.99。
2.6 重复性分别检测高值和低值两个样本,重复性(CV%)应不高于15.0%。
2.7 批间差在三个批次产品之间,样本测定结果的变异系数(CV%)应不高于20.0%。
2.8 特异性2.9 质控品赋值有效性测定高值、低值浓度质控品,其结果均应在质控范围内。
2.10 稳定性2.10.1 效期稳定性10℃~30℃储存(质控品2℃~8℃),有效期12个月,效期后2个月内分别检测2.3~2.6,2.8,2.9项,其结果应符合各项要求。
2.10.2 质控品复溶稳定性冻干粉试剂复溶后,-20℃以下储存,有效期1个月,分别检测2.6,2.9项,其结果应符合各项要求。
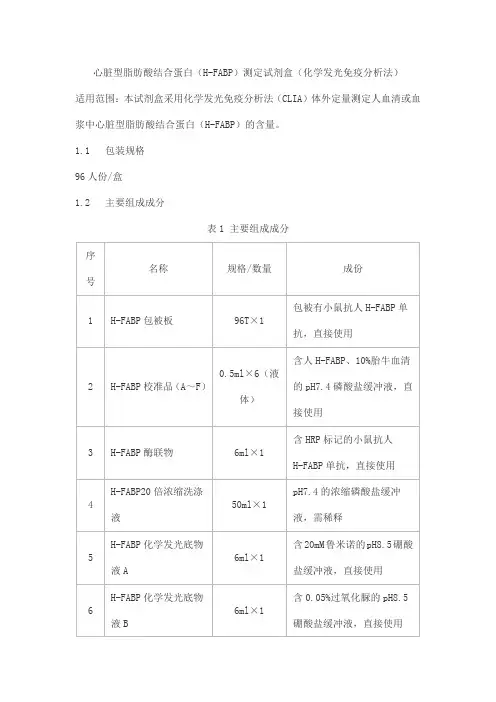
心脏型脂肪酸结合蛋白(H-FABP)测定试剂盒(化学发光免疫分析法)适用范围:本试剂盒采用化学发光免疫分析法(CLIA)体外定量测定人血清或血浆中心脏型脂肪酸结合蛋白(H-FABP)的含量。
1.1 包装规格96人份/盒1.2 主要组成成分表1 主要组成成分注:校准品溯源至同位素稀释质谱法,校准品(A~F)目标浓度为0、3、10、30、80、160ng/ml。
2.1 外观组分齐全、完整,液体无渗漏,微孔板包装袋无破损、漏气现象;标签应清晰,易识别。
2.2 装量液体装量应不少于标示值。
2.3 准确度在剂量反应曲线检测范围内,用已知浓度的纯品做回收试验,其回收率应在85~115%范围内。
2.4 线性在线性范围 [2.5,160]ng/ml内,剂量反应曲线相关系数(r)的绝对值应不低于0.9900。
2.5 空白限应不大于2.5ng/ml。
2.6 重复性变异系数(CV)应不大于10.0%。
2.7 批间差批间变异系数(CV)应不大于15.0%。
2.8 分析特异性测定浓度为300ng/ml人肝脏型脂肪酸结合蛋白(L-FABP),交叉反应率小于2.5%。
2.9 稳定性产品在2~8℃条件下保存有效期为12个月,取到效期产品在1个月内进行检测,检测结果应满足2.3~2.6,2.8项要求。
术语4.1 CLIA:Chemiluminescent immunoassay化学发光免疫分析4.2 H-FABP:Heart-type Fatty Acid-Binding Protein心脏型脂肪酸结合蛋白4.3 RLU:Relative Light Unit相对光单位。

心型脂肪酸结合蛋白(h-FABP)酶联免疫分析试剂盒预期应用ELISA法定量测定人血清、血浆或其它相关生物液体中心型脂肪酸结合蛋白(h-FABP)含量。
实验原理用纯化的抗体包被微孔板,制成固相载体,往包被抗h-FABP抗体的微孔中依次加入标本或标准品、生物素化的抗h-FABP抗体、HRP标记的亲和素,经过彻底洗涤后用底物TMB显色。
TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的h-FABP呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),计算样品浓度。
试剂盒组成及试剂配制1. 酶联板:一块(96孔)2. 标准品(冻干品):2瓶,每瓶临用前以样品稀释液稀释至1ml,盖好后静置10分钟以上,然后反复颠倒/搓动以助溶解,其浓度为150 ng/ml,请先稀释至30 ng/ml,再做系列倍比稀释(注:不要直接在板中进行倍比稀释)后,分别稀释成30 ng/ml,15 ng/ml,7.5 ng/ml,3.75 ng/ml,1.88 ng/ml,0.94 ng/ml,0.47 ng/ml,样品稀释液直接作为标准浓度0 ng/ml,临用前15分钟内配制。
如配制15 ng/ml标准品:取0.5ml (不要少于0.5ml )30 ng/ml的上述标准品加入含有0.5ml样品稀释液的Eppendorf管中,混匀即可,其余浓度以此类推。
3. 样品稀释液:1×20ml。
4. 检测稀释液A:1×10ml。
5. 检测稀释液B:1×10ml。
6. 检测溶液A:1×120μl(1:100)临用前以检测稀释液A 1:100稀释,稀释前根据预先计算好的每次实验所需的总量配制(100μl/孔),实际配制时应多配制0.1-0.2ml。
如10μl 检测溶液A加990μl检测稀释液A的比例配制,轻轻混匀,在使用前一小时内配制。
7. 检测溶液B:1×120μl/瓶(1:100)临用前以检测稀释液B 1:100稀释。

心脏型脂肪酸结合蛋白测定试剂盒(荧光免疫法)组成:每盒含相应规格人份检测卡和1份产品二维码(内含校准信息)。
每人份检测卡包括1份心脏型脂肪酸结合蛋白检测卡、1包干燥剂。
心脏型脂肪酸结合蛋白检测卡由PMMA镀膜、反应室(T线包被鼠抗人h-FABP单克隆抗体;C线包被羊抗鼠抗体)、荧光微球(荧光微球标记的鼠抗人h-FABP单克隆抗体)、吸水纸、塑料载板组成。
适用范围:本产品用于体外定量检测人全血、血清、血浆中心脏型脂肪酸结合蛋白含量。
1.1规格卡型1人份/盒、10人份/盒、20人份/盒、50人份/盒。
1.2组成每盒含相应规格人份检测卡和1份产品二维码(内含校准信息)。
每人份检测卡包括1份心脏型脂肪酸结合蛋白检测卡、1包干燥剂。
心脏型脂肪酸结合蛋白检测卡由PMMA镀膜、反应室(T线包被鼠抗人h-FABP单克隆抗体;C线包被羊抗鼠抗体)、荧光微球(荧光微球标记的鼠抗人h-FABP单克隆抗体)、吸水纸、塑料载板组成。
2.1物理性状2.1.1外观应整洁完整、无毛刺、无破损、无污染;材料附着牢固;标签字迹清晰,无破损。
2.1.2液体移行速度液体移行速度应不低于10 mm/min(到达Test区应低于2min)。
2.2空白限空白限应不高于2.5ng/mL。
2.3重复性分别用低、中、高3个浓度的心脏型脂肪酸结合蛋白样本液,测定变异系数CV(%)应不高于15.0%。
2.4批间差用3个批号试剂卡,分别检测低、中浓度的心脏型脂肪酸结合蛋白样本液相对极差R应不高于15.0%。
2.5线性在[2.5,50]ng/mL的范围内,用线性拟合公式拟合,相关系数应不低于0.990。
2.6准确度回收率应在85%~115%范围内。
2.7稳定性将检测试剂盒在4℃~30℃的环境中放置至有效期18个月后,分别检测2.1、2.2、2.3、2.5、2.6项,结果应符合各项目的要求。
心脏型脂肪酸结合蛋白检测试剂盒(胶体金免疫层析法)
适用范围:用于体外定性检测人血清、血浆和全血样本中心脏型脂肪酸结合蛋白(H-FABP)的含量。
1.1规格:20人份/盒和40人份/盒。
1.2组成:
2.1 物理性状
2.1.1液体组分应澄清透明、无沉淀或絮状物,铝箔袋应无破损漏气现象。
2.1.2液体试剂的净含量应不少于标示值。
2.1.3 液体移行速度应不低于10mm/min。
2.1.4 试纸条宽度应为4.5±0.1mm。
2.2 临界值
2.2.1取同一批试剂盒中的检测卡测定浓度为(8.4±0.84)ng/mL的样本20次,判定结果的阳性率应≥95%。
2.2.2取同一批试剂盒中的检测卡测定浓度为(5.6±0.56)ng/mL的样本20次,判定结果的阴性率应≥95%。
2.3 特异性
检测人血清白蛋白(HSA)及胆红素,反应结果应为阴性。
表1 与其它物质的交叉反应
2.4 批间差
取三批检测卡,分别测定浓度为(8.4±0.84)ng/mL的样本各20次,判定结果的阳性率应≥95%;测定浓度为(5.6±0.56)ng/mL的样本各20次,判定结果的阴性率应≥95%。
2.5 稳定性
本产品4~30℃保存有效期18个月,取到效期产品在2个月内进行检测,测定结果应符合上述2.1、2.2、2.3项要求。
专利名称:一种定量检测人心型脂肪酸结合蛋白的荧光免疫层析方法及其试剂盒
专利类型:发明专利
发明人:王秀利
申请号:CN201110453809.6
申请日:20111229
公开号:CN102520194A
公开日:
20120627
专利内容由知识产权出版社提供
摘要:本发明公开了一种定量检测人心型脂肪酸结合蛋白(hFABP)的荧光免疫层析方法及其试剂盒。
本发明的定量检测hFABP荧光免疫层析方法是利用量子点的优良荧光特性,结合双色标记技术及免疫层析技术,在优化试纸条各组成部件基础上,实现的荧光定量检测。
与常规胶体金免疫层析方法相比,本发明具有标记稳定性好、非特异性低、灵敏度高、线性范围宽以及定量准确的优势。
本发明试剂盒对hFABP进行的定量检测,可同时检测全血、血清及血浆样品,从而为急性心肌梗塞的早期筛查和预后评估提供了一种简便、准确、特异、价廉的检测工具,适用于各级医院,特别有助于在基层医院及诊所的广泛推广。
申请人:深圳康美生物科技股份有限公司
地址:518057 广东省深圳市南山区科丰路二号通讯工业大厦二楼东侧一号
国籍:CN
代理机构:深圳市深佳知识产权代理事务所(普通合伙)
代理人:唐华明
更多信息请下载全文后查看。
心型脂肪酸结合蛋白(H-FABP)测定试剂盒(胶乳免疫比浊法)适用范围:本产品用于体外定量测定人体血浆或血清中心型脂肪酸结合蛋白的含量。
1.1 规格试剂1(R1):1×60mL、试剂2(R2):1×15mL;试剂1(R1):2×60mL、试剂2(R2):2×15mL;试剂1(R1):1×16mL、试剂2(R2):1×4mL;试剂1(R1):1×19mL、试剂2(R2):1×7mL;试剂1(R1):2×20mL、试剂2(R2):2×20mL;试剂1(R1):1×20mL、试剂2(R2):1×20mL;试剂1(R1):1×10mL、试剂2(R2):1×10mL;试剂1(R1):1×5mL、试剂2(R2):1×5mL;试剂1(R1):2×60ml、试剂2(R2):2×20ml;试剂1(R1):2×60ml、试剂2(R2):2×12ml;试剂1(R1):4×60ml、试剂2(R2):2×40ml。
校准品(选配):6×1mL。
质控品(选配):2×1mL。
1.2 组成1.2.1试剂组成见表1:试剂1(R1),试剂2(R2)。
表1试剂组成1.2.2校准品的组成:六个水平的冻干校准品,在水基质中添加心型脂肪酸结合蛋白纯品(纯度:大于95%)。
定值范围:0ng/mL;(4-10) ng/mL;(10-20)ng/mL;(15-50)ng/mL;(40-80)ng/mL;(80-160)ng/mL。
1.2.3质控品的组成:两个水平的冻干质控品,在水基质中添加心型脂肪酸结合蛋白纯品(纯度:大于95%)。
定值范围:(2-10)ng/mL;(15-45)ng/mL。
2.1 外观液体双试剂:R1:无色至淡黄色澄清液体,R2:乳白色液体。
心型脂肪酸结合蛋白测定试剂盒 (胶乳免疫比浊法)适用范围:用于体外定量测定人血清或血浆中心型脂肪酸结合蛋白的含量。
1.1 包装规格表1 包装规格1.2 主要组成成分表2 主要组成成分2.1 外观试剂1为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂2为乳白色液体,目测不得有任何沉淀及絮状悬浮物;校准品为无色或淡黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;质控品为无色或淡黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂盒标签标识清晰,外包装完整无损。
2.2 净含量试剂的净含量应不少于标称量。
2.3 测定项目2.3.1 试剂空白吸光度试剂空白:A700nm下测定空白吸光度应≤ 1.8000。
2.3.2 准确度与已取得CE的产品进行比对试验:在[2.5,130]ng/ml区间内,相关系数r≥0.975,在[2.5,50] ng/ml区间内测定的绝对偏差应不超过±5ng/ml,在(50,130]ng/ml区间内测定的相对偏差应不超过±10%。
2.3.3 分析灵敏度样本浓度为20 ng/ml时,其吸光度变化在0.0100~0.0550之间。
2.3.4 线性区间在[2.5,130]ng/ml区间内,相关系数r≥0.990,在[2.5,50] ng/ml区间内测定的线性绝对偏差应不超过±5ng/ml,在(50,130]ng/ml区间内测定的线性相对偏差应不超过±10%。
2.3.5 测量精密度a)重复性对不同浓度的血清样本或质控品重复测定10次,其测定值的变异系数(CV%)应不大于10%。
b)批间差随机抽取三批试剂盒的批间相对极差(R)应≤10%。
2.4 稳定性试剂盒在2℃~8℃密封避光保存,有效期为12个月。
在试剂盒有效期满后一个月以内,分别检测2.1、2.3.1、2.3.2、2.3.3、2.3.4、2.3.5 a)项,结果应符合各项目的要求。
心脏型脂肪酸结合蛋白测定试剂盒(免疫比浊法)适用范围:用于体外定量测定人血清、血浆中心脏型脂肪酸结合蛋白(H-FABP)的含量。
1.1包装规格校准品(选配):1.0mL×1;1.0mL×2;1.0mL×5。
质控品(选配):1.0mL×1;1.0mL×2;1.0mL×5。
1.2主要组成成分校准品靶值批特异,详见校准品瓶签,质控品质控范围批特异,详见质控品瓶签。
2.1 外观试剂1为无色透明液体,试剂2为乳白色液体。
校准品、质控品为白色冻干品,复溶后为无色澄清液体。
试剂盒标签标识清晰,外包装完整无损。
2.2 装量试剂液体成分的装量不少于瓶签标示量。
2.3试剂空白在600nm处测定试剂空白吸光度,应≤1.5。
2.4分析灵敏度测试5 ng/mL的被测物时,吸光度变化(ΔA)≥0.01。
2.5空白限试剂盒的空白限≤1.0ng/mL。
2.6准确度待检系统与比对系统测值的相关系数(r)不小于0.975;在[2.0,15.0]ng/mL区间内,绝对偏差应不超过±1.8ng/mL;(15.0,120.0]ng/mL区间内,相对偏差应不超过±12%。
2.7线性2.7.1在[2.0,120.0]ng/mL区间内,线性相关系数r≥0.990;2.7.2在[2.0,15.0]ng/mL区间内,线性绝对偏差应不超过±1.8ng/mL;(15.0,120.0]ng/mL区间内,线性相对偏差应不超过±12%。
2.8精密度2.8.1重复性测试高、低两浓度样本,其结果的变异系数CV应≤10%。
2.8.2批间差随机抽取三批试剂盒测试同一份样本,批间相对极差(R)应≤12%。
2.8.3瓶内均匀性校准品,质控品的瓶内变异系数CV应≤10%。
2.8.4瓶间均匀性校准品、质控品的瓶间变异系数CV应≤10%。
2.9质控品的赋值有效性质控品检测结果应在其质控范围内。
2性能指标
2.1外观检查
外观应平整,材料附着应牢固,各组份应齐全。
2.2物理检查
膜条应不小于 2.5mm;液体移行速度应不低于 10mm/min。
2.3阳性参考品符合率
对 3 份阳性参考品进行检测,检测结果为阳性。
2.4阴性参考品符合率
对 5 份阴性参考品进行检测,检测结果为阴性。
2.5灵敏度
对灵敏度参考品进行检测,检测结果为阳性。
2.6精密度
2.6.1批内精密度
取同一批次试剂,对精密度参考品进行检测,重复检测 10 次,其反应结果应呈阳性,显色均一。
2.6.2批间精密度
取三个批次试剂,对精密度参考品进行检测,各重复检测 10 次,其反应结果应呈阳性,显色均一。
2.7分析特异性
在浓度为 25ng/mL 的阳性参考品中加入血红蛋白、甘油三酯和胆固醇,使得血红蛋白浓度≤5mg/mL、甘油三酯浓度≤30mg/mL和胆固醇浓度≤5mg/mL,重复检测 3 次,检测结果应为阳性。