2016届高考化学第一轮复习配套作业:第八章 高频考点真题验收全通关
- 格式:doc
- 大小:415.00 KB
- 文档页数:7
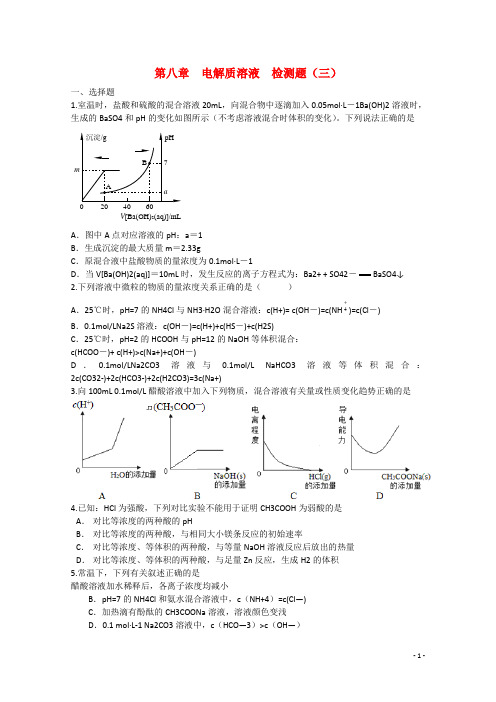
第八章 电解质溶液 检测题(三)一、选择题1.室温时,盐酸和硫酸的混合溶液20mL ,向混合物中逐滴加入0.05mol·L -1Ba(OH)2溶液时,生成的BaSO4和pH 的变化如图所示(不考虑溶液混合时体积的变化)。
下列说法正确的是V [Ba(OH)2(aq)]/mLA .图中A 点对应溶液的pH :a =1B .生成沉淀的最大质量m =2.33gC .原混合液中盐酸物质的量浓度为0.1mol·L -1D .当V[Ba(OH)2(aq)]=10mL 时,发生反应的离子方程式为:Ba2+ + SO42-BaSO4↓ 2.下列溶液中微粒的物质的量浓度关系正确的是( )A .25℃时,pH=7的NH4Cl 与NH3·H2O 混合溶液:c(H+)= c(OH -)=c(NH 4)=c(Cl -)B .0.1mol/LNa2S 溶液:c(OH -)=c(H+)+c(HS -)+c(H2S)C .25℃时,pH=2的HCOOH 与pH=12的NaOH 等体积混合:c(HCOO -)+ c(H+)>c(Na+)+c(OH -)D .0.1mol/LNa2CO3溶液与0.1mol/L NaHCO3溶液等体积混合:2c(CO32-)+2c(HCO3-)+2c(H2CO3)=3c(Na+)3.向100mL 0.1mol/L 醋酸溶液中加入下列物质,混合溶液有关量或性质变化趋势正确的是醋酸溶液加水稀释后,各离子浓度均减小B .pH=7的NH4Cl 和氨水混合溶液中,c (NH+4)=c(Cl —)C .加热滴有酚酞的CH3COONa 溶液,溶液颜色变浅D .0.1 mol·L-1 Na2CO3溶液中,c (HCO —3)>c (OH —)6.对H2O的电离平衡不产生影响的粒子是A.HCl B.13M3+C.CH3COO-D.+172887.下列说法正确的是A.Na2CO3溶液中加入少量Ca(OH)2 固体,CO32-水解程度减小,溶液的pH 减小B.25℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,V(醋酸)<V(NaOH) C.向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成D.CH3COOH 溶液加水稀释后,溶液中c(CH3COOH)c(CH3COO-)的值减小8.一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是()A.NaCl固体中没有离子B.NaCl溶液是电解质C.NaCl在水溶液中电离出了可以自由移动的离子D.NaCl溶液在电流作用下电离出大量的离子9.下列说法正确的是()A.易溶于水的物质一定是电解质B.液态氯化氢能导电C.液态氯化钠能导电D.熔融的液态钠是电解质10.常温下,下列各溶液的叙述中正确的是A. NaHSO3与Na2SO3混合溶液中:3c(Na+)=c(HSO3-)+c(SO32-)B. 0.1 mol/L 的醋酸钠溶液20 mL与0.1 mol/L盐酸10mL 混合后溶液显酸性:c(CH3COO-)>c(CH3COOH)>c(Cl-)>c(H+)C. 等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)=c(SO42-) >c ( NH4+)> c(H+)>c(OH-)D. 向1.00L 0.3 mol/L NaOH溶液中缓慢通入0.2 mol CO2气体,溶液中:c(Na+)>c(CO32-) >c(HCO3-)>c(OH-)> c(H+)11.图8是一水溶液在pH从0到14的范围内,H2CO3、HCO3-、CO32-三种成分平衡时的组成分数,下列叙述正确的是()图8A.此图是1.0 mol/L碳酸钠溶液滴定1.0 mol/L HCl溶液的滴定曲线B.在pH为6.37及10.25时,溶液中c(H2CO3) = c(HCO3-) = c(CO32-)C.人体血液的pH约为7.4,则CO2在血液中多以HCO3-的形式存在D.若用CO2和NaOH反应制取Na2CO3,溶液的pH必须控制在12以上12.常温下,向20 mL 0.2 mol /L H2A溶液中滴加0.2 mol /L NaOH溶液。

第五节胶体一、选择题1.将饱和FeCl溶液分别滴入下述液体中,能形成胶体的是()3A.冷水B.沸水C.NaOH浓溶液D.NaCl浓溶液解析:本题考查氢氧化铁胶体的制备:向沸腾的蒸馏水中逐滴加入1~2mL饱和FeCl溶液,3继续煮沸至液体呈红褐色,停止加热。
本题答案为选项B。
2.为了除去蛋白质溶液中混入的少量氯化钠,可以采用的方法是()。
A.过滤B.电泳C.渗析D.加入AgNO溶液,过滤3解析:渗析是利用膜对溶质的选择性透过的原理设计的一种物质分离的方法,实现不同性质溶质的分离,生物大分子不能通过半透膜,而氯离子和钠离子可以透过半透膜,从而达到分离的目的。
本题答案为选项C。
3.氯化铁溶液与氢氧化铁胶体具有的共同性质是()。
A.分散质颗粒直径都在1~100nm之间B.能透过半透膜C.加热蒸干、灼烧后都有氧化铁生成D.呈红褐色解析:溶液中分散质颗粒直径1~100nm,胶体分散质颗粒直径100nm,所以选项A错误;胶体不能透过半透膜,但是溶液中的分散质微粒是可以的,所以选项B错误。
氯化铁溶液呈黄色,氢氧化铁胶体呈红褐色,所以选项D错误。
本题答案为选项C。
4.已知由AgNO稀溶液与稍过量的KI稀溶液可制得AgI溶胶Ⅰ,由KI的稀溶液与稍过量的3AgNO溶液可制得AgI溶胶Ⅱ,则下列说法中正确的是()。
3A.Ⅰ和Ⅱ混合后,仍然是AgI溶胶B.Ⅰ中胶粒带正电荷,Ⅱ中胶粒带负电荷C.Ⅰ与Ⅱ混合后,将得到AgI沉淀D.Ⅰ与Ⅱ混合后既有溶胶又有沉淀解析:对于AgI胶体的带电性有两种情况:由AgNO稀溶液与稍过量的KI稀溶液可制得AgI3溶胶Ⅰ(这里的胶粒带负电荷),由KI的稀溶液与稍过量的AgNO溶液可制得AgI溶胶Ⅱ(这3里的胶粒带正电荷)。
混合后,胶粒带电荷相反,可以得到沉淀。
AgI胶体带电性是由反应物中用量大的决定的。
本题答案为选项C。
5.用200mL0.01mol/LKI溶液与150mL0.01mol/LAgNO溶液相互作用制得AgI溶胶,经渗3析后,下列说法中正确的是( )。

第一章高频考点真题验收全通关(把握本章在高考中考什么、怎么考,练通此卷、平步高考!)一、选择题(本题包括7小题,每小题6分,共42分)1.(2012·江苏高考)下列有关物质的性质与应用不相对应的是()A.明矾能水解生成Al(OH)3胶体,可用作净水剂B.FeCl3溶液能与Cu反应,可用于蚀刻印刷电路C.SO2具有氧化性,可用于漂白纸浆D.Zn具有还原性和导电性,可用作锌锰干电池的负极材料2.(2012·重庆高考)下列叙述正确的是()A.Fe与S混合加热生成FeS2B.NaHCO3的热稳定性大于Na2CO3C.过量的铜与浓硝酸反应有一氧化氮生成D.白磷在空气中加热到一定温度能转化为红磷3.(2011·上海高考)过氧化钠可作为氧气的来源。
常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了28 g,反应中有关物质的物理量正确的是(N A表示阿伏加德罗常数)()4.(2014·全国卷Ⅱ)下列反应中,反应后固体物质增重的是()A.氢气通过灼热的CuO粉末B.二氧化碳通过Na2O2粉末C.铝与Fe2O3发生铝热反应D.将锌粒投入Cu(NO3)2溶液5.(2012·安徽高考)已知室温下,Al(OH)3的K sp或溶解度远大于Fe(OH)3。
向浓度均为0.1 mol·L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH 溶液。
下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是()6.(2013·广东高考)下列实验的现象与对应结论均正确的是()7.(2011·福建高考)下表各选项中,不能利用置换反应通过Y得到W的一组化合物是()8.(10分)(2013·重庆高考)合金是建造航空母舰的主体材料。
(1) 航母升降机可由铝合金制造。
①工业炼铝的原料由铝土矿提取而得,提取过程中通入的气体为________。

回夺市安然阳光实验学校第8周周周清周六排查训练(本栏目内容,在学生用书中以形式分册装订!)一、原子结构1.判断正误(正确的打“√”,错误的打“×”)(1)质子数为17、中子数为20的氯原子:2017Cl(2015·江苏化学,2A)( )(2)氯离子(Cl-)的结构示意图:(2015·江苏化学,2B)( )(3)质子数为35、中子数为45的溴原子:8035Br(2014·江苏化学,2B)( )(4)中子数为146、质子数为92的铀(U)原子:14692U(2013·江苏化学,2D)( )(5)235 92U和238 92U是中子数不同质子数相同的同种核素(2012·天津理综,3C)( )(6)原子核内有18个中子的氯原子:3517Cl(2012·海南,9D)( )(7)在氮原子中,质子数为7而中子数不一定为7(2010·课标全国卷,7C)( )(8)通过化学变化可以实现16O与18O间的相互转化(2010·山东理综,9C)( )答案:(1)×(2)×(3)√(4)×(5)×(6)√(7)√(8)×2.[2014·重庆理综,8(1)(2)](1)3He是高效核能原料,其原子核内中子数为________。
(2)Na的原子结构示意图为__________,Na在氧气中完全燃烧所得产物的电子式为______________。
二、元素周期表元素周期律3.判断正误(正确的打“√”,错误的打“×”)(1)同主族元素含氧酸的酸性随核电荷数的增加而减弱(2014·山东理综)( )(2)Cl-、S2-、Ca2+、K+半径逐渐减小(2014·山东理综)( )(3)碱性:Ba(OH)2<Ca(OH)2<KOH(2013·重庆理综,3B)( )(4)第2周期元素从左到右,最高正价从+1递增到+7(2013·天津理综,3B)( )(5)同周期金属元素的化合价越高,其原子失电子能力越强(2013·天津理综,3D)( )(6)科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代了普通DNA链中的P元素(2013·浙江理综,7C)( )(7)第ⅠA族金属元素是同周期中金属性最强的元素(2012·山东理综,9B)( )(8)第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强(2011·天津理综,2C)( )(9)同周期元素(除0族元素外)从左到右,原子半径逐渐减小(2011·天津理综,2B)( )(10)根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7(2011·安徽理综,11B)( )答案:(1)×(2)×(3)×(4)×(5)×(6)√(7)√(8)×(9)√(10)×4.(2015·新课标全国卷Ⅰ)W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18。

第八章高频考点真题验收全通关(把握本章在高考中考什么、怎么考,练通此卷、平步高考!)一、选择题(本题包括7小题,每小题6分,共42分)1.(2014·福建高考)下列关于0.10 mol·L -1 NaHCO 3溶液的说法正确的是( ) A .溶质的电离方程式为NaHCO 3===Na ++ H ++ CO 2-3 B .25 ℃时,加水稀释后,n (H +)与n (OH -)的乘积变大C .离子浓度关系:c (Na +)+c (H +)=c (OH -)+c (HCO -3)+c (CO 2-3)D .温度升高,c (HCO -3)增大2.(2013·重庆高考)下列说法正确的是( )A .KClO 3和SO 3溶于水后能导电,故KClO 3和SO 3为电解质B .25 ℃时,用醋酸溶液滴定等浓度NaOH 溶液至pH =7,V 醋酸<V NaOHC .向NaAlO 2溶液中滴加NaHCO 3溶液,有沉淀和气体生成D .AgCl 沉淀易转化为AgI 沉淀且K (AgX)=c (Ag +)·c (X -),故K (AgI)<K (AgCl)3.(2014·全国卷Ⅰ)溴酸银(AgBrO 3)溶解度随温度变化曲线如下图所示。
下列说法错误的是( )A .溴酸银的溶解是放热过程B .温度升高时溴酸银溶解速度加快C .60 ℃时溴酸银的K sp 约等于6×10-4 D .若硝酸钾中含有少量溴酸银,可用重结晶方法提纯4.(2013·安徽高考)已知NaHSO 3溶液显酸性,溶液中存在以下平衡:HSO -3+H 2O H 2SO 3+OH -①HSO -3 H ++SO 2-3 ② 向0.1 mol·L -1的NaHSO 3溶液中分别加入以下物质,下列有关说法正确的是( )A .加入少量金属Na ,平衡①左移,平衡②右移,溶液中c (HSO -3)增大B .加入少量Na 2SO 3固体,则c (H +)+c (Na +)=c (HSO -3)+c (OH -)+12c (SO 2-3)C.加入少量NaOH溶液,c(SO2-3)c(HSO-3)、c(OH-)c(H+)的值均增大D.加入氨水至中性,则2c(Na+)=c(SO2-3)>c(H+)=c(OH-)5.(2012·安徽高考)氢氟酸是一种弱酸,可用来刻蚀玻璃。
已知25°C时:①HF(aq)+OH-(aq)===F-(aq)+H2O(l)ΔH=-67.7 kJ·mol-1②H+(aq)+OH-(aq)===H2O(l)ΔH=-57.3 kJ·mol-1在20 mL 0.1 mol·L-1氢氟酸中加入V mL 0.1 mol·L-1NaOH溶液。
下列有关说法正确的是A.氢氟酸的电离方程式及热效应可表示为:HF(aq) F-(aq)+H+(aq)ΔH=+10.4 kJ·mol-1B.当V=20时,溶液中:c(OH-)=c(HF)+c(H+)C.当V=20时,溶液中:c(F-)<c (Na+)=0.1 mol·L-1D.当V>0时,溶液中一定存在:c(Na+)>c(F-)>c(OH-)>c(H+)6.(2014·四川高考)下列溶液中粒子的物质的量浓度关系正确的是()A.0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO2-3)>c(HCO-3)>c(OH-)B.20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)C.室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH+4)+c(OH-)D.0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH)7.(2013·江苏高考改编)一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示。
已知:pM=-lg c(M),p(CO2-3)=-lg c(CO2-3)。
下列说法正确的是()①MgCO3、CaCO3、MnCO3的K sp依次增大②a点可表示MnCO3的饱和溶液,且c(Mn2+)=c(CO2-3)③b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO2-3)④c点可表示MgCO3的不饱和溶液,且c(Mg2+)<c(CO2-3)A.①②B.②③C.①③D.②④二、非选择题(本题包括4个小题,共58分)8.(14分)(2014·上海高考)硫在自然界中以游离态和多种化合态形式出现。
硫的化合物大多具有氧化性或还原性。
许多金属硫化物难溶于水。
完成下列填空:(1)硫化氢具有还原性,可以和许多氧化剂反应,在酸性条件下,H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式:________________________________________________________________________________________________________________________________________________。
(2)石油化工的废气中有H2S,写出从废气中回收单质硫的两种方法(除空气外,不使用其他原料),以化学方程式表示:________________________________________________。
(3)室温下,0.1 mol·L-1的硫化钠溶液和0.1 mol·L-1的碳酸钠溶液,碱性更强的是________,其原因是___________________________________________________________。
已知:H2S:K i1=1.3×10-7K i2=7.1×10-15H2CO3:K i1=4.3×10-7K i2=5.6×10-11(4)向ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加一定量的氨水后,生成ZnS沉淀,用电离平衡原理解释上述现象:_____________________________________。
(5)将黑色的Fe2S3固体加入足量盐酸中,溶液中有淡黄色固体生成,产物还有________、________。
过滤,微热滤液,然后加入过量氢氧化钠溶液,可观察到的现象是____________________________。
9.(15分)(2012·江苏高考)废弃物的综合利用既有利于节约资源,又有利于保护环境。
实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)回收Cu并制备ZnO的部分实验过程如下:(1)①铜帽溶解时加入H2O2的目的是________________________________________(用化学方程式表示)。
②铜帽溶解完全后,需将溶液中过量的H2O2除去。
除去H2O2的简便方法是__________。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。
实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。
上述过程中反应的离子方程式如下:2Cu2++4I-===2CuI(白色)↓+I22S2O2-3+I2===2I-+S4O2-6①滴定选用的指示剂为________,滴定终点观察到的现象为________________________________________________________________________。
②若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会________(填“偏高”“偏低”或“不变”)。
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成2-。
下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
实验中可选用的试剂:30%H2O2、1.0 mol·L-1HNO3、1.0 mol·L-1NaOH。
由除去铜的滤液制备ZnO的实验步骤依次为:①________________________________________________________________________;②________________________________________________________________________;③过滤;④___________________________________________________________;⑤过滤、洗涤、干燥;⑥900℃煅烧。
10.(14分)(2013·北京高考)用含有Al2O3、SiO2和少量FeO·x Fe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下(部分操作和条件略):Ⅰ.向铝灰中加入过量稀H2SO4,过滤;Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;Ⅳ.加入MnSO4至紫红色消失,过滤;Ⅴ.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解Al2O3的离子方程式是_______________________________________。
(2)将MnO-4氧化Fe2+的离子方程式补充完整:1MnO-4+Fe2++______===1Mn2++Fe3++______。
(3)已知:生成氢氧化物沉淀的pH注:金属离子的起始浓度为0.1 mol·L-1根据表中数据解释步骤Ⅱ的目的:________________________________________________________________________ ________________________________________________________________________。
(4)已知:一定条件下,MnO-4可与Mn2+反应生成MnO2。
①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是________________________________________________________________________。