第四章非晶态结构与性质
- 格式:doc
- 大小:450.03 KB
- 文档页数:31

非晶态材料的电子结构与性质非晶态材料是一种特殊的材料,其结构不具有长程有序性,而是呈现无规则的结构排列。
与晶态材料相比,非晶态材料具有许多独特的电子结构和性质。
本文将探讨非晶态材料的电子结构与性质,并介绍其在实际应用中的潜力。
首先,非晶态材料的电子结构与晶态材料有着很大的差异。
晶态材料的原子排列具有周期性,因此其电子能带结构也呈现出禁带和能带分裂等特点。
与之不同,非晶态材料中的原子无规则排列,并且在小尺寸区域内存在着较大的原子间距离变化。
这种无规则性导致了非晶态材料在能带结构上的复杂性和多样性。
其次,非晶态材料的电子结构对其性能具有重要影响。
由于非晶态材料的电子能带结构复杂多样,因此其导电性、光学性质和磁性等特性也相对复杂。
举个例子,非晶态硅在光学方面的性质与晶态硅有着显著差异。
晶态硅是一种典型的半导体材料,其禁带宽度较大,只能吸收较高能量的光线。
而非晶态硅由于其复杂的电子能带结构,能够吸收更宽波长范围的光线,因此在光电转换和太阳能电池等领域有着广泛的应用潜力。
此外,非晶态材料的电子结构也对其力学性能产生了显著影响。
非晶态金属玻璃是一种具有非晶态结构的金属材料。
由于其原子具有无序排列,非晶态金属玻璃具有超高的硬度和强度。
研究发现,非晶态金属玻璃的导电性依赖于电子态密度和电子局域化程度。
这种密切的关联性使得非晶态材料在设计高强度和高导电性的材料时具有潜在优势。
值得一提的是,非晶态材料的电子结构与性质也与制备方法和组成元素有关。
通过不同的制备方法和合金化调控,可以改变非晶态材料的电子能带结构,从而调控其性能。
例如,通过控制金属原子尺寸和含量,可以调节非晶态合金材料的磁性和导电性。
这种灵活性使得非晶态材料在设计可调控性能的材料时具有巨大潜力。
综上所述,非晶态材料的电子结构与性质是传统晶态材料所不具备的独特特点。
其复杂多样的电子能带结构决定了非晶态材料在导电性、光学性质和力学性能等方面的特殊性。
通过调控非晶态材料的电子结构,人们可以设计出具有特殊功能和优异性能的材料,这将为材料科学和工程领域的发展带来巨大的潜力。


第4章非晶态构造与性质一、名词解释1.熔体与玻璃体:熔体即具有高熔点的物质的液体。
熔体快速冷却形成玻璃体。
2.聚合与解聚:聚合:各种低聚物相互作用形成高聚物解聚:高聚物分化成各种低聚物3.晶子学说与无规那么网络学说:晶子学说〔有序、对称、具有周期性的网络构造〕:1硅酸盐玻璃中含有无数的晶子2晶子的互相组成取决于玻璃的化学组成3晶子不同于一般微晶,而是带有晶体变形的有序区域,在晶子中心质点排列较有规律,远离中心那么变形程度增大4晶子分散于无定形物质中,两者没有明显界面无规那么网络学说〔无序不对称不具有周期性的网络构造〕1形成玻璃态的物质与晶体构造相类似,形成三维的空间网格构造2这种网络是离子多面体通过氧桥相连进而向三维空间规那么-4.网络形成体与网络变性体:网络形成体:能够单独形成玻璃的氧化物网络变性体:不能单独形成玻璃的氧化物5.桥氧与非桥氧:桥氧:玻璃网络中作为两个成网多面体所共有顶角的氧非桥氧:玻璃网络中只与一个成网多面体相连的氧二、填空与选择1.玻璃的通性为:各向同性、介稳性、由熔融态向玻璃态转化是可逆与渐变的,无固定熔点、由熔融态向玻璃态转化时,物理、化学性质随温度的变化连续性和物理化学性质随成分变化的连续性。
2.氧化物的键强是形成玻璃的重要条件。
根据单键强度的大小可把氧化物中的正离子分为三类:网络形成体、网络中间体和网络改变体;其单键强度数值范围分别为单键强度>335KJ/mol、单键强度介于250~335KJ/mol 和单键强度<250~335KJ/mol。
3.聚合物的形成可分为三个阶段,初期:石英颗粒的分化;中期:缩聚与变形;后期:在一定时间内分化与缩聚到达平衡。
4.熔体构造的特点是:近程有序、远程无序。
5.熔体是物质在液相温度以上存在的一种高能量状态,在冷却的过程中可以出现结晶化、玻璃化和分相三种不同的相变过程。
-6.在玻璃性质随温度变化的曲线上有二个特征温度Tg〔脆性温度〕和Tf 〔软化温度〕,与这二个特征温度相对应的粘度分别为1012Pa·s和108Pa·s。

非晶态材料的结构和性质探究随着科学技术的不断发展,材料科学领域中有一个重要的分支——非晶态材料。
相较于晶态材料,非晶态材料具有更多的特殊性质,广泛应用于电子、光学、力学等众多领域。
本文将探究非晶态材料的结构和性质,着重讲解非晶态材料相变过程中的特性。
一、非晶态材料的特性非晶态材料是一种无序的结构状态,其原子或分子排列没有规则性可循。
这种无序状态可以使得非晶态材料具有比晶态材料更好的性质,例如:1. 力学性质:非晶态材料具备比晶态材料更高的强度和更好的韧性,因为其无序结构可以吸收更多的能量,从而避免应力集中的发生。
2. 热学性质:非晶态材料比晶态材料更好地维持其形状和结构,因为其良好的热稳定性可以防止晶界不稳定,使受热材料没有破裂的风险。
3. 电学性质:非晶态材料有时比晶态材料具有更好的导电性和磁性,因为其无序性使电子和电离子的移动更容易,比如非晶态碳材料、非晶态合金等。
二、非晶态材料的制备方法非晶态材料的制备方法多样,其中最常见的有:1. 溅射法:利用高能量离子束轰击原材料,将离子以固体形式沉积到厚度为20~100nm的基板上,形成非晶态薄膜材料。
2. 快速凝固法:将液态金属流淌在高温基底板上,迅速冷却至极低温度(20K),从而得到非晶态合金材料。
3. 机械法:通过机械磨粉、球磨、冲击等方式制备纳米非晶态材料。
三、非晶态材料的相变过程相变是指物质由一种状态转变为另一种状态的过程。
相较于晶态材料,非晶态材料的相变过程更加独特和复杂。
以非晶态金属为例,在高温下它们呈现出非晶态,但当温度下降时,非晶态材料会发生玻璃-金属相变,这种相变通常被称为相变前的热事件(Tg)和相变后的热事件(Tx)。
Tg是非晶态材料从固体状态转变为液体状态的温度,此时其结构变得更加有序;而Tx则是非晶态材料从玻璃状态转变为金属状态的温度,此时不光温度变化,而且其结构改变也十分复杂。
Tg 和Tx温度升高或降低对材料的性质产生重要影响。

第四章非晶态结构与性质4-3试用实验方法鉴别晶体SiO2、SiO2玻璃、硅胶和SiO2熔体。
它们的结构有什么不同?解:利用X射线检测。
晶体SiO2——质点在三维空间做有规律的排列,各向异性。
SiO2熔体——内部结构为架状,近程有序,远程无序。
SiO2玻璃——各向同性。
硅胶——疏松多孔。
4-4影响熔体粘度的因素有哪些?试分析一价碱金属氧化物降低硅酸盐熔体粘度的原因。
解:(1)影响熔体粘度的主要因素:温度和熔体的组成。
碱性氧化物含量增加,剧烈降低粘度。
随温度降低,熔体粘度按指数关系递增。
(2)通常碱金属氧化物(Li2O、Na2O、K2O、Rb2O、Cs2O)能降低熔体粘度。
这些正离子由于电荷少、半径大、和O2-的作用力较小,提供了系统中的“自由氧”而使O/Si比值增加,导致原来硅氧负离子团解聚成较简单的结构单位,因而使活化能减低、粘度变小。
4-5熔体粘度在727℃时是107Pa·s,在1156℃时是103 Pa·s,在什么温度下它是106 Pa·s?解:根据727℃时,η=107Pa·s,由公式得:(1)1156℃时,η=103 Pa·s,由公式得:(2)联立(1),(2)式解得∴A=-6.32,B=13324当η=106 Pa·s时,解得t =808.5℃。
4-14影响玻璃形成过程中的动力学因素是什么?结晶化学因素是什么?试简要叙述之。
解:影响玻璃形成的关键是熔体的冷却速率,熔体是析晶还是形成玻璃与过冷度、粘度、成核速率、晶体生长速率有关。
玻璃形成的结晶化学因素有:复合阴离子团大小与排列方式,键强,键型。
4-16有两种玻璃其组成(mol%)如下表,试计算玻璃的结构参数,并比较两种玻璃的粘度在高温下何者大?解:1号:Z=4,Al3+被视为网络形成离子X1=2R-Z=0.5,Y1=4-0.5=3.52号:Z=4,Al3+被视为网络改变离子X2=2R-Z=1.5,Y2=4-1.5=2.5Y1>Y2 高温下1号玻璃的粘度大。





非晶态材料的结构与性质研究非晶态材料是一种具有特殊结构的材料,无定形、无序分布的原子构成了它们的基本单元,同时它们也具有高度的随机性和失序性。
非晶态材料是过渡态材料,介于晶体与液体之间,与晶体不同,它们没有规则的晶格结构,因此也不能被描述为任意结构的重复单元。
近年来,随着人类对材料科学的深入理解和研究的深入,越来越多的科学家开始关注和研究这种神秘的非晶态材料。
本文将从结构和性质两个方面入手,探究非晶态材料的内在特性和可应用性。
一、非晶态材料的结构非晶态材料的结构复杂多样,通常由不规则紧密排列、缺陷集中分布、混合原子成分以及纳米结构构成。
它们无长程有序,但却存在近程有序和阻止原子自由运动的局域约束作用。
非晶态材料中,无法使用晶体的周期性函数或者Bravais格子来描述它们的结构,也无法使用晶体学的方法来解析其晶格常数及对称性。
非晶态材料常被描述为“准晶体”,这也是由于非晶态材料具有与晶体类似的物理化学性质。
比如,强度、硬度、模量等性质,甚至比晶体更好,在某些应用领域中可以更好地发挥作用。
从宏观的角度来看,非晶态材料呈现出均匀的特性,因此在某些特定环境下可以用来代替晶体材料。
二、非晶态材料的性质非晶态材料的性质是其结构所决定的。
由于非晶态材料无晶体的周期性结构,因此其物理和化学性质通常比晶体更为复杂。
一些特定的结构和性质常常应用于制备晶体。
在结构上,是由于非晶体中局部约束作用的存在以及无序的结构总体所导致的。
在性质上,非晶态材料的特点是自组装的能力、缺陷密度大、力学性能优秀、高温应用能力好、表面结构多元化、电子性能有优势、生物活性等多种特殊性质的组合。
自组装性是非晶态材料的一个显著特点。
由于其内部的局部约束作用,非晶态材料有一定程度的自组装能力。
这意味着它们可以自行形成结构和形状。
这一特点使得非晶态材料被广泛应用于材料科学,例如,它们被用于制备介电材料、金属玻璃、纳米材料等领域。
缺陷密度高是非晶态材料的另一个特点。
非晶态材料的物理和化学性质非晶态材料是一类特殊的材料,其结构并不像晶态材料那样有序排列,而是一种无序的、非周期性的结构。
非晶态材料由于其独特的结构和性质,被广泛应用于许多领域,如电子、能源、航空航天和医疗等领域。
本文将从物理和化学两个方面介绍非晶态材料的性质。
物理性质1. 密度非晶态材料与晶态材料相比,其密度较高。
这主要是由于非晶态材料的原子间距较短,相邻原子距离较小导致的。
比如,非晶态金属玻璃(BMG)的密度通常比同种金属的晶态高5%至10%。
2. 基本磁性质非晶态材料的磁性质以及磁学行为的研究是材料物理学领域的研究热点。
非晶态材料中,由于原子之间的无序性,电子的自旋在空间分布上也呈现出无规律性分布,因此对磁性有着显著的影响。
例如,磁记忆合金等材料,使用在高灵敏度磁传感器中,能够反应非常细微的磁场变化。
3. 超导性质非晶态材料中存在一种二维超导现象,即由于层状结构中的原子无序排列,可以造成电子在横向进行导电的过程中,发生了一些特殊的效应。
这种超导性质的出现极大地改变了超导体研究的现状,不仅对物理学领域有很大的作用,还对制造医疗、能源学等领域具有重要的实际应用价值。
4. 弹性性质非晶态材料核心构造过程所产生的氧化、固化以及空气中的各类设计使其微观数量水平的结构和性质变得更为坚韧,耐用,兼具弹性特性。
对一些板和杆类制品而言,这种高弹性性能成为所以具有很强的优势。
化学性质1. 相对于晶体材料,更容易形成玻璃在材料工业生产中,有时需要一定形状和尺寸改变的材料,然而这些晶体材料生产出来之后不容易改变其尺寸或形状,这时就需要非晶态材料。
非晶态材料不像晶体材料那样有序排列,因此在其加热制造过程中,形成一定的好处。
特别是高分子塑料玻璃,尤其适合这种特殊性质,并成为制造玻璃器皿和仪器的首选材料。
2. 优异的表面活性和吸附性能非晶态材料在物理结构上具有许多规则性,其中一个最显着的特征是不对称性因素,例如吸附能和界面能等都常常有小而重要的变化。
第四章非晶态结构与性质4-1名词解释熔体与玻璃体分化(解聚)与缩聚网络形成体网络中间体网络改变体桥与非桥氧硼反常现象单键强度晶子学说与无规则网络学说4-2试简述硅酸盐熔体聚合物结构形成的过程和结构特点。
4-3试用实验方法鉴别晶体SiO2、SiO2玻璃、硅胶和SiO2熔体。
它们的结构有什么不同?4-4 试述石英晶体、石英熔体、Na2O·2SiO2熔体结构和性质上的区别。
4-5影响熔体粘度的因素有哪些?试分析一价碱金属氧化物降低硅酸盐熔体粘度的原因。
4-6熔体粘度在727℃时是107Pa·s,在1156℃时是103 Pa·s,在什么温度下它是106 Pa·s?(用lnη=A+B/T解之)4-7 SiO2熔体的粘度在1000℃时为1014 Pa·s,在1400℃时为107 Pa·s。
SiO2玻璃粘滞流动的活化能是多少?上述数据为恒压下取得,若在恒容下获得,你认为活化能会改变吗?为什么?4-8一种熔体在1300℃的粘度是310 Pa·s,在800℃是107 Pa·s,在1050℃时其粘度为多少?在此温度下急冷能否形成玻璃?4-9试用logη=A+B/(T-T0)方程式,绘出下列两种熔体在1350~500℃间的粘度曲线(logη~1/T)。
两种熔体常数如下:4-10派来克斯(Pyrex)玻璃的粘度在1400℃时是109 Pa·s,在840℃是1013Pa·s。
请回答:(1)粘性流动活化能是多少?(2)为了易于成形,玻璃达到105Pa·s的粘度时约要多高的温度?4-11一种玻璃的工作范围是870℃(η=106Pa·s)至1300℃(η=102.5Pa·s),估计它的退火点(η=1012Pa·s)?4-12一种用于密封照明灯的硼硅酸盐玻璃,它的退火点是544℃,软化点是780℃。
非晶态物质的结构与性质在我们的生活中,大部分的物质都是晶体。
晶体是一种有序的结构,它们的分子排列方式是高度固定的,因此晶体的形态也非常规则。
相比之下,非晶态物质则是分子有序排列的一种极端形式,它们的结构没有规则性,因此可以有很多不同的形态和性质。
在本文中,我们将探讨非晶态物质的结构和性质。
什么是非晶态物质?非晶态物质通常被认为是一种“无序”的结构。
简单来说,它们是没有长程有序性的物质,但在局部区域内分子之间可以有一定的“短程有序”。
这意味着分子之间的排列方式不是高度规则的,而是有所波动的。
非晶态物质可以出现在固体、液体和气体状态下,例如玻璃、塑料、橡胶和氧化硅等。
非晶态物质的结构非晶态物质的结构是非常复杂的,因为它们涉及到多个长度尺度上的无序性。
在小尺度上,在分子排列的局部区域内,非晶态物质可能会有一定的短程有序性。
这种局部有序性是由于物质的制备过程中,诸如原子或分子的排列方式不完全随机所导致的。
由于非晶态物质没有长程有序性,其原子和分子的排列方式不会出现周期性的重复。
这也使得非晶态物质的结构非常难以确定。
通常,人们使用散射技术来研究非晶态物质的结构。
这些散射技术包括X射线散射、中子散射、电子衍射以及光散射等技术。
非晶态物质的性质因为非晶态物质的结构没有规则性,所以它们有许多不同于晶体的性质。
本节将会讨论一些非晶态物质特有的性质。
1. 均匀性非晶态物质通常具有非常均匀的结构和成分分布。
这是由于非晶态物质没有周期性结构,使得其分子结构和成分分布在空间上更加均匀。
2. 可塑性非晶态物质通常具有非常好的可塑性。
这是由于其独特的结构,非晶态物质中的分子可以非常容易地滑动,从而使它能够产生大变形而不断裂。
3. 高温稳定性非晶态物质通常具有非常好的高温稳定性。
在高温下,晶体由于其有序排列被破坏而失去了稳定性,而非晶态物质由于其无序方式排列而保持稳定。
这使得一些高温应用中需要具有稳定性的材料,如汽车引擎零件和高温耐受的陶瓷,能够被制造出来。
非晶态材料的结构与性质非晶态材料,又称无定形材料或非晶材料。
与晶态材料不同,它们没有经过晶化,也就是说它们的分子没有像晶体一样有序排列。
这些化合物往往是由由金属、半导体或塑料构成的合金或陶瓷,有着非常特殊的性质。
本文将探讨非晶态材料的结构与性质,并探索其在现代工业中的应用。
一、非晶态材料的结构非晶态材料的结构比较难以描述,因为它们不是经过晶体结构有序排列的。
与之对应的,相对应于晶格的是非定向的、无规则的玻璃态;相对于晶体中的原子位置周期性排列,非晶体中的原子位置则是凌乱无序的。
在晶体中,原子的排列是周期性、有序的,而在非晶质中,在几近无序的背景下,原子与原子之间只有短程有序,也就是说,原子之间的距离与平均含量是变化无常且不依赖于空间位置的。
非晶态材料也可以看成是一个微小晶体组成的复合材料,不同晶粒的尺寸从几十Å到几百Å不等,而每个晶粒内的原子则分布得比晶体中原子分布更为凌乱。
二、非晶态材料的性质相比于晶态材料,在非晶态材料中,由于没有晶格,材料的物理性质更加复杂与难以描述。
以下将会介绍几个典型的非晶态材料的性质:1. 坚硬度高:许多非晶态金属材料的硬度都非常高,高达1500-1600HM,相比之下,很多晶体金属材料都只有100-600HM的硬度。
2. 形状记忆效应强:非晶态合金在各种情况下都有优秀的形态回复和形状记忆效应,这让它们在制造高弹性元器件时更加适用。
3. 震动阻尼性能强:非晶态合金的震动阻尼性能非常高,可以有效地抑制振动响应,这对于航空航天等领域有着十分广泛的应用。
4. 导电性能优异:非晶态的金属材料也有一些优秀的导电性能,可以作为微电子元器件的制造材料。
三、非晶态材料的应用除了上述提到的性质外,非晶态材料还具有较好的抗腐蚀性、抗疲劳性能和良好的潜变行为。
因此,非晶态材料在现代工业中的应用越来越广泛。
以下是几种常见的应用:1. 磁存储材料:非晶态磁性材料是计算机、电子元器件及储存介质等高科技产品中必不可少的基础材料。
第四章非晶态结构与性质4-1名词解释熔体与玻璃体分化(解聚)与缩聚网络形成体网络中间体网络改变体桥与非桥氧硼反常现象单键强度晶子学说与无规则网络学说4-2试简述硅酸盐熔体聚合物结构形成的过程和结构特点。
4-3试用实验方法鉴别晶体SiO2、SiO2玻璃、硅胶和SiO2熔体。
它们的结构有什么不同?4-4 试述石英晶体、石英熔体、Na2O·2SiO2熔体结构和性质上的区别。
4-5影响熔体粘度的因素有哪些?试分析一价碱金属氧化物降低硅酸盐熔体粘度的原因。
4-6熔体粘度在727℃时是107Pa·s,在1156℃时是103 Pa·s,在什么温度下它是106 Pa·s?(用lnη=A+B/T解之)4-7 SiO2熔体的粘度在1000℃时为1014 Pa·s,在1400℃时为107 Pa·s。
SiO2玻璃粘滞流动的活化能是多少?上述数据为恒压下取得,若在恒容下获得,你认为活化能会改变吗?为什么?4-8一种熔体在1300℃的粘度是310 Pa·s,在800℃是107 Pa·s,在1050℃时其粘度为多少?在此温度下急冷能否形成玻璃?4-9试用logη=A+B/(T-T0)方程式,绘出下列两种熔体在1350~500℃间的粘度曲线(logη~1/T)。
两种熔体常数如下:4-10派来克斯(Pyrex)玻璃的粘度在1400℃时是109 Pa·s,在840℃是1013Pa·s。
请回答:(1)粘性流动活化能是多少?(2)为了易于成形,玻璃达到105Pa·s的粘度时约要多高的温度?4-11一种玻璃的工作范围是870℃(η=106Pa·s)至1300℃(η=102.5Pa·s),估计它的退火点(η=1012Pa·s)?4-12一种用于密封照明灯的硼硅酸盐玻璃,它的退火点是544℃,软化点是780℃。
非晶态材料的结构和性质从古至今,材料科学一直是人类探究物质本质的重要领域。
而随着科技的不断发展,新型材料的研究和应用也是越来越引人瞩目。
其中,非晶态材料因其独特的结构和性质,备受关注。
本文将对非晶态材料的结构和性质进行分析和探讨。
一、非晶态材料的结构首先,我们来了解什么是非晶态材料。
非晶态材料又称为无定形材料,其最主要的特点就是缺乏结晶。
在结晶的材料中,原子或分子以一定的规律排列成晶体结构。
而在非晶态材料中,这些原子或分子呈现出一种无序的排列状态,这是它独特的结构。
具体来说,在非晶态材料中,原子或分子的排列呈现出类似于液体的状态,缺乏长程的周期性结构。
而这种无序排列的状态,正是非晶态材料独特性质的基础。
二、非晶态材料的性质在结晶材料中,晶格结构的确定和相互作用的复杂性对材料的性质有着至关重要的影响。
而非晶态材料的缺乏结晶,则意味着其物理和化学性质可能完全不同于晶体材料。
2.1 高硬度和强韧性首先,非晶态材料的高硬度和强韧性是其独特性质之一。
比如非晶态金属材料可以达到毫米级别的高弹性模量和高硬度,而且材料强度在拉伸时无明显脆性断裂的现象。
这些高机械性能是结晶材料所不具备的。
2.2 超强的抗腐蚀性其次,非晶态材料还具有超强的抗腐蚀性能。
比如很多非晶态合金材料可以在极端环境下,如酸和碱的腐蚀、高温和高压下长时间稳定存在,而且具有很高的耐腐蚀性。
这地取代了传统的耐腐蚀材料,如不锈钢和钛合金等。
2.3 特殊的磁性非晶态材料还具有独特的磁性。
比如费米面附近的能级密度很高,使得非晶态磁性材料可以达到很高的饱和磁化强度和低的磁晶各向异性,使其可用于磁性传感和数据存储设备等领域。
三、非晶态材料的应用由于非晶态材料的独特结构和性质,其应用范围也相当广泛。
3.1 军事领域在军事领域中,非晶态材料主要应用在弹头、装甲材料和悬挂设计等领域。
比如非晶态合金材料可以极大地提高弹头的穿透能力,使其能够有效打击敌方装甲车辆。
3.2 磁性领域在磁性领域中,非晶态材料主要应用于磁性传感器、磁存储器、电机和变压器等设备。
第四章非晶态结构与性质内容提要熔体和玻璃体是物质另外两种聚集状态。
相对于晶体而言,熔体和玻璃体中质点排列具有不规则性,至少在长距离范围结构具有无序性,因此,这类材料属于非晶态材料。
从认识论角度看,本章将从晶体中质点的周期性规则形排列过渡到质点微观排列的非周期性、非规则性来认识非晶态材料的结构和性质。
熔体特指加热到较高温度才能液化的物质的液体,即较高熔点物质的液体。
熔体快速冷却则变成玻璃体。
因此,熔体和玻璃体是相互联系、性质相近的两种聚集状态,这两种聚集状态的研究对理解无机材料的形成和性质有着重要的作用。
传统玻璃的整个生产过程就是熔体和玻璃体的转化过程。
在其他无机材料(如陶瓷、耐火材料、水泥等)的生产过程中一般也都会出现一定数量的高温熔融相,常温下以玻璃相存在于各晶相之间,其含量及性质对这些材料的形成过程及制品性能都有重要影响。
如水泥行业,高温液相的性质(如粘度、表面张力)常常决定水泥烧成的难易程度和质量好坏。
陶瓷和耐火材料行业,它通常是强度和美观的有机结合,有时希望有较多的熔融相,而有时又希望熔融相含量较少,而更重要的是希望能控制熔体的粘度及表面张力等性质。
所有这些愿望,都必须在充分认识熔体结构和性质及其结构与性质之间的关系之后才能实现。
本章主要介绍熔体的结构及性质,玻璃的通性、玻璃的形成、玻璃的结构理论以及典型玻璃类型等内容,这些基本知识对控制无机材料的制造过程和改善无机材料性能具有重要的意义。
4.1 熔体的结构一、对熔体的一般认识自然界中,物质通常以气态、液态和固态三种聚集状态存在。
这些物质状态在空间的有限部分则称为气体、液体和固体。
固体又分为晶体和非晶体两种形式。
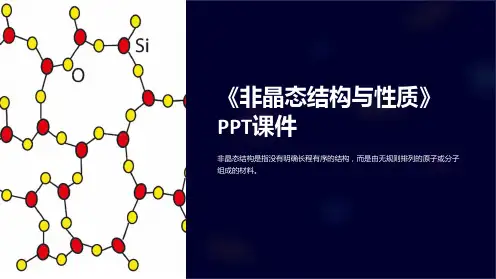
晶体的结构特点是质点在三维空间作规则排列,即远程有序;非晶体包括用熔体过冷而得到的传统玻璃和用非熔融法(如气相沉积、真空蒸发和溅射、离子注入等)所获得的新型玻璃,也称无定形体,其结构特点是近程有序,远程无序。
习惯上把高熔点物质的液体称为熔体(指熔点温度以上,具有一定流动性的液体),所以对于硅酸盐来说,它的液体一般称之为熔体。
熔体或液体介于气体和晶体之间,高温时其结构状态接近气体,在低温时接近晶体。
可从以下几个方面来说明通常所接触到的熔体,其结构更接近于晶体。
(一)通常的熔体是处于离熔点不远的状态以H2O为例,其冰的熔点为0℃,水的汽化点为100℃,所以通常所研究的水(常温液态H2O)是处于离熔点不远的状态。
硅酸盐物质的熔点一般都很高,多数处于1000℃以上,而所研究的熔体都只比熔点高几百度,即远离气化点,处于靠近熔点的温度,这时的熔体状态更接近于晶体。
(二)固体熔融时体积变化不大晶体转化为液体时,体积变化ΔV<10%;SiO2转化为液体时,体积变化ΔV<3%。
说明:固体和液体中的质点之间距离变化不大。
(三)固体熔化热比液体气化热小得多冰的熔化热为6.02 kJ/mol,而水的气化热为40.40 kJ/mol熔化热Na:2.51 k J/molZn:6.69 kJ/mol说明:固体和液体的内能差别不大,即内部质点之间作用力差别不大。
(四)固液态热容相近表4-1 几种金属固、液态时的热容值物质名称Pb Cu Sb Mn 固体热容(J/mol)27.30 31.11 29.81 46.47液体热容(J/mol)28.47 31.40 29.94 46.06 说明:液体中质点的热运动状态与固体中相类似,即基本上仍是在平衡位置作谐振动。
(五)X射线衍射图相似图4-1 不同聚集状态物质的X射线衍射强度随入射角度变化的分布曲线1-晶体;2-玻璃体;3-熔体;4-气体图4-1中θ为X射线衍射角,即X射线入射光与晶面之间的夹角。
曲线1—晶体:衍射强度时强时弱,在不同θ处出现尖锐的衍射“峰”;4—气体:小角度衍射衍射强度很大,并随θ值的增大逐渐减弱,没有“峰”或类似的“峰”出现;3—熔体:相当于晶体对应衍射峰位置出现突起,呈现宽阔的衍射“峰”,无气体所特有的的小角度衍射;2-玻璃体:与熔体衍射峰近似,衍射峰最高点的位置与晶体相近。
由以上分析可以认为,在高于熔点不太多的温度下,熔体内部质点的排列不象气体那样杂乱无章,而是具有某种程度的规律性,即体现了熔体近程有序和远程无序的结构特征,熔体中某一质点最邻近的几个质点的排列形式与间距和晶体中的相似;熔体衍射图中衍射峰都很宽阔,这与熔体质点的有规则排列区域的高度分散有关。
玻璃体的衍射图与熔体相似,说明玻璃在很大程度上继承了熔体的结构。
二、硅酸盐熔体结构(一)硅酸盐熔体中的质点单元一般盐类的熔体结构质点是简单的分子、原子或离子。
但硅酸盐熔体的结构要复杂得多,这是因为硅酸盐晶体结构中的Si-O或Al-O之间的结合力强,在转变成熔体时难以破坏造成的。
因此,硅酸盐熔体中的质点不可能全部以简单的离子形式存在。
硅酸盐熔体具有粘度大的特点,说明熔体中存在较大的难活动的质点或质点组合体。
实验表明,硅酸盐熔体和玻璃体的结构很相似,它们的结构中都存在着简单离子和近程有序的离子团:1.Na+,K+,Ba2+等电荷少、半径大的离子一般呈单个离子形式存在;2.Si4+,P5+,B3+,Ge4+等电荷多、配位数小的离子往往与O2-结合成络阴离子,成为聚合程度不等的复合阴离子团;3.整个熔体是电中性,阳离子和阴离子团之间仍旧存在静电吸引力;4.熔体结构特征仍然是在阳离子周围包围阴离子,阴离子周围包围阳离子;5.复合阴离子团的种类、大小和复杂程度随熔体的组成和温度而变,可以解聚或继续聚合成更复杂的阴离子团。
其聚合和解聚反应为:……即:熔体在一定组成、一定温度时存在相应的复合阴离子团。
(二)影响复合阴离子团结构的因素1.组成(内因)表4-2 硅酸盐复合阴离子团结构O:Si名称负离子团类型共氧离子数每个硅负电荷数负离子团结构4:1 岛状硅酸盐[SiO4]4-0 4 3.5:1 组群状硅酸盐[Si2O7]6- 1 33:1环状硅酸盐六节环(三节环、四节环)[Si6O18]6-([Si3O9]6-、[Si4O12]6-)2 23:1 链状硅酸盐1[Si2O6]4- 2 22.75:1 带状硅酸盐 1 [Si4O11]6- 2.5 1.52.5:1 层状硅酸盐 2 [Si4O10]4- 3 1 二维方向无限延伸2:1 架状硅酸盐 3 [SiO2] 4 0 三维方向无限延伸在硅酸盐熔体中,最基本的离子是硅、氧和碱金属或碱土金属离子。
由于Si4+电价高,半径小,它有着很强的形成硅氧四面体[SiO4]的能力。
根据鲍林电负性计算,Si-O间电负性差值△x=1.7,所以Si-O键既有离子键又有共价键的成分,其中50%为共价键。
Si-O 键这种键合方式,使它具有高键能、方向性和低配位等特点。
熔体中R-O键(R指碱金属或碱土金属离子)的键型是以离子键为主,比Si-O键弱得多。
当R2O、RO引人硅酸盐熔体中时,Si4+将把R-O 上的O2-拉向自己一边,使Si-O-Si 中的Si-O 键断裂,导致Si-O键的键强、键长、键角都会发生变动。
也即R2O、RO起到了提供”游离”氧的作用。
如图4-2以Na2O为例,说明以上的变化。
图中与两个Si4+相连的氧称为桥氧(与两个网络形成阳离子相连接的、电价已饱和的氧离子,该种氧离子不能再与其他金属阳离子相连接,也称非活性氧或公共氧。
),与一个Si4+相连的氧称为非桥氧(只与一个网络形成阳离子连接,电价不饱和的氧离子。
该种氧离子还能再与其它金属阳离子相连接以达到电中性(中和),也称活性氧或非公共氧。
)。
在SiO2石英熔体中,O/Si比为2∶1,[SiO4]连接成架状。
当引入Na2O时,由于Na2O提供”游离”氧,O/Si比升高,结果使部分桥氧断裂成为非桥氧。
随Na2O的加入量的增加,O/Si比可由原来2∶1逐步升高至4∶1,此时[SiO4]的连接方式可从架状、层状、带状、链状、环状最后桥氧全部断裂而形成[SiO4]岛状,[SiO4]连接程度降低。
图4-2 Na2O和Si-O网络(二维模型)反应示意图在熔体中结构单元之间的排列是无规则的,结构单元本身也有变形。
除硅的氧化物能聚合成各种复合阴离子团以外,熔体中含有磷、硼、锗、砷等氧化物时也会形成类似的聚合。
如:P:,,可形成双四面体、链状、架状;B:,,可形成环状、链状,层状。
这类具有和O2-形成网络复合阴离子团的离子称为网络形成离子,其氧化物称为网络形成体。
复合阴离子团大小随O/Si(硅酸盐)或O/B(硼酸盐)、O/P(磷酸盐)、O/Ge(锗酸盐)、O/As(砷酸盐)比值而变化:比值愈大,复合阴离子团愈小;比值愈小,复合阴离子团愈大。
硅酸盐熔体中除了网络形成离子外,也可能有其它离子如Al。
Al不能独立形成硅酸盐类型的网络,但能和Si置换,形成。
置换后的熔体和纯SiO2熔体相比,Al离子并不明显地改变熔体结构,称为网络中间离子,其氧化物称为网络中间体在硅酸盐熔体中引入碱金属或碱土金属氧化物(R2O或RO)时,由于R+、R2+电荷小、半径大,与O2-的结合力比Si弱,Si4+可以把它们所带入的O2-吸引过去,即R2O或RO提供“游离”氧,使O/Si比值增加,导致四面体网络中部分和二个硅相连的桥氧的断裂,形成非桥氧,起断网作用,促使复合阴离子团变小,粘度降低,熔体相对比较均匀,存在于熔体中的R+、R2+以统计方式均匀分布于非桥氧附近,由于这类离子改变了网络,在结构上处于网络之外,故称为网络改变离子或网络外体离子,其氧化物称为网络改变体或网络外体。
2.温度(外因)温度升高,使质点间的作用力减弱,使复合阴离子团解聚;温度降低,则使阴离子团进一步聚合。
(三)硅酸盐熔体的分相硅酸盐熔体分成二种或两种以上的不混溶液相,称为分相。
硅酸盐熔体分相与熔体中的Si—O聚合体、其它阳离子—氧多面体的几何结构以及阳离子—氧的键性有关。
如果外加的阳离子在熔体中和氧形成较强的键,以致氧很难被硅离子夺去,在熔体表现为独立的R—O离子聚合体,其中只会有少数Si离子,这样就出现两种液相共存,一种含少量Si的富R—O液相,一种是含R+少的富Si—O液相,使系统自由焓降低,从而在熔体中观察到两种液相的不混溶现象。
R—O的键强近似地决定于阳离子电荷Z与半径r之比(Z/r,称为离子势),Z/r越大,熔体分成二液不混溶液滴的倾向越明显。
Sr2+、Ca2+、Mg2+等离子的Z/r比值大,容易导致熔体分相;K+、Cs+、Rb+的Z/r比值较小,不易导致熔体分相。
4.2 熔体的性质物质的宏观性质是它微观结构的反映,下面我们将从结构的观点来讨论硅酸盐熔体的二个重要物理化学性质。
一、粘度(一)基本概念1.定义当相邻内层液体作相对运动时,两层之间存在着一种阻碍运动的内摩擦力f,而单位面积的内摩擦力和垂直于液体运动方向的速度梯度的关系如下:(3-1)式中:f—内摩擦力;A—接触面积;—垂直于运动方向的速度梯度;—比例系数,称为粘度系数,简称粘度。