1.2芳香性与同芳香性
- 格式:ppt
- 大小:376.00 KB
- 文档页数:35

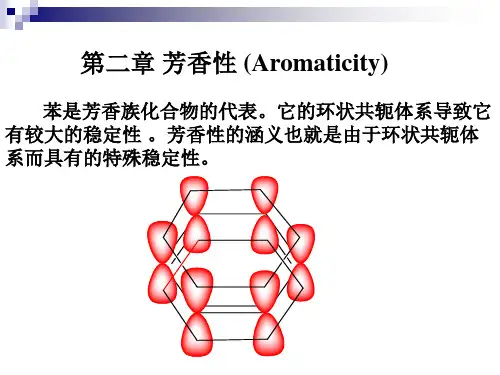
碳环化合物的芳香性1芳香性,非芳香性,反芳香性,同芳香性及反同芳香性的判断芳烃一般具有苯环结构,它们是环状闭合共轭体系,π电子高度离域,体系能量低,较稳定。
在化学性质上表现为易进行亲电取代反应,不易进行加成和氧化反应,即具有不同程度的芳香性。
是不是具有芳香性的化合物一定具有苯环?1931年德国化学家休克尔(Hückel)从分子轨道理论的角度,对环状多烯烃(亦称轮烯)的芳香性提出了如下规则,即Hückel 规则。
其要点是:化合物是轮烯,共平面,它的π电子数为4n+2(n为0,1,2,3…,n 整数),共面的原子均为sp2或sp杂化。
1954年伯朗特(Platt)提出了周边修正法,认为可以忽略中间的桥键而直接计算外围的电子数,对Hückel规则进行了完善和补充。
但仍有一些不足之处[1]。
1.1芳香性一些稠环烃也可将之看成轮烯,画经典结构式时,应使尽量多的双键处在轮烯上,处在轮烯内外的双键写成其共振的正负电荷形式,将出现在轮烯内外的单键忽略后,再用Hückel -Platt规则判断。
(1)双键碳处在不与轮烯共用的内部,计算电子时,只计算轮烯上的电子,内部的不记。
下面的化合物A和D周边分别有双键6个和5个,如此时判断他们的芳香性就会造成错误。
而它们的B和E式分别有双键7个和6个,将内部的双键写成其共振的正负电荷形式C 和F后,将出现在轮烯内外的单键忽略后,用Hückel-Platt规则判断得A为芳香性物质,而D不是芳香性物质。
A B CD E F14e12e(2)双键与轮烯直接相连,计算电子时,将双键写成其共振的电荷结构,负电荷按2个电子计,正电荷按0计,内部不计。
如下面物质均有芳香性:14e10e6e6eOO2e6eOO6e10e2e6e(3)轮烯内部通过单键相连,且单键碳与轮烯共用,单键忽略后,下列物质萘、蒽、菲均有芳香性:10e8e12e14e12e14e(4)轮烯外部通过单键相连,且单键碳与轮烯共用,单键忽略后,分别计算单键所连的轮烯的芳香性,下列物质均有芳香性:1.2反芳香性反芳香性是指化合物共平面,它的π电子数为4n (n 为0,1,2,3…,n 整数),共面的原子均为sp 2或sp 杂化的轮烯,它的稳定性小于开链烃。

有机化学基础知识点整理芳香性和芳香化合物的性质芳香性和芳香化合物的性质有机化学是化学领域中的一个重要分支,研究有机物的结构、性质和合成方法等。
芳香性和芳香化合物是有机化学中的重要概念和研究内容之一。
本文将对芳香性和芳香化合物的基础知识点进行整理。
一、芳香性的概念芳香性是指含有芳香环结构的化合物所特有的性质或现象。
它是由芳香环中的π电子云形成的高度共轭体系所决定的。
具备芳香环结构的化合物表现出一系列独特的性质,包括稳定性高、反应活性低、呈现特殊的气味等。
二、芳香性的规则和条件1. 符合Hückel规则Hückel规则是判断一个化合物是否具备芳香性的一个重要准则。
根据Hückel规则,一个环状分子具备芳香性必须满足:- 分子是平面的;- 分子中含有 4n+2 个π电子,其中 n 是非负整数。
2. 产生高度共轭体系芳香性是由共轭体系中的π电子云形成的,因此产生芳香性的分子通常具有大范围的共轭结构。
对于苯环来说,由于其电子云在整个环上共轭,因此苯是最简单的芳香化合物。
3. 具备极性芳香化合物中的芳香环带有电负性较大的原子团,如氧、氮等,因此具备一定的极性。
然而,芳香化合物整体上常表现出较弱的极性,主要由于π电子在环上的扩散。
三、芳香化合物的性质1. 化学稳定性芳香化合物的共轭结构使其更加稳定。
对于具有芳香性的化合物,由于能量更低,其化学稳定性也相对较高。
这也是为什么芳香化合物常用作药物、染料和香料等方面的原料。
2. 同位素标记由于芳香化合物的稳定性,可以通过同位素标记来追踪其在化学反应中的转化过程。
同位素标记技术在有机化学的研究和应用中扮演着重要的角色,有助于揭示化学反应的机理和动力学。
3. 气味和香味芳香化合物常常具有独特的气味和香味,广泛应用于香水、香料和食品添加剂等方面。
因为芳香化合物形成的芳香环结构能够与嗅觉受体结合,产生特殊的感官效应。
4. 光谱特性芳香化合物在红外光谱、紫外光谱和核磁共振光谱等光谱中表现出特殊的峰值和吸收特性,这对于准确鉴定和表征芳香化合物具有重要意义。



碳环化合物的芳香性魏荣宝陈苏战刘秀明天津理工大学生物与化学工程学院天津300191摘要本文介绍碳环化合物的芳香性,非芳香性,反芳香性,同芳香性及反同芳香性简单判断的方法及在有机化学中的应用。
1芳香性,非芳香性,反芳香性,同芳香性及反同芳香性的判断芳烃一般具有苯环结构,它们是环状闭合共轭体系,π电子高度离域,体系能量低,较稳定。
在化学性质上表现为易进行亲电取代反应,不易进行加成和氧化反应,即具有不同程度的芳香性。
是不是具有芳香性的化合物一定具有苯环?1931年德国化学家休克尔(Hückel)从分子轨道理论的角度,对环状多烯烃(亦称轮烯)的芳香性提出了如下规则,即Hückel 规则。
其要点是:化合物是轮烯,共平面,它的π电子数为4n+2(n为0,1,2,3…,n 整数),共面的原子均为sp2或sp杂化。
1954年伯朗特(Platt)提出了周边修正法,认为可以忽略中间的桥键而直接计算外围的电子数,对Hückel规则进行了完善和补充。
但仍有一些不足之处[1]。
本文根据教学实践,提出了简单判断碳环化合物的芳香性、非芳香性、反芳香性、同芳香性及反同芳香性的方法及在有机化学中的应用[2]。
1.1芳香性一些稠环烃也可将之看成轮烯,画经典结构式时,应使尽量多的双键处在轮烯上,处在轮烯内外的双键写成其共振的正负电荷形式,将出现在轮烯内外的单键忽略后,再用Hückel -Platt规则判断。
(1)双键碳处在不与轮烯共用的内部,计算电子时,只计算轮烯上的电子,内部的不记。
下面的化合物A和D周边分别有双键6个和5个,如此时判断他们的芳香性就会造成错误。
而它们的B和E式分别有双键7个和6个,将内部的双键写成其共振的正负电荷形式C 和F后,将出现在轮烯内外的单键忽略后,用Hückel-Platt规则判断得A为芳香性物质,而D不是芳香性物质。
A B CD E F14e12e (2)双键与轮烯直接相连,计算电子时,将双键写成其共振的电荷结构,负电荷按2个电子计,正电荷按0计,内部不计。

杂环化合物; 组成碳环化合物的一个或多个环碳原子,被O、S、N、Se、P、As……等非碳原子置换而形成的化合物,称为杂环化合物;这些非碳原子则称为杂原子。
但通常将周期表中的零族和第一族元素的原子以及其他金属元素的原子除外。
前者是由于尚未发现由它们组成的、稳定的杂环化合物;后者虽能参与成环,但性质特殊,通常列入金属有机化合物类。
常见的杂环化合物由五元、六元环组成,但也有三元、四元环及七元、八元环的,甚至还有十元以上的大环。
环内的杂原子可由一个至多个相同或不相同的杂原子组成。
成环的形式有单杂环及稠杂环;稠杂环可以是碳环与杂环并合,也可以是杂环与杂环并合。
因而杂环化合物的种类繁多、数目庞大。
在环状有机化合物中,成环原子除碳外,还含有氧、硫、氮等其他原子的环状有机化合物称为杂环化合物。
有脂杂环和芳杂环,通常说的杂环主要是指芳杂环。
芳杂环可以按照杂原子的种类、数目和结合方式,分成若干系。
杂环化合物上述杂环化合物都符合休克尔规则,故都有芳香性。
π电子数计算技巧:双键C 阳离子阴离子单键杂原子双键杂原子1 02 2 1具有芳香性化合物的特点是:(1)必须是环状的共轭体系;(2) 具有平面结构——共平面或接近共平面(平面扭转<0.01nm);(3) 环上的每个原子均采用SP2杂化(在某些情况下也可是SP杂化);(4) 环上的π电子能发生电子离域,且符合4n + 2 的Hückel规则。
具有芳香性化合物在性质上的标志是:(1) 与苯类似,容易发生亲电取代反应,而不易发生加成;(2) 氢化热和燃烧热比相应的非环体系低,而显示出特殊的稳定性;(3) 在NMR谱中与苯及其衍生物的质子有类似的化学位移。
根据休克尔规则,环丁二烯应没有芳香性。
环丁二烯右4个π电子,不符合4n+2规则,它有一组简并的非键轨道和一个成键轨道,基态下其中两个π电子占据能量最低的成键轨道,但两个简并的非键轨道只有两个π电子数,就是说它是半充满的,按照洪特规则,它是非常不稳定的。


有机化学期中论文学校院系:西北大学化工学院班级:化学工程与工艺学号:2009115065姓名:崔尧论碳环化合物的芳香性的判断摘要本文介绍碳环化合物的芳香性,非芳香性,反芳香性,同芳香性及反同芳香性简单判断的方法及在有机化学中的应用。
一芳香性,非芳香性,反芳香性,同芳香性及反同芳香性的判断芳烃一般具有苯环结构,它们是环状闭合共轭体系,π电子高度离域,体系能量低,较稳定。
在化学性质上表现为易进行亲电取代反应,不易进行加成和氧化反应,即具有不同程度的芳香性。
是不是具有芳香性的化合物一定具有苯环?1931年德国化学家休克尔(Hückel)从分子轨道理论的角度,对环状多烯烃(亦称轮烯)的芳香性提出了如下规则,即Hückel 规则。
其要点是:化合物是轮烯,共平面,它的π电子数为4n+2(n为0,1,2,3…,n 整数),共面的原子均为sp2或sp杂化。
1954年伯朗特(Platt)提出了周边修正法,认为可以忽略中间的桥键而直接计算外围的电子数,对Hückel规则进行了完善和补充。
但仍有一些不足之处[1]。
本文根据教学实践,提出了简单判断碳环化合物的芳香性、非芳香性、反芳香性、同芳香性及反同芳香性的方法及在有机化学中的应用[2]。
(1)芳香性一些稠环烃也可将之看成轮烯,画经典结构式时,应使尽量多的双键处在轮烯上,处在轮烯内外的双键写成其共振的正负电荷形式,将出现在轮烯内外的单键忽略后,再用Hückel -Platt规则判断。
(1)双键碳处在不与轮烯共用的内部,计算电子时,只计算轮烯上的电子,内部的不记。
下面的化合物A和D周边分别有双键6个和5个,如此时判断他们的芳香性就会造成错误。
而它们的B和E式分别有双键7个和6个,将内部的双键写成其共振的正负电荷形式C 和F后,将出现在轮烯内外的单键忽略后,用Hückel-Platt规则判断得A为芳香性物质,而D不是芳香性物质。

芳香性概述内容提要1. 芳香性1.1芳香性的定义与基本判据1.2芳香化合物的基本化学性质1.3芳香化合物的基本结构特征1.4芳香化合物的核磁共振性质和芳香性的检验手段1.4.1核磁共振原理1.4.2 电磁屏蔽效应1.4.3 全反式[18]轮烯的核磁共振1.4.4 芳香化合物的核磁共振性质1.4.5 芳香性的检验手段1.5芳香性的定性判据——休克尔规则1.5.1休克尔规则的表述1.5.2. 休克尔规则的应用举例1.5.3适用休克尔规则的常见非苯芳香化合物1.6周边修正1.6.1萘和薁1.6.2芘1.6.3双键修正在周边修正中的应用1.7芳香性定性判据的局限性2. 反芳香性2.1反芳香性的定义与基本判据2.2典型的反芳香化合物2.2.1 环丁二烯2.2.2 环戊二烯正离子3. 非芳香性4. 同芳香性4.1环辛四烯正离子4.2其它典型的同芳香性分子4.2.1环戊烯-4-正离子4.2.2降冰片烯-7-正离子4.2.3亚甲叉[10]轮烯5. Y芳香性6. 休克尔分子轨道理论6.1变分法概述6.2尝试波函数的构建方法6.3尝试波函数Ψ = c A A + c B B的构建举例6.4同核双原子分子的变分法构建结果6.5异核双原子分子的变分法构建结果6.6 αA和αB的差值对成键和反键轨道能E+和E-的影响6.7休克尔分子轨道法7. 富烯7.1线性π体系分子轨道能量的计算公式7.2使用休克尔分子轨道法简便求解分子轨道能和轨道系数的举例:1,3-丁二烯7.3富烯与1,3,5-己三烯7.3.1 富烯7.3.2 1,3,5-己三烯7.3.3 富烯与1,3,5-己三烯的比较7.3.4 休克尔分子轨道法的局限性8. 环丁二烯与姜泰勒畸变8.1单一环状π体系分子轨道能量的计算公式8.2多边形法则8.3休克尔分子轨道法对环丁二烯的处理8.4环丁二烯的真实情况与姜-泰勒畸变8.4.1 环丁二烯的真实情况8.4.2 姜-泰勒畸变正文1.芳香性(Aromaticity)1.1芳香性的定义与基本判据芳香化合物一词,最早源于苯的合成,天然产物安息香胶中,含有苯甲酸(俗称安息香酸),苯甲酸与碱共热可脱去羧基得到苯,其带有芬芳气味[1]最初,芳香化合物的范围仅限于苯与其同系物,后来随着人们对芳香性的认识不断加深,芳香性的概念也不断被扩展和重新定义公元1931年,德国物理学家和物理化学家艾瑞克·休克尔(Erich Hückel)提出,离域π电子数符合4n + 2规则的平面共轭多烯,具有芳香性,其中n是非负整数[2]。

多环化合物的芳香性摘要介绍了简单判断多环化合物的芳香性、非芳香性、反芳香性、同芳香性及反同芳香性的方法及其在有机化学中的应用。
关键词多环化合物芳香性反芳香性同芳香性1芳香性、非芳香性、反芳香性、同芳香性及反同芳香性的判断芳烃一般具有苯环结构,它们是环状闭合共轭体系,π电子高度离域,体系能量低,较稳定。
在化学性质上表现为易进行亲电取代反应,不易进行加成和氧化反应,即具有不同程度的芳香性。
是不是具有芳香性的化合物一定具有苯环?1931年德国化学家休克尔(Hückel)从分子轨道理论的角度,对环状多烯烃(亦称轮烯)的芳香性提出了如下规则,即Hückel规则。
其要点是:化合物是轮烯,共平面,它的π电子数为4n+2(n为0,1,2,3…,n整数),共面的原子均为sp2或sp杂化。
1954年伯朗特(Platt)提出了周边修正法,认为可以忽略中间的桥键而直接计算外围的电子数,对Hückel规则进行了完善和补充。
(1)芳香性(轮烯,共平面,π电子数为4n+2,共面的原子均为sp2或sp 杂化),一些稠环烃也可将之看成轮烯。
画经典结构式时,应使尽量多的双键处在轮烯上,处在轮烯内外的双键写成其共振的正负电荷形式,将出现在轮烯内外的单键忽略后,再用Hückel-Platt规则判断。
下面的化合物A和D周边分别有双键6个和5个,此时直接判断他们的芳香性就会造成错误。
所以首先应将他们改写成尽量多的双键处在轮烯上的B和E 式,B和E分别有双键7个和6个,将内部的双键写成其共振的正负电荷形式C 和F后,将出现在轮烯内外的单键忽略,用Hückel-Platt规则判断得A,G为芳香性物质,D不是芳香性物质。
①双键与轮烯直接相连,计算电子数时,将双键写成其共振的电荷结构,负电荷按2个电子计,正电荷按0计,内部不计。
如下面物质均有芳香性。
②轮烯内部通过单键相连,且单键碳与轮烯共用,单键忽略后,下列物质萘、蒽、菲均有芳香性。
芳香族化合物的概念1. 概念定义芳香族化合物是一类具有稳定的芳香性质的有机化合物。
它们由苯环(或苯环的衍生物)构成,具有共轭的π电子体系和特殊的稳定性。
芳香族化合物通常具有较低的反应活性和较高的熔点、沸点,且不溶于水。
2. 关键概念解析2.1 芳香性芳香性是芳香族化合物最重要的特征之一。
它指的是分子中存在稳定、共轭的π电子体系,使得分子呈现出特殊的稳定性和独特的化学反应。
具有芳香性质的分子一般都符合赫兹规则,即满足4n+2个π电子(n为非负整数)。
例如,苯(C6H6)分子中含有6个π电子,符合赫兹规则,因此呈现出稳定且不容易发生加成反应。
2.2 共轭系统共轭系统是指由相邻原子上存在多个相互重叠、能够自由移动的π电子构成的电子体系。
在芳香族化合物中,苯环上的π电子能够自由地在整个环上运动,形成一个共轭系统。
共轭系统的存在使得芳香族化合物具有稳定性,并且能够参与一系列特定的化学反应。
2.3 稳定性芳香族化合物具有较高的稳定性,这主要归功于其共轭π电子体系。
共轭π电子体系能够通过分子内部的共轭作用来分散和稳定电荷,从而减少反应活性。
此外,芳香族化合物还具有较高的熔点和沸点,这是因为相邻分子之间存在着较强的范德华力。
2.4 应用芳香族化合物在生命科学、材料科学、医药和农药等领域都有广泛的应用。
•生命科学:许多天然产物和人工合成药物都含有芳香环结构,如水杨酸类药物(如阿司匹林)、激素类药物(如雌激素)等。
此外,许多生物活性分子也包含芳香环结构,如DNA碱基和氨基酸芳香侧链。
•材料科学:芳香族化合物具有良好的电子传输性能和光学性质,因此被广泛应用于有机电子器件和光电材料的制备中。
例如,聚苯乙烯(一种含有苯环的高分子)可用于制备发光二极管(LED)和太阳能电池。
•医药和农药:许多医药品和农药都是以芳香族化合物为主要活性成分的。
例如,阿司匹林是一种常用的解热镇痛药,其主要成分水杨酸具有芳香环结构。
农药中常见的拟除虫菊酮类化合物也含有芳香环结构。
芳 烃一、芳香性的概念一般所谓的芳香性化合物大多具有下列几个特点。
⑴较高的碳/氢比例 许多芳香族化合物都有较高的碳/氢之比。
比如苯和萘。
相对而言, 在脂肪族化合物中,除少数几个化合物和炔烃外,绝大部分的碳/氢比例都较低。
⑵键长的平均化 芳香性分子具有比正常的碳碳双键的键长稍长的双键和比正常的碳 碳单键的键长稍短的单键。
无芳香性的多烯分子中单键和双键的键长特征很明显,芳香性分 子的碳碳键长位于单双键之间,苯环中6 个碳碳键长相等,环中并无单键双键之分。
⑶分子的共平面性 具有芳香性的分子的一个显著特征是环上原子的平面性或几乎平 面性的排列。
有平面结构的化合物并不都是有芳香性的,但芳香性总是伴随着一定程度的平 面性。
⑷共轭性 苯环上的6 个π电子在所有的碳原子上离域而相互交盖并得到稳定, 其稳定 化的程度可用离域能或共轭能表示。
只要分子是有芳香性的,它必定由于电荷离域而具有正 的共轭能,反之,反芳香性分子和非芳香性分子则由于电荷离域而分别具有负共轭能和零共 轭能。
⑸特征光谱 芳香体系的振动光谱和电子光谱与脂肪体系及简单的共轭体系有明显的 差异。
如苯环的紫外光谱上有184nm,202nm(K 带)和 254nm(B 带)三个特征峰;红外光 谱上分别在 30003100, 1600, 1570, 1500, 10001100cm 1 等区域及指纹区有特征峰。
1 HNMR 谱则是芳香性分子表现出特殊现象的最明显标志。
⑹化学性质 早期所谓芳香性即是指苯的化学反应性的总称,认为具有芳香性特征的 分子都是具有特殊稳定性的环结构不易被破坏的环状化合物。
如,甲苯易氧化为苯甲酸但环 结构得到保留。
芳香族化合物中都含有不饱和键,但它们似乎具有饱和性,很难发生加成反 应,一般仅发生取代反应,这和一般的不饱和化合物明显不同。
由于芳香性化合物所显示的性质范围如此广泛, 以至于很难用一个简单的定义把上述各 性质归纳起来。