芳香性及其判断规则
- 格式:ppt
- 大小:1.73 MB
- 文档页数:28

芳香性判断技巧-标准化文件发布号:(9556-EUATWK-MWUB-WUNN-INNUL-DDQTY-KII一,芳香性判据——Hückel规则Hückel规则:一个单环化合物只要具有平面离域体系,它的π 电子数为4n+2(n=0,1,3,…整数),就有芳香性(当 n>7 时,有例外).对能看懂这篇文章的人说:苯有有芳香性,那就是废话了.非苯芳烃:凡符合Hückel规则,不含苯环的具有芳香性的烃类化合物,非苯芳烃包括一些环多烯和芳香离子等.二,一些非苯芳烃1.环多烯烃:(通式CnHn )又称作轮烯(也有人把n≥10 的环多烯烃称为轮烯).环丁烯,苯,环辛四烯和环十八碳九烯分别称[4]轮烯,[6]轮烯,[8]轮烯和[18]轮烯.它们是否具有芳香性,可按Hückel规则判断,首先看环上的碳原子是否均处于一个平面内,其次看π 电子数是否符合 4n+2.[18]轮烯环上碳原子基本上在一个平面内,π 电子数为 4n+2(n=4),因此具有芳香性.又如[10]轮烯,π 电子数符合 4n+2(n=2),但由于环内两个氢原子的空间位阻,使环上碳原子不能在一个平面内,故无芳香性.2,芳香离子:某些烃无芳香性,但转变成离子后,则有可能显示芳香性.如环戊二烯无芳香性,但形成负离子后,不仅组成环的 5 个碳原子在同一个平面上,且有 6 个π 电子(n=1),故有芳香性.与此相似,环辛四烯的两价负离子也具有芳香性.因为形成负离子后,原来的碳环由盆形转变成了平面正八边形,且有 10 个π 电子(n=2),故有芳香性.环戊二烯负离子其它某些离子也具有芳香性,例如,环丙烯正离子(Ⅰ),环丁二烯两价正离子(Ⅱ)和两价负离子(Ⅲ),环庚三烯正离子(Ⅳ).因为它们都具有平面结构,且π 电子数分别位 2,2,6,6,符合 4n+2(n 分别位0,0,1,1).具有芳香性的离子也属于非苯芳烃.3,稠环体系:与苯相似,萘,蒽,菲等稠环芳烃,由于它们的成环碳原子都在同一个平面上,且π 电子数分别为 10 和 14,符合 Hückel 规则,具有芳香性.虽然萘,蒽,菲是稠环芳烃,但构成环的碳原子都处在最外层的环上,可看成是单环共轭多烯,故可用 Hückel 规则来判断其芳香性.与萘,蒽,等稠环芳烃相似,对于非苯系的稠环化合物,如果考虑其成环原子的外围π 电子,也可用 Hückel 规则判断其芳香性.例如,薁(蓝烃)是由一个五元环和一个七元环稠合而成的,其成环原子的外围π 电子有 10 个,相当于[10]轮烯,符合 Hückel 规则(n=2),也具有芳香性.三.π 电子数的计算也许你在做题目的时候对于π 电子数的计算弄糊涂了,比如:觉得怎么同是N原子怎么有时候要把它的孤对电子算进去,有时候又不要呢.我以前就是这样的,现在基本知道判断芳香性了,只是有点经验,有些具体原理我还是不懂.下面是我的一些心得体会,若有错误还请留言指正.下面用的例子中的杂原子是N,其他原子类推.吡咯的N的孤对电子要算进去,在家两双键上的4个电子,共有6电子,有芳香性.吡啶中N原子上连有双键,N上孤对电子不能算进去,三双键共轭,共有6个π电子,有芳香性.两个N都与双键相连,孤对电子也都不算,还是6个π电子有一个N与双键相连,有一个没有.按以上的思路,与双键相连的N上的孤对电子不算进去,而右边的N原子上的孤对电子要算进去,结果也是6个π电子这种结构的也具有芳香性,看起来这个七元环没有达到共轭结构,我的也是经验,两双键中间隔了一个碳正离子,你就把这个碳正离子去掉再来计算π电子数,也是6个.注意:若隔的是碳负离子就不能这样了,一定要是碳正离子才可以这样算.这个和上面那个有点相似,但隔的是碳负离子,一个碳负离子算2个电子,图中有2个碳负离子,还有3个双键,有10个π电子.图中左边,一双键连接两个环,可以写出它的共振体,当然尽量往有芳香性的写,而且芳香性的环稳定,贡献大.这样下面的五元环有6π电子,上面的三元环有2π电子.都有芳香性.因为三键中两π键互相垂直,孤只有一个能与其他双键共轭,。


(个人感悟详细版)芳香性:环状闭合共轭体系,π电子高度离域,具有离域能,体系能量低,较稳定.在化学性质上表现为易进行亲电取代反应,不易进行加成反应和氧化反应,这种物理,化学性质称为芳香性. 一,芳香性判据——Hückel规则Hückel规则:一个单环化合物只要具有平面离域体系,它的π 电子数为4n+2(n=0,1,3,…整数),就有芳香性(当n>7 时,有例外).对能看懂这篇文章的人说:苯有有芳香性,那就是废话了.非苯芳烃:凡符合Hückel规则,不含苯环的具有芳香性的烃类化合物,非苯芳烃包括一些环多烯和芳香离子等.二,一些非苯芳烃1.环多烯烃:(通式CnHn )又称作轮烯(也有人把n≥10 的环多烯烃称为轮烯).环丁烯,苯,环辛四烯和环十八碳九烯分别称[4]轮烯,[6]轮烯,[8]轮烯和[18]轮烯.它们是否具有芳香性,可按Hückel规则判断,首先看环上的碳原子是否均处于一个平面内,其次看π 电子数是否符合4n+2.[18]轮烯环上碳原子基本上在一个平面内,π 电子数为4n+2(n=4),因此具有芳香性.又如[10]轮烯,π 电子数符合4n+2(n=2),但由于环内两个氢原子的空间位阻,使环上碳原子不能在一个平面内,故无芳香性.2,芳香离子:某些烃无芳香性,但转变成离子后,则有可能显示芳香性.如环戊二烯无芳香性,但形成负离子后,不仅组成环的 5 个碳原子在同一个平面上,且有 6 个π 电子(n=1),故有芳香性.与此相似,环辛四烯的两价负离子也具有芳香性.因为形成负离子后,原来的碳环由盆形转变成了平面正八边形,且有10 个π 电子(n=2),故有芳香性.环戊二烯负离子其它某些离子也具有芳香性,例如,环丙烯正离子(Ⅰ),环丁二烯两价正离子(Ⅱ)和两价负离子(Ⅲ),环庚三烯正离子(Ⅳ).因为它们都具有平面结构,且π 电子数分别位2,2,6,6,符合4n+2(n 分别位0,0,1,1).具有芳香性的离子也属于非苯芳烃.3,稠环体系:与苯相似,萘,蒽,菲等稠环芳烃,由于它们的成环碳原子都在同一个平面上,且π 电子数分别为10 和14,符合Hückel 规则,具有芳香性.虽然萘,蒽,菲是稠环芳烃,但构成环的碳原子都处在最外层的环上,可看成是单环共轭多烯,故可用Hückel 规则来判断其芳香性.与萘,蒽,等稠环芳烃相似,对于非苯系的稠环化合物,如果考虑其成环原子的外围π 电子,也可用Hückel 规则判断其芳香性.例如,薁(蓝烃)是由一个五元环和一个七元环稠合而成的,其成环原子的外围π 电子有10 个,相当于[10]轮烯,符合Hückel 规则(n=2),也具有芳香性.三.π 电子数的计算也许你在做题目的时候对于π 电子数的计算弄糊涂了,比如:觉得怎么同是N原子怎么有时候要把它的孤对电子算进去,有时候又不要呢.我以前就是这样的,现在基本知道判断芳香性了,只是有点经验,有些具体原理我还是不懂.下面是我的一些心得体会,若有错误还请留言指正.下面用的例子中的杂原子是N,其他原子类推.吡咯的N的孤对电子要算进去,在家两双键上的4个电子,共有6电子,有芳香性.(成环的四个碳原子和一个杂原子都是sp2杂化,所以你看的图中 N还要再连接一个H. N总共5个电子,连接了三个达到八电子饱和故其还有一对电子对未画出,所以是两个双键4个再加N的一对孤电子对2个总共六个)吡啶中N原子上连有双键,N上孤对电子不能算进去,三双键共轭,共有6个π电子,有芳香性.(貌似是一个原子提供一个π电子既然已经双键提供过一次就只算一次跟三键有点类似)两个N都与双键相连,孤对电子也都不算,还是6个π电子(跟刚才上面解释差不多相当于3个双键)有一个N与双键相连,有一个没有.按以上的思路,与双键相连的N上的孤对电子不算进去,而右边的N原子上的孤对电子要算进去,结果也是6个π电子(上面三个题的组合即没有双键的N提供电子对有双键的按提供一个所以是两个双键加一个电子对的2个π电子共六个)这种结构的也具有芳香性,看起来这个七元环没有达到共轭结构,我的也是经验,两双键中间隔了一个碳正离子,你就把这个碳正离子去掉再来计算π电子数,也是6个.注意:若隔的是碳负离子就不能这样了,一定要是碳正离子才可以这样算.(遇到这种没双键的但是有正负电子的我一般是先数双键然后数几个折角即连接处然后是正的话减去减去正的个数是负的话加上负的个数理论依据是正电荷的话使其sp杂化而负电荷的话使其sp2杂化)这个和上面那个有点相似,但隔的是碳负离子,一个碳负离子算2个电子,图中有2个碳负离子,还有3个双键,有10个π电子.(理由同上)图中左边,一双键连接两个环,可以写出它的共振体,当然尽量往有芳香性的写,而且芳香性的环稳定,贡献大.这样下面的五元环有6π电子,上面的三元环有2π电子.都有芳香性.(遇到这种先拆开难理解的双键然后再分成若干小原子团)因为三键中两π键互相垂直,孤只有一个能与其他双键共轭,(貌似是无机的知识三键算一个双键)。



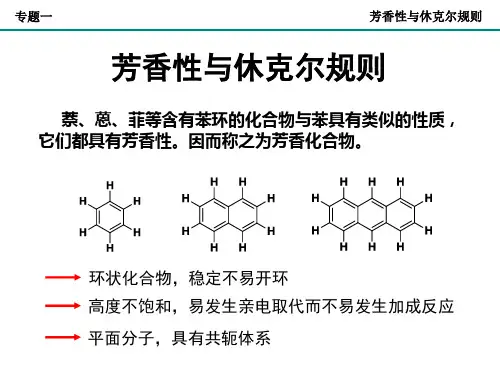
芳香性:环状闭合共轭体系,π电子高度离域,具有离域能,体系能量低,较稳定.在化学性质上表现为易进行亲电取代反应,不易进行加成反应和氧化反应,这种物理,化学性质称为芳香性. 一,芳香性判据——Hückel规则Hückel规则:一个单环化合物只要具有平面离域体系,它的π电子数为4n+2(n=0,1,3,…整数),就有芳香性(当 n>7 时,有例外).对能看懂这篇文章的人说:苯有有芳香性,那就是废话了.非苯芳烃:凡符合Hückel规则,不含苯环的具有芳香性的烃类化合物,非苯芳烃包括一些环多烯和芳香离子等.二,一些非苯芳烃1.环多烯烃:(通式CnHn )又称作轮烯(也有人把 n≥10 的环多烯烃称为轮烯).环丁烯,苯,环辛四烯和环十八碳九烯分别称[4]轮烯,[6]轮烯,[8]轮烯和[18]轮烯.它们是否具有芳香性,可按Hückel规则判断,首先看环上的碳原子是否均处于一个平面内,其次看π电子数是否符合 4n+2.[18]轮烯环上碳原子基本上在一个平面内,π电子数为 4n+2(n=4),因此具有芳香性.又如[10]轮烯,π电子数符合 4n+2(n=2),但由于环内两个氢原子的空间位阻,使环上碳原子不能在一个平面内,故无芳香性.2,芳香离子:某些烃无芳香性,但转变成离子后,则有可能显示芳香性.如环戊二烯无芳香性,但形成负离子后,不仅组成环的 5 个碳原子在同一个平面上,且有 6 个π电子(n=1),故有芳香性.与此相似,环辛四烯的两价负离子也具有芳香性.因为形成负离子后,原来的碳环由盆形转变成了平面正八边形,且有 10 个π电子(n=2),故有芳香性.环戊二烯负离子其它某些离子也具有芳香性,例如,环丙烯正离子(Ⅰ),环丁二烯两价正离子(Ⅱ)和两价负离子(Ⅲ),环庚三烯正离子(Ⅳ).因为它们都具有平面结构,且π电子数分别位 2,2,6,6,符合4n+2(n 分别位0,0,1,1).具有芳香性的离子也属于非苯芳烃.3,稠环体系:与苯相似,萘,蒽,菲等稠环芳烃,由于它们的成环碳原子都在同一个平面上,且π电子数分别为 10 和 14,符合 Hückel 规则,具有芳香性.虽然萘,蒽,菲是稠环芳烃,但构成环的碳原子都处在最外层的环上,可看成是单环共轭多烯,故可用 Hückel 规则来判断其芳香性.与萘,蒽,等稠环芳烃相似,对于非苯系的稠环化合物,如果考虑其成环原子的外围π电子,也可用 Hückel 规则判断其芳香性.例如,薁(蓝烃)是由一个五元环和一个七元环稠合而成的,其成环原子的外围π电子有 10 个,相当于[10]轮烯,符合 Hückel 规则(n=2),也具有芳香性.三.π电子数的计算也许你在做题目的时候对于π电子数的计算弄糊涂了,比如:觉得怎么同是N原子怎么有时候要把它的孤对电子算进去,有时候又不要呢.我以前就是这样的,现在基本知道判断芳香性了,只是有点经验,有些具体原理我还是不懂.下面是我的一些心得体会,若有错误还请留言指正.下面用的例子中的杂原子是N,其他原子类推.吡咯的N的孤对电子要算进去,在家两双键上的4个电子,共有6电子,有芳香性.吡啶中N原子上连有双键,N上孤对电子不能算进去,三双键共轭,共有6个π电子,有芳香性. 两个N都与双键相连,孤对电子也都不算,还是6个π电子有一个N与双键相连,有一个没有.按以上的思路,与双键相连的N上的孤对电子不算进去,而右边的N原子上的孤对电子要算进去,结果也是6个π电子这种结构的也具有芳香性,看起来这个七元环没有达到共轭结构,我的也是经验,两双键中间隔了一个碳正离子,你就把这个碳正离子去掉再来计算π电子数,也是6个.注意:若隔的是碳负离子就不能这样了,一定要是碳正离子才可以这样算.这个和上面那个有点相似,但隔的是碳负离子,一个碳负离子算2个电子,图中有2个碳负离子,还有3个双键,有10个π电子.图中左边,一双键连接两个环,可以写出它的共振体,当然尽量往有芳香性的写,而且芳香性的环稳定,贡献大.这样下面的五元环有6π电子,上面的三元环有2π电子.都有芳香性.因为三键中两π键互相垂直,孤只有一个能与其他双键共轭,http://206.108.48.51/forumdisplay.php?fid=63。


芳香性的判断
一、芳香性的一般特征:
1. 分子中C/H的比例高(含多个不饱和键);
2. 键长平均化;
3. 分子共平面;
4. 不易加成、氧化,易发生亲电取代;
5. 符合Hǜckel规则(4n+2规律):单环多烯π电子数等于4n+2时,构成π电子的封闭体系表现出一定的芳香性。
从休克尔规则我们可以得知,具有芳香性的通常是具有如下四个特点的分子:
(1)它们是包括若干数目键的环状体系;
(2)它们具有平面结构,或至少非常接近平面(平面扭转不大于0.1nm);
(3)环上的每一个原子必须是sp 杂化(某些情况也可以是sp杂化);
(4)环上的电子能够发生离域。
分子具有芳香性的标志是:
(1)这类化合物虽有不饱和键,但不易进行加成反应,而与苯相似,容易进行亲电取代;
(2)通过氢化热或燃烧热对离域能的热化学测量表明,这类具有芳香性的环状分子比相应的非环体
系具有低的氢化热低的燃烧热,而显示特殊的稳定性。
(3)用物理方法和核磁共振谱进行测定,这类化合物的质子与苯及其衍生物的质子一样,显示类似
的化学位。
芳香性判断原则:1.环状体系;2.π电子数(4n+2规则);3.分子共平面。
判断下列化合物是否具有芳香性:
二、常见芳香性体系:杂环芳香体系:富烯衍生物:(富烯本身不稳定)。

芳香性判断技巧The final revision was on November 23, 2020一,芳香性判据——Hückel规则Hückel规则:一个单环化合物只要具有平面离域体系,它的π 电子数为4n+2(n=0,1,3,…整数),就有芳香性(当 n>7 时,有例外).对能看懂这篇文章的人说:苯有有芳香性,那就是废话了.非苯芳烃:凡符合Hückel规则,不含苯环的具有芳香性的烃类化合物,非苯芳烃包括一些环多烯和芳香离子等.二,一些非苯芳烃1.环多烯烃:(通式CnHn?)又称作轮烯(也有人把n≥10 的环多烯烃称为轮烯).环丁烯,苯,环辛四烯和环十八碳九烯分别称[4]轮烯,[6]轮烯,[8]轮烯和[18]轮烯.它们是否具有芳香性,可按Hückel规则判断,首先看环上的碳原子是否均处于一个平面内,其次看π 电子数是否符合 4n+2.[18]轮烯环上碳原子基本上在一个平面内,π 电子数为 4n+2(n=4),因此具有芳香性.又如[10]轮烯,π 电子数符合 4n+2(n=2),但由于环内两个氢原子的空间位阻,使环上碳原子不能在一个平面内,故无芳香性.2,芳香离子:某些烃无芳香性,但转变成离子后,则有可能显示芳香性.如环戊二烯无芳香性,但形成负离子后,不仅组成环的 5 个碳原子在同一个平面上,且有 6 个π 电子(n=1),故有芳香性.与此相似,环辛四烯的两价负离子也具有芳香性.因为形成负离子后,原来的碳环由盆形转变成了平面正八边形,且有 10 个π 电子(n=2),故有芳香性.环戊二烯负离子其它某些离子也具有芳香性,例如,环丙烯正离子(Ⅰ),环丁二烯两价正离子(Ⅱ)和两价负离子(Ⅲ),环庚三烯正离子(Ⅳ).因为它们都具有平面结构,且π 电子数分别位 2,2,6,6,符合4n+2(n 分别位0,0,1,1).具有芳香性的离子也属于非苯芳烃.3,稠环体系:与苯相似,萘,蒽,菲等稠环芳烃,由于它们的成环碳原子都在同一个平面上,且π 电子数分别为 10 和 14,符合 Hückel 规则,具有芳香性.虽然萘,蒽,菲是稠环芳烃,但构成环的碳原子都处在最外层的环上,可看成是单环共轭多烯,故可用 Hückel 规则来判断其芳香性.与萘,蒽,等稠环芳烃相似,对于非苯系的稠环化合物,如果考虑其成环原子的外围π 电子,也可用 Hückel 规则判断其芳香性.例如,薁(蓝烃)是由一个五元环和一个七元环稠合而成的,其成环原子的外围π 电子有 10 个,相当于[10]轮烯,符合 Hückel 规则(n=2),也具有芳香性.三.π 电子数的计算也许你在做题目的时候对于π 电子数的计算弄糊涂了,比如:觉得怎么同是N原子怎么有时候要把它的孤对电子算进去,有时候又不要呢.我以前就是这样的,现在基本知道判断芳香性了,只是有点经验,有些具体原理我还是不懂.下面是我的一些心得体会,若有错误还请留言指正.下面用的例子中的杂原子是N,其他原子类推.吡咯的N的孤对电子要算进去,在家两双键上的4个电子,共有6电子,有芳香性.吡啶中N原子上连有双键,N上孤对电子不能算进去,三双键共轭,共有6个π电子,有芳香性.两个N都与双键相连,孤对电子也都不算,还是6个π电子有一个N与双键相连,有一个没有.按以上的思路,与双键相连的N上的孤对电子不算进去,而右边的N原子上的孤对电子要算进去,结果也是6个π电子这种结构的也具有芳香性,看起来这个七元环没有达到共轭结构,我的也是经验,两双键中间隔了一个碳正离子,你就把这个碳正离子去掉再来计算π电子数,也是6个.注意:若隔的是碳负离子就不能这样了,一定要是碳正离子才可以这样算.这个和上面那个有点相似,但隔的是碳负离子,一个碳负离子算2个电子,图中有2个碳负离子,还有3个双键,有10个π电子.图中左边,一双键连接两个环,可以写出它的共振体,当然尽量往有芳香性的写,而且芳香性的环稳定,贡献大.这样下面的五元环有6π电子,上面的三元环有2π电子.都有芳香性.因为三键中两π键互相垂直,孤只有一个能与其他双键共轭,。

芳香性判断技巧范文芳香性是指物质具有可感知的香味,对于人们来说,通过感知香味可以判断物质的成分、性质和质量。
掌握芳香性判断技巧可以帮助我们更好地了解物质,下面是一些常用的芳香性判断技巧。
1.嗅闻物质时要避免强烈的刺激性香味,可以在空气中摆动手指,然后将香味带到鼻子附近闻,避免香味被刺激的患处。
2.嗅闻物质时不可过量,适量嗅闻一次,避免过多刺激感官。
3.嗅闻物质时要注意区分短暂的刺激性香味和持久的清淡香味。
刺激性香味常常意味着物质含有刺激性或有毒性成分,而清淡香味则反映了物质可能的化学性质。
4.对于芳香性判断,通常通过观察变化来帮助判断。
一些物质在受热或氧化作用下会产生特殊的香味,例如苯酚加热会发出酚或苯酚烧灼味。
5.薄荷或柠檬酸的含有物质往往具有清凉的香味,而柠檬酸常用于防腐剂,因此柠檬酸的香味往往伴随着有保鲜或防腐作用的物质。
6.氧化物质通常具有淡淡的芳香性,例如酸性氧化剂一氧化二氮、一氧化硫等。
7.一些香味可用于判断物质的品质。
例如,蔗糖具有甜味,如果发现物质具有类似蔗糖的香味,可能表明物质属于糖类。
再比如,纯净的咖啡豆应该具有浓郁的咖啡香味,而受潮变质的咖啡豆会失去香味。
8.通过比较不同物质之间的香味可以判断它们的差异。
例如,同样是水果类的香味,苹果的香味通常酸甜而清爽,橙子的香味则更加醇厚和温暖。
9.香草、草本植物往往具有浓郁的芳香性,而一些花朵则具有独特的香气,如玫瑰花具有浓郁的花香味。
总之,芳香性判断技巧需要通过嗅闻物质并结合观察和经验来进行判断。
掌握这些技巧可以帮助我们更好地了解不同物质的特性和性质,但需要注意不要用嗅觉直接接触一些有害物质,以免对身体造成损害。
芳香性判断技巧Company number:【0089WT-8898YT-W8CCB-BUUT-202108】一,芳香性判据——Hückel规则Hückel规则:一个单环化合物只要具有平面离域体系,它的π 电子数为4n+2(n=0,1,3,…整数),就有芳香性(当 n>7 时,有例外).对能看懂这篇文章的人说:苯有有芳香性,那就是废话了.非苯芳烃:凡符合Hückel规则,不含苯环的具有芳香性的烃类化合物,非苯芳烃包括一些环多烯和芳香离子等.二,一些非苯芳烃1.环多烯烃:(通式CnHn?)又称作轮烯(也有人把n≥10 的环多烯烃称为轮烯).环丁烯,苯,环辛四烯和环十八碳九烯分别称[4]轮烯,[6]轮烯,[8]轮烯和[18]轮烯.它们是否具有芳香性,可按Hückel规则判断,首先看环上的碳原子是否均处于一个平面内,其次看π 电子数是否符合 4n+2.[18]轮烯环上碳原子基本上在一个平面内,π 电子数为 4n+2(n=4),因此具有芳香性.又如[10]轮烯,π 电子数符合 4n+2(n=2),但由于环内两个氢原子的空间位阻,使环上碳原子不能在一个平面内,故无芳香性.2,芳香离子:某些烃无芳香性,但转变成离子后,则有可能显示芳香性.如环戊二烯无芳香性,但形成负离子后,不仅组成环的 5 个碳原子在同一个平面上,且有 6 个π 电子(n=1),故有芳香性.与此相似,环辛四烯的两价负离子也具有芳香性.因为形成负离子后,原来的碳环由盆形转变成了平面正八边形,且有 10 个π 电子(n=2),故有芳香性.环戊二烯负离子其它某些离子也具有芳香性,例如,环丙烯正离子(Ⅰ),环丁二烯两价正离子(Ⅱ)和两价负离子(Ⅲ),环庚三烯正离子(Ⅳ).因为它们都具有平面结构,且π 电子数分别位 2,2,6,6,符合4n+2(n 分别位0,0,1,1).具有芳香性的离子也属于非苯芳烃.3,稠环体系:与苯相似,萘,蒽,菲等稠环芳烃,由于它们的成环碳原子都在同一个平面上,且π 电子数分别为 10 和 14,符合 Hückel 规则,具有芳香性.虽然萘,蒽,菲是稠环芳烃,但构成环的碳原子都处在最外层的环上,可看成是单环共轭多烯,故可用 Hückel 规则来判断其芳香性.与萘,蒽,等稠环芳烃相似,对于非苯系的稠环化合物,如果考虑其成环原子的外围π 电子,也可用 Hückel 规则判断其芳香性.例如,薁(蓝烃)是由一个五元环和一个七元环稠合而成的,其成环原子的外围π 电子有 10 个,相当于[10]轮烯,符合 Hückel 规则(n=2),也具有芳香性.三.π 电子数的计算也许你在做题目的时候对于π 电子数的计算弄糊涂了,比如:觉得怎么同是N原子怎么有时候要把它的孤对电子算进去,有时候又不要呢.我以前就是这样的,现在基本知道判断芳香性了,只是有点经验,有些具体原理我还是不懂.下面是我的一些心得体会,若有错误还请留言指正.下面用的例子中的杂原子是N,其他原子类推.吡咯的N的孤对电子要算进去,在家两双键上的4个电子,共有6电子,有芳香性.吡啶中N原子上连有双键,N上孤对电子不能算进去,三双键共轭,共有6个π电子,有芳香性.两个N都与双键相连,孤对电子也都不算,还是6个π电子有一个N与双键相连,有一个没有.按以上的思路,与双键相连的N上的孤对电子不算进去,而右边的N原子上的孤对电子要算进去,结果也是6个π电子这种结构的也具有芳香性,看起来这个七元环没有达到共轭结构,我的也是经验,两双键中间隔了一个碳正离子,你就把这个碳正离子去掉再来计算π电子数,也是6个.注意:若隔的是碳负离子就不能这样了,一定要是碳正离子才可以这样算.这个和上面那个有点相似,但隔的是碳负离子,一个碳负离子算2个电子,图中有2个碳负离子,还有3个双键,有10个π电子.图中左边,一双键连接两个环,可以写出它的共振体,当然尽量往有芳香性的写,而且芳香性的环稳定,贡献大.这样下面的五元环有6π电子,上面的三元环有2π电子.都有芳香性.因为三键中两π键互相垂直,孤只有一个能与其他双键共轭,。
芳香性4n+2怎么判断
4N+2个单电子,是有奇数对π建和孤电子对么(一般地),第一个有三个π键和一个孤电子对(C得了一个,形成一对孤对电子)没有芳香性。
1、休克尔规则:即∏电子数=4n+2(n为自然数)共轭环状体系具有芳香性。
如苯(n=1),环戊二烯负离子(n=1)。
2、参与形成大∏键的原子是共平面的
扩展资料:
其它某些离子也具有芳香性,例如,环丙烯正离子(Ⅰ),环丁二烯两价正离子(Ⅱ)和两价负离子(Ⅲ),环庚三烯正离子(Ⅳ)。
因为它们都具有平面结构,且π电子数分别为2,2,6,6,符合4n+2(n分别位0,0,1,1)。
具有芳香性的离子也属于非苯芳烃。
一,芳香性判据——Hu ckel规则H u ckel规则:一个单环化合物只要具有平面离域体系,它的n电子数为4n+2(n=0,1,3, ••整数),就有芳香性(当n>7时,有例外).对能看懂这篇文章的人说:苯有有芳香性,那就是废话了•非苯芳烃:凡符合Huckel规则,不含苯环的具有芳香性的烃类化合物,非苯芳烃包括一些环多烯和芳香离子等•二,一些非苯芳烃1.环多烯烃:(通式CnHn )又称作轮烯(也有人把n》10的环多烯烃称为轮烯).环丁烯,苯,环辛四烯和环十八碳九烯分别称[4]轮烯,[6]轮烯,[8]轮烯和[18]轮烯.它们是否具有芳香性,可按Huckei规则判断,首先看环上的碳原子是否均处于一个平面内,其次看n 电子数是否符合4n+2.[18]轮烯环上碳原子基本上在一个平面内,n电子数为4n+2(n=4),因此具有芳香性.又如[10]轮烯,n电子数符合4n+2(n=2),但由于环内两个氢原子的空间位阻,使环上碳原子不能在一个平面内,故无芳香性.2,芳香离子:某些烃无芳香性,但转变成离子后,则有可能显示芳香性•如环戊二烯无芳香性,但形成负离子后,不仅组成环的5个碳原子在同一个平面上,且有6个n电子(n=1),故有芳香性.与此相似,环辛四烯的两价负离子也具有芳香性•因为形成负离子后,原来的碳环由盆形转变成了平面正八边形,且有10个n电子(n二2),故有芳香性环戊二烯负离子其它某些离子也具有芳香性,例如,环丙烯正离子(I),环丁二烯两价正离子(n)和两价负离子(川),环庚三烯正离子(W ).因为它们都具有平面结构,且n电子数分别位2,2,6,6,符合4n+2(n 分别位0,0,1,1).具有芳香性的离子也属于非苯芳烃.3,稠环体系:与苯相似,萘,蔥,菲等稠环芳烃,由于它们的成环碳原子都在同一个平面上,且n电子数分别为10和14,符合Huckel规则,具有芳香性. 虽然萘,蔥,菲是稠环芳烃,但构成环的碳原子都处在最外层的环上,可看成是单环共轭多烯,故可用Huckel规则来判断其芳香性.与萘,蔥,等稠环芳烃相似,对于非苯系的稠环化合物,如果考虑其成环原子的外围n 电子,也可用Huckel规则判断其芳香性.例如,薁(蓝烃)是由一个五元环和一个七元环稠合而成的,其成环原子的外围n电子有10个,相当于[10]轮烯,符合Huckel规则(n=2),也具有芳香性.三• n电子数的计算也许你在做题目的时候对于n电子数的计算弄糊涂了,比如:觉得怎么同是N原子怎么有时候要把它的孤对电子算进去,有时候又不要呢•我以前就是这样的,现在基本知道判断芳香性了,只是有点经验,有些具体原理我还是不懂.下面是我的一些心得体会,若有错误还请留言指正.下面用的例子中的杂原子是N,其他原子类推.吡咯的N的孤对电子要算进去,在家两双键上的4个电子,共有6电子,有芳香性.吡啶中N原子上连有双键,N上孤对电子不能算进去,三双键共轭,共有6个n电子, 有芳香性.两个N都与双键相连,孤对电子也都不算,还是6个n电子有一个N与双键相连,有一个没有.按以上的思路,与双键相连的N上的孤对电子不算进去,而右边的N原子上的孤对电子要算进去,结果也是6个n电子这种结构的也具有芳香性, 看起来这个七元环没有达到共轭结构, 我的也是经验两双键中间隔了一个碳正离子,你就把这个碳正离子去掉再来计算n电子数,也是 6 个. 注意: 若隔的是碳负离子就不能这样了, 一定要是碳正离子才可以这样算.这个和上面那个有点相似, 但隔的是碳负离子, 一个碳负离子算2个电子, 图中有2个碳负离子,还有3个双键,有10个n电子.图中左边, 一双键连接两个环, 可以写出它的共振体, 当然尽量往有芳香性的写, 而且芳香性的环稳定,贡献大.这样下面的五元环有6 n电子,上面的三元环有2n 电子. 都有芳香性.因为三键中两n键互相垂直,孤只有一个能与其他双键共轭,。
芳香性的判断芳香性是指化合物分子结构中的一种特殊性质,它使分子带有一种特殊的气味。
芳香烃化合物是一类具有芳香性的有机化合物,它们的分子结构中至少含有一个或多个苯环或取代苯环,这使它们具有强烈的芳香性。
芳香性可以通过一系列实验方法进行判断与测试。
一般来说,芳香性的判断有以下几种方法:一、气味判断法比较直观的方法,即通过嗅觉感受样品产生的气味,若有强烈或特殊的气味,则可以认为该样品具有芳香性。
这种方法对于浓度较高、气味较强的样品比较适用,但也存在一定的主观因素。
因此,对于对气味较为敏感的人群,应该采用其他方法。
二、物理化学性质法芳香性与分子的物理化学性质有关,可以通过它们的熔点、沸点、密度等物理量的大小,来初步判断分子是否具有芳香性。
一般来说,芳香烃的熔点与沸点较高,密度较大,分子中含有许多π电子共轭结构,因此具有较强的解离极性,易被溶剂包络。
这种方法虽然具有一定的准确性,但对于含有多种不同基团的化合物,判断会更加困难。
三、光谱分析法光谱分析技术是一种非常有效的分析方法,其中红外光谱和紫外光谱常用于检测芳香性。
在红外光谱中,如果存在苯环的C-H伸缩振动谱线的位置,可以判断分子是否含有芳香性,同样的,在紫外光谱中,芳香烃的吸收带也比较容易区分。
四、化学反应法芳香性化合物与其他化合物之间会发生特定的化学反应,根据这些反应也可以判断芳香性。
例如,苯环经过氧化将会形成苯酚,氧化还原也会产生具有特殊芳香性的二苯乙烷等。
此方法对化学成分学习较好的人或化学专业的人较为适用。
综上所述,判断芳香性的方法有很多种,每一种方法都有其局限性和优势,因此,需要在实际应用过程中根据具体情况选择合适的方法。
一,芳香性判据——Hückel规则Hückel规则:一个单环化合物只要具有平面离域体系,它的π 电子数为4n+2(n=0,1,3,…整数),就有芳香性(当 n>7 时,有例外).对能看懂这篇文章的人说:苯有有芳香性,那就是废话了.非苯芳烃:凡符合Hückel规则,不含苯环的具有芳香性的烃类化合物,非苯芳烃包括一些环多烯和芳香离子等.二,一些非苯芳烃1.环多烯烃:(通式CnHn )又称作轮烯(也有人把n≥10 的环多烯烃称为轮烯).环xx,苯,环辛四烯和环十八碳九烯分别称[4]轮烯,[6]轮烯,[8]轮烯和[18]轮烯.它们是否具有芳香性,可按Hückel规则判断,首先看环xx的碳原子是否均处于一个平面内,其次看π 电子数是否符合 4n+2.[18]轮烯环xx碳原子基本xx在一个平面内,π 电子数为 4n+2(n=4),因此具有芳香性.又如[10]轮烯,π 电子数符合 4n+2(n=2),但由于环内两个氢原子的空间位阻,使环xx碳原子不能在一个平面内,故无芳香性.2,芳香离子:某些烃无芳香性,但转变成离子后,则有可能显示芳香性.如环戊二烯无芳香性,但形成负离子后,不仅组成环的 5 个碳原子在同一个平面xx,且有 6 个π 电子(n=1),故有芳香性.与此相似,环辛四烯的两价负离子也具有芳香性.因为形成负离子后,原来的碳环由盆形转变成了平面正八边形,且有 10 个π 电子(n=2),故有芳香性.环戊二烯负离子其它某些离子也具有芳香性,例如,环丙烯正离子(Ⅰ),环xx两价正离子(Ⅱ)和两价负离子(Ⅲ),环庚三烯正离子(Ⅳ).因为它们都具有平面结构,且π电子数分别位 2,2,6,6,符合 4n+2(n 分别位0,0,1,1).具有芳香性的离子也属于非苯芳烃.3,稠环体系:与苯相似,萘,蒽,菲等稠环芳烃,由于它们的成环碳原子都在同一个平面xx,且π 电子数分别为 10 和14,符合Hückel 规则,具有芳香性.虽然萘,蒽,菲是稠环芳烃,但构成环的碳原子都处在最外层的环xx,可看成是单环共轭多烯,故可用Hückel 规则来判断其芳香性.与萘,蒽,等稠环芳烃相似,对于非苯系的稠环化合物,如果考虑其成环原子的外围π 电子,也可用Hückel 规则判断其芳香性.例如,薁(蓝烃)是由一个五元环和一个七元环稠合而成的,其成环原子的外围π 电子有 10 个,相当于[10]轮烯,符合Hückel 规则(n=2),也具有芳香性.三.π 电子数的计算也许你在做题目的时候对于π 电子数的计算弄糊涂了,比如:觉得怎么同是N原子怎么有时候要把它的孤对电子算进去,有时候又不要呢.我以前就是这样的,现在基本知道判断芳香性了,只是有点经验,有些具体原理我还是不懂.下面是我的一些心得体会,若有错误还请留言指正.下面用的例子xx的杂原子是N,其他原子类推.吡咯的N的孤对电子要算进去,在家两双键xx的4个电子,共有6电子,有芳香性.吡啶xxN原子xx连有双键,Nxx孤对电子不能算进去,三双键共轭,共有6个π电子,有芳香性.两个N都与双键相连,孤对电子也都不算,还是6个π电子有一个N与双键相连,有一个没有.按以xx的思路,与双键相连的Nxx的孤对电子不算进去,而右边的N原子xx的孤对电子要算进去,结果也是6个π电子这种结构的也具有芳香性,看起来这个七元环没有达到共轭结构,我的也是经验,两双键xx间隔了一个碳正离子,你就把这个碳正离子去掉再来计算π电子数,也是6个.注意:若隔的是碳负离子就不能这样了,一定要是碳正离子才可以这样算.这个和xx面那个有点相似,但隔的是碳负离子,一个碳负离子算2个电子,图xx有2个碳负离子,还有3个双键,有10个π电子.图xx左边,一双键连接两个环,可以写出它的共振体,当然尽量往有芳香性的写,而且芳香性的环稳定,贡献大.这样下面的五元环有6π电子,xx面的三元环有2π电子.都有芳香性.因为三键xx两π键互相垂直,孤只有一个能与其他双键共轭,。
芳香性的判断1931年,德国化学家休克尔将分子轨道(MO )理论推广到共轭体系的简单有机分子,提出了简单有用的休克尔分子轨道(HMO )理论。
通过HMO 理论计算,推导出著名的(4n+2)规则----休克尔规则。
一、休克尔规则休克尔规则最一般的表述如下:在完全共轭的平面单环体系中,如果环中参与离域的π电子数为(4n+2)个(n=0,1,2,……),则该体系具有芳香性。
例1:下列体系均具有芳香性:1、环丙烯正离子:≡(n=0)2、环丁二烯双正离子:≡3、环丁二烯双负离子:≡4、环戊二烯负离子:≡5、苯:≡6、环庚三烯正离子: ≡7、环辛四烯双正离子: ≡8、环辛四烯双负离子: ≡二、休克尔规则的导出1、休克尔分子轨道理论分子轨道理论是用来解释共价键形成过程的理论之一。
分子轨道理论认为:共价键的形成是成键原子的原子轨道(AO )相互接近、相互作用而重新组成整体的分子轨道(MO )的结果,分子轨道是成键原子的能量相近、对称性相同的原子轨道发生最大重叠而形成的。
分子轨道理论是从分子的整体出发考虑成键过程的,成键电子不再固定在两个成键原子之间,而是分布到整个分子当中,即成键电子不再是定域的,而是离域的。
因此,用分子轨道理论描述离域体系更为恰当。
分子轨道理论描述共价键的形成过程过于复杂,休克尔对此进行了简化。
休+ - - + + + - -克尔认为:在离域体系中,σ键是定域于两个成键原子之间的,但π键是离域的,而化学性质主要与π键有关,这样我们就可以只关注由p 原子轨道组合形成的π分子轨道得到的π键。
这种只考虑π键的分子轨道理论就称为休克尔分子轨道理论(HMO )。
也就是说,HMO 为简化了的MO 。
例如,苯分子形成过程的休克尔分子轨道能级图如下:*6π*4π *5π6个p 轨道(AO ) 2π3π1π基态时,6个p 电子分成3对,分别填入3个能量较低的成键分子轨道1π、2π和3π中,而3个能量较高的反键分子轨道是全空的。