芳香性与休克尔规则PPT课件
- 格式:ppt
- 大小:152.50 KB
- 文档页数:10


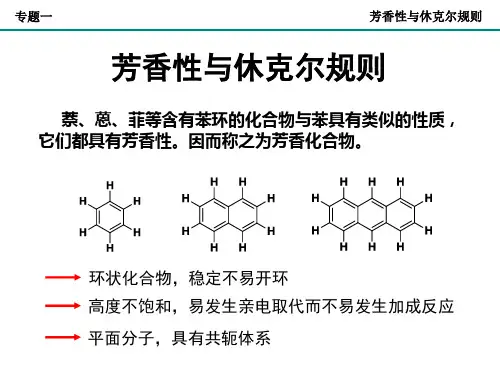







一、Huckel规则
概念:一个具有同平面的环状闭合共轭体系的单环多烯化合物,只有当它的π电子数为4n+2时,才可能有芳香族的稳定性。
根据分子轨道理论,n个原子轨道可组成n个分子轨道,其中,成键轨道的能量低于原子轨道的能量,反键轨道的能量高于原子轨道的能量,非键轨道的能量等于原子轨道的能量。
画出顶角朝下的圆内接正n边形,则每一个顶角的位置相当于一个分子轨道的能级,圆心的水平位置相当于未成键的原子轨道能级。
在圆心水平位置以下的顶角是成键轨道,处在圆心水平位置以上的顶角是反键轨道。
电子在分子轨道的填充方式,遵守能量最低原理和Hund规则。
当所有的成键轨道都被自旋成对的电子充满,非键原子轨道也同样全充满或全空时,为稳定的闭壳层结构。
当单环共轭体系的π电子数为4n+2时,即有2,6,10,……个电子时,电子恰好填满成键轨道。
分子能量比相应的直链共轭多烯烃低,分子具有芳香性。
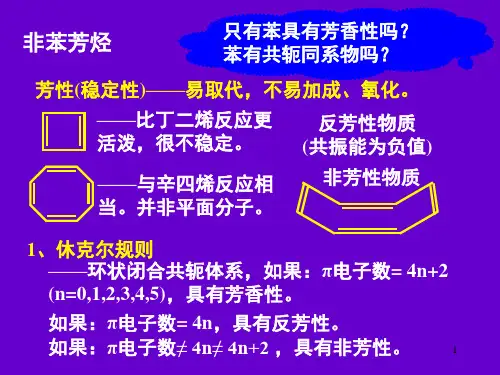
当π电子数为4n时,如4,8,12,……时,在两个非键分子轨道中有两个自旋平行单电子,相当两个自由基电子,因此特别不稳定。
与相应开链的共轭烯烃比较反而能量更高,不具芳香性,是反芳香性分子。
二、方向性的特性
1、独特的化学性质。
芳香族化合物虽然是高度不饱和的,但与其他不饱和烃不同,难发生加成和氧化反应,易于发生取代反应。
2、芳香族化合物在结构上都是具有共平面的环状封闭共轭体系,环上的每个原子都有一个垂直于环平面的p轨道而形成大π键。
3、独特的光谱学性质。
芳香族化合物的π电子环流,在外加磁场的作用下产生诱导磁场,处于去屏蔽区的芳环氢质子的化学位移移向低场,δ值一般在7左右。
5.3.4 芳香性与Hückel规则
芳香性化合物不容易发生加
成反应,但容易发生亲电取代反
应,这和不饱和烃类化合物具有
明显的区别。
Hückel规则解释了具有芳香
性的化合物的结构特点,是芳香
性的重要判据。
[18]轮烯的
结构与芳香性
一. 芳烃的化学性质与芳香性
与烯烃和炔烃等不饱和烃相比,芳环不易发生加成反应,但容易发生亲电取代反应,这种性质是由芳环的结构所决定的。
Hückel规则——芳香性的判据
1.环状平面结构
2.连续的环状共轭体系
3.π电子数是4n+2(n=0,1,2,…)
二. 轮烯的结构
具有单环结构的共轭多烯烃为轮烯。
[4]轮烯[6]轮烯[8]轮烯[10]轮烯[12]轮烯[14]轮烯[18]轮烯环丁二烯苯
环辛四烯
环癸五烯
[4]轮烯
反芳香性
[6]轮烯
芳香性
[8]轮烯
非芳香性
[10]轮烯
非芳香性
[12]轮烯
非芳香性
[14]轮烯
非芳香性
[18]轮烯
芳香性
三. 其他的环状结构的芳香性
其他的五元及多元环状结构及其离子的芳香性。
环戊二烯(无芳香性)环戊二烯基自由基(非芳香性)
环戊二烯基正离子(反芳香性)环戊二烯基负离子(芳香性)
1,3,5-环庚三烯(非芳香性)环辛四烯基二价正离子和二价负离子(芳香性)
1,3,5-环庚三烯基正离子(芳香性)
四. 其他的芳环和杂芳环
萘(芳香性)蒽(芳香性)菲(芳香性)
吡啶(芳香性)
薁(芳香性)吡咯(芳香性)。