芳香性判断技巧修订版
- 格式:docx
- 大小:242.31 KB
- 文档页数:4
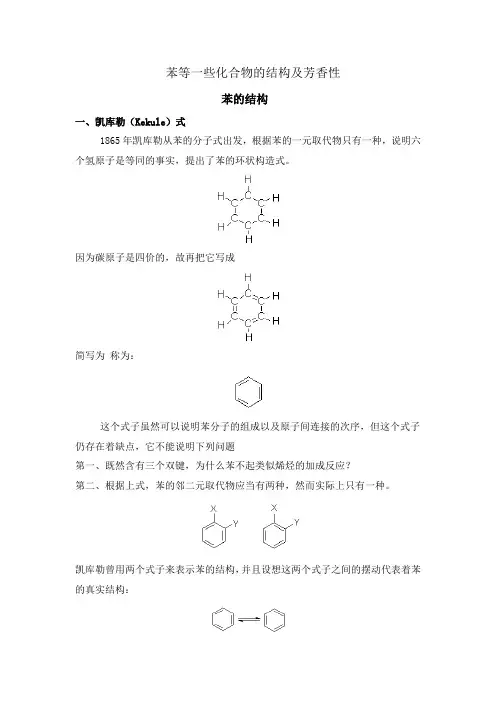
苯等一些化合物的结构及芳香性苯的结构一、凯库勒(Kekule)式1865年凯库勒从苯的分子式出发,根据苯的一元取代物只有一种,说明六个氢原子是等同的事实,提出了苯的环状构造式。
因为碳原子是四价的,故再把它写成简写为称为:这个式子虽然可以说明苯分子的组成以及原子间连接的次序,但这个式子仍存在着缺点,它不能说明下列问题第一、既然含有三个双键,为什么苯不起类似烯烃的加成反应?第二、根据上式,苯的邻二元取代物应当有两种,然而实际上只有一种。
凯库勒曾用两个式子来表示苯的结构,并且设想这两个式子之间的摆动代表着苯的真实结构:由此可见,凯库勒式并不能确切地反映苯的真实情况。
二、苯的稳定性氢化热是衡量分子内能大小尺度。
氢化热越大分子内能越高,越不稳定;氢化热越低,分子内能越低,分子越稳定。
1、的氢化热为119.6kj/mol2、如果苯的构造式用凯库勒式表示的话,苯的氢化热为环己烯氢化热的三倍。
119.6*3=358.8KJ/mol3、实际上苯的氢化热是208.4KJ/mol,比预计的数值低150.4KJ/mol.这是由于苯环中存在共轭体系,π电子高度离域的结果,这部分能量为苯的共轭能或离域能。
从上所述,我们可以认识到苯分子具有较低的内能,分子稳定,是一种具有特殊稳定性的物质。
三、苯分子结构的价键观点根据现代物理方法(如X射线法,光谱法等)证明了苯分子是一个平面正六边形构型,键角都是120o ,碳碳键的键长都是0.1397nm。
按照轨道杂化理论,苯分子中六个碳原子都以sp2杂化轨道互相沿对称轴的方向重叠形成六个C-C σ键,组成一个正六边形。
每个碳原子各以一个sp2杂化轨道分别与氢原子1s轨道沿对称轴方向重叠形成六个C-H σ键。
由于是sp2杂化,所以键角都是120o,所有碳原子和氢原子都在同一平面上。
每个碳原子还有一个垂直于σ键平面的p轨道,每个p轨道上有一个p电子,六个p轨道组成了大π键。
四、苯的分子轨道模型分子轨道法认为六个p 轨道线性组合成六个π分子轨道,其中三个成键轨ψ1ψ2ψ3 和三个反键轨道ψ4ψ5ψ6 。

有机化学基本理论主讲人:史达清3. 芳香性芳香性化合物的特点:(1)较高的碳/氢比例;(2)键长的平均化;(3)分子的共平面性;(4)共轭能;(5)特征光谱(在1H NMR 出现环电流,使环上质子化学位移移向低场);(6)化学性质(结构具有特殊稳定性,易被取代,不易被加成和氧化)。
芳香性的判据休克尔(Hückel)规则:在由sp2杂化碳原子组成的平面单环体系中,含有4n+2 个π 电子的体系将具有与惰性气体相类似的闭壳层结构,从而显示出芳香性。
在具体判断时,不能仅从4n+2 个π电子数进行判断。
一般要同时满足以下三个条件才具有芳香性:(1)闭环共轭体系;(2)成环的所有的原子在同一个平面上(即共平面) ;(3)4n+2 个π 电子举例:(1)环丙烯衍生物(2)环丁二烯衍生物(3)环戊二烯衍生物(4)环庚三烯衍生物(5)环辛四烯衍生物(6)轮烯类化合物其实对于单环共轭多烯,只有当成键轨道或非键轨道完全填充满电子时,才具有闭壳层结构。
如下图所示:(7)稠环芳烃一般,4n+2 规则只适用于平面单环体系,不适用于稠环体系。
对于稠环体系只能用分子轨道法经计算后确定成键轨道、非键轨道和反键轨道数目来看能否形成封闭的π 电子壳层而确定。
对较为简单的多环体系,其中没有三个以上的环所共用的原子,如果π 电子数为4n+2 ,则可以判别该体系是芳香性的。
(8)杂芳环化合物杂芳香性化合物是环上有杂原子取代的具有4n+2 个π 电子并显示芳香特点的化合物,它可以分为两类,一类是利用体系中杂原子上未共享电子对的一些化合物。
例如呋喃、噻吩、吡咯、噻唑、咪唑等。
这些化合物中的氧、氮或硫原子上的未共享电子对和二烯部分的四个π 电子结合得到一个 6 π 电子的4n+2 离域体系。
它们的芳香性大小是:噻吩>吡咯>呋喃。
另外一类是环上杂原子上的未共享电子对并未参与芳香性稳定化作用,例如吡啶、嘧啶等。
此外,还有一些以氮为中心原子的周边共轭体系,例如环[3.2.2]嗪、环[4.4.3]嗪也都是稳定的芳香性化合物。


芳香性判断技巧-标准化文件发布号:(9556-EUATWK-MWUB-WUNN-INNUL-DDQTY-KII一,芳香性判据——Hückel规则Hückel规则:一个单环化合物只要具有平面离域体系,它的π 电子数为4n+2(n=0,1,3,…整数),就有芳香性(当 n>7 时,有例外).对能看懂这篇文章的人说:苯有有芳香性,那就是废话了.非苯芳烃:凡符合Hückel规则,不含苯环的具有芳香性的烃类化合物,非苯芳烃包括一些环多烯和芳香离子等.二,一些非苯芳烃1.环多烯烃:(通式CnHn )又称作轮烯(也有人把n≥10 的环多烯烃称为轮烯).环丁烯,苯,环辛四烯和环十八碳九烯分别称[4]轮烯,[6]轮烯,[8]轮烯和[18]轮烯.它们是否具有芳香性,可按Hückel规则判断,首先看环上的碳原子是否均处于一个平面内,其次看π 电子数是否符合 4n+2.[18]轮烯环上碳原子基本上在一个平面内,π 电子数为 4n+2(n=4),因此具有芳香性.又如[10]轮烯,π 电子数符合 4n+2(n=2),但由于环内两个氢原子的空间位阻,使环上碳原子不能在一个平面内,故无芳香性.2,芳香离子:某些烃无芳香性,但转变成离子后,则有可能显示芳香性.如环戊二烯无芳香性,但形成负离子后,不仅组成环的 5 个碳原子在同一个平面上,且有 6 个π 电子(n=1),故有芳香性.与此相似,环辛四烯的两价负离子也具有芳香性.因为形成负离子后,原来的碳环由盆形转变成了平面正八边形,且有 10 个π 电子(n=2),故有芳香性.环戊二烯负离子其它某些离子也具有芳香性,例如,环丙烯正离子(Ⅰ),环丁二烯两价正离子(Ⅱ)和两价负离子(Ⅲ),环庚三烯正离子(Ⅳ).因为它们都具有平面结构,且π 电子数分别位 2,2,6,6,符合 4n+2(n 分别位0,0,1,1).具有芳香性的离子也属于非苯芳烃.3,稠环体系:与苯相似,萘,蒽,菲等稠环芳烃,由于它们的成环碳原子都在同一个平面上,且π 电子数分别为 10 和 14,符合 Hückel 规则,具有芳香性.虽然萘,蒽,菲是稠环芳烃,但构成环的碳原子都处在最外层的环上,可看成是单环共轭多烯,故可用 Hückel 规则来判断其芳香性.与萘,蒽,等稠环芳烃相似,对于非苯系的稠环化合物,如果考虑其成环原子的外围π 电子,也可用 Hückel 规则判断其芳香性.例如,薁(蓝烃)是由一个五元环和一个七元环稠合而成的,其成环原子的外围π 电子有 10 个,相当于[10]轮烯,符合 Hückel 规则(n=2),也具有芳香性.三.π 电子数的计算也许你在做题目的时候对于π 电子数的计算弄糊涂了,比如:觉得怎么同是N原子怎么有时候要把它的孤对电子算进去,有时候又不要呢.我以前就是这样的,现在基本知道判断芳香性了,只是有点经验,有些具体原理我还是不懂.下面是我的一些心得体会,若有错误还请留言指正.下面用的例子中的杂原子是N,其他原子类推.吡咯的N的孤对电子要算进去,在家两双键上的4个电子,共有6电子,有芳香性.吡啶中N原子上连有双键,N上孤对电子不能算进去,三双键共轭,共有6个π电子,有芳香性.两个N都与双键相连,孤对电子也都不算,还是6个π电子有一个N与双键相连,有一个没有.按以上的思路,与双键相连的N上的孤对电子不算进去,而右边的N原子上的孤对电子要算进去,结果也是6个π电子这种结构的也具有芳香性,看起来这个七元环没有达到共轭结构,我的也是经验,两双键中间隔了一个碳正离子,你就把这个碳正离子去掉再来计算π电子数,也是6个.注意:若隔的是碳负离子就不能这样了,一定要是碳正离子才可以这样算.这个和上面那个有点相似,但隔的是碳负离子,一个碳负离子算2个电子,图中有2个碳负离子,还有3个双键,有10个π电子.图中左边,一双键连接两个环,可以写出它的共振体,当然尽量往有芳香性的写,而且芳香性的环稳定,贡献大.这样下面的五元环有6π电子,上面的三元环有2π电子.都有芳香性.因为三键中两π键互相垂直,孤只有一个能与其他双键共轭,。




芳香性判断技巧The final revision was on November 23, 2020一,芳香性判据——Hückel规则Hückel规则:一个单环化合物只要具有平面离域体系,它的π 电子数为4n+2(n=0,1,3,…整数),就有芳香性(当 n>7 时,有例外).对能看懂这篇文章的人说:苯有有芳香性,那就是废话了.非苯芳烃:凡符合Hückel规则,不含苯环的具有芳香性的烃类化合物,非苯芳烃包括一些环多烯和芳香离子等.二,一些非苯芳烃1.环多烯烃:(通式CnHn?)又称作轮烯(也有人把n≥10 的环多烯烃称为轮烯).环丁烯,苯,环辛四烯和环十八碳九烯分别称[4]轮烯,[6]轮烯,[8]轮烯和[18]轮烯.它们是否具有芳香性,可按Hückel规则判断,首先看环上的碳原子是否均处于一个平面内,其次看π 电子数是否符合 4n+2.[18]轮烯环上碳原子基本上在一个平面内,π 电子数为 4n+2(n=4),因此具有芳香性.又如[10]轮烯,π 电子数符合 4n+2(n=2),但由于环内两个氢原子的空间位阻,使环上碳原子不能在一个平面内,故无芳香性.2,芳香离子:某些烃无芳香性,但转变成离子后,则有可能显示芳香性.如环戊二烯无芳香性,但形成负离子后,不仅组成环的 5 个碳原子在同一个平面上,且有 6 个π 电子(n=1),故有芳香性.与此相似,环辛四烯的两价负离子也具有芳香性.因为形成负离子后,原来的碳环由盆形转变成了平面正八边形,且有 10 个π 电子(n=2),故有芳香性.环戊二烯负离子其它某些离子也具有芳香性,例如,环丙烯正离子(Ⅰ),环丁二烯两价正离子(Ⅱ)和两价负离子(Ⅲ),环庚三烯正离子(Ⅳ).因为它们都具有平面结构,且π 电子数分别位 2,2,6,6,符合4n+2(n 分别位0,0,1,1).具有芳香性的离子也属于非苯芳烃.3,稠环体系:与苯相似,萘,蒽,菲等稠环芳烃,由于它们的成环碳原子都在同一个平面上,且π 电子数分别为 10 和 14,符合 Hückel 规则,具有芳香性.虽然萘,蒽,菲是稠环芳烃,但构成环的碳原子都处在最外层的环上,可看成是单环共轭多烯,故可用 Hückel 规则来判断其芳香性.与萘,蒽,等稠环芳烃相似,对于非苯系的稠环化合物,如果考虑其成环原子的外围π 电子,也可用 Hückel 规则判断其芳香性.例如,薁(蓝烃)是由一个五元环和一个七元环稠合而成的,其成环原子的外围π 电子有 10 个,相当于[10]轮烯,符合 Hückel 规则(n=2),也具有芳香性.三.π 电子数的计算也许你在做题目的时候对于π 电子数的计算弄糊涂了,比如:觉得怎么同是N原子怎么有时候要把它的孤对电子算进去,有时候又不要呢.我以前就是这样的,现在基本知道判断芳香性了,只是有点经验,有些具体原理我还是不懂.下面是我的一些心得体会,若有错误还请留言指正.下面用的例子中的杂原子是N,其他原子类推.吡咯的N的孤对电子要算进去,在家两双键上的4个电子,共有6电子,有芳香性.吡啶中N原子上连有双键,N上孤对电子不能算进去,三双键共轭,共有6个π电子,有芳香性.两个N都与双键相连,孤对电子也都不算,还是6个π电子有一个N与双键相连,有一个没有.按以上的思路,与双键相连的N上的孤对电子不算进去,而右边的N原子上的孤对电子要算进去,结果也是6个π电子这种结构的也具有芳香性,看起来这个七元环没有达到共轭结构,我的也是经验,两双键中间隔了一个碳正离子,你就把这个碳正离子去掉再来计算π电子数,也是6个.注意:若隔的是碳负离子就不能这样了,一定要是碳正离子才可以这样算.这个和上面那个有点相似,但隔的是碳负离子,一个碳负离子算2个电子,图中有2个碳负离子,还有3个双键,有10个π电子.图中左边,一双键连接两个环,可以写出它的共振体,当然尽量往有芳香性的写,而且芳香性的环稳定,贡献大.这样下面的五元环有6π电子,上面的三元环有2π电子.都有芳香性.因为三键中两π键互相垂直,孤只有一个能与其他双键共轭,。

芳香性判断技巧范文芳香性是指物质具有可感知的香味,对于人们来说,通过感知香味可以判断物质的成分、性质和质量。
掌握芳香性判断技巧可以帮助我们更好地了解物质,下面是一些常用的芳香性判断技巧。
1.嗅闻物质时要避免强烈的刺激性香味,可以在空气中摆动手指,然后将香味带到鼻子附近闻,避免香味被刺激的患处。
2.嗅闻物质时不可过量,适量嗅闻一次,避免过多刺激感官。
3.嗅闻物质时要注意区分短暂的刺激性香味和持久的清淡香味。
刺激性香味常常意味着物质含有刺激性或有毒性成分,而清淡香味则反映了物质可能的化学性质。
4.对于芳香性判断,通常通过观察变化来帮助判断。
一些物质在受热或氧化作用下会产生特殊的香味,例如苯酚加热会发出酚或苯酚烧灼味。
5.薄荷或柠檬酸的含有物质往往具有清凉的香味,而柠檬酸常用于防腐剂,因此柠檬酸的香味往往伴随着有保鲜或防腐作用的物质。
6.氧化物质通常具有淡淡的芳香性,例如酸性氧化剂一氧化二氮、一氧化硫等。
7.一些香味可用于判断物质的品质。
例如,蔗糖具有甜味,如果发现物质具有类似蔗糖的香味,可能表明物质属于糖类。
再比如,纯净的咖啡豆应该具有浓郁的咖啡香味,而受潮变质的咖啡豆会失去香味。
8.通过比较不同物质之间的香味可以判断它们的差异。
例如,同样是水果类的香味,苹果的香味通常酸甜而清爽,橙子的香味则更加醇厚和温暖。
9.香草、草本植物往往具有浓郁的芳香性,而一些花朵则具有独特的香气,如玫瑰花具有浓郁的花香味。
总之,芳香性判断技巧需要通过嗅闻物质并结合观察和经验来进行判断。
掌握这些技巧可以帮助我们更好地了解不同物质的特性和性质,但需要注意不要用嗅觉直接接触一些有害物质,以免对身体造成损害。

芳香性概述内容提要1. 芳香性1.1芳香性的定义与基本判据1.2芳香化合物的基本化学性质1.3芳香化合物的基本结构特征1.4芳香化合物的核磁共振性质和芳香性的检验手段1.4.1核磁共振原理1.4.2 电磁屏蔽效应1.4.3 全反式[18]轮烯的核磁共振1.4.4 芳香化合物的核磁共振性质1.4.5 芳香性的检验手段1.5芳香性的定性判据——休克尔规则1.5.1休克尔规则的表述1.5.2. 休克尔规则的应用举例1.5.3适用休克尔规则的常见非苯芳香化合物1.6周边修正1.6.1萘和薁1.6.2芘1.6.3双键修正在周边修正中的应用1.7芳香性定性判据的局限性2. 反芳香性2.1反芳香性的定义与基本判据2.2典型的反芳香化合物2.2.1 环丁二烯2.2.2 环戊二烯正离子3. 非芳香性4. 同芳香性4.1环辛四烯正离子4.2其它典型的同芳香性分子4.2.1环戊烯-4-正离子4.2.2降冰片烯-7-正离子4.2.3亚甲叉[10]轮烯5. Y芳香性6. 休克尔分子轨道理论6.1变分法概述6.2尝试波函数的构建方法6.3尝试波函数Ψ = c A A + c B B的构建举例6.4同核双原子分子的变分法构建结果6.5异核双原子分子的变分法构建结果6.6 αA和αB的差值对成键和反键轨道能E+和E-的影响6.7休克尔分子轨道法7. 富烯7.1线性π体系分子轨道能量的计算公式7.2使用休克尔分子轨道法简便求解分子轨道能和轨道系数的举例:1,3-丁二烯7.3富烯与1,3,5-己三烯7.3.1 富烯7.3.2 1,3,5-己三烯7.3.3 富烯与1,3,5-己三烯的比较7.3.4 休克尔分子轨道法的局限性8. 环丁二烯与姜泰勒畸变8.1单一环状π体系分子轨道能量的计算公式8.2多边形法则8.3休克尔分子轨道法对环丁二烯的处理8.4环丁二烯的真实情况与姜-泰勒畸变8.4.1 环丁二烯的真实情况8.4.2 姜-泰勒畸变正文1.芳香性(Aromaticity)1.1芳香性的定义与基本判据芳香化合物一词,最早源于苯的合成,天然产物安息香胶中,含有苯甲酸(俗称安息香酸),苯甲酸与碱共热可脱去羧基得到苯,其带有芬芳气味[1]最初,芳香化合物的范围仅限于苯与其同系物,后来随着人们对芳香性的认识不断加深,芳香性的概念也不断被扩展和重新定义公元1931年,德国物理学家和物理化学家艾瑞克·休克尔(Erich Hückel)提出,离域π电子数符合4n + 2规则的平面共轭多烯,具有芳香性,其中n是非负整数[2]。

一,芳香性判据——Hu ckel规则H u ckel规则:一个单环化合物只要具有平面离域体系,它的n电子数为4n+2(n=0,1,3, ••整数),就有芳香性(当n>7时,有例外).对能看懂这篇文章的人说:苯有有芳香性,那就是废话了•非苯芳烃:凡符合Huckel规则,不含苯环的具有芳香性的烃类化合物,非苯芳烃包括一些环多烯和芳香离子等•二,一些非苯芳烃1.环多烯烃:(通式CnHn )又称作轮烯(也有人把n》10的环多烯烃称为轮烯).环丁烯,苯,环辛四烯和环十八碳九烯分别称[4]轮烯,[6]轮烯,[8]轮烯和[18]轮烯.它们是否具有芳香性,可按Huckei规则判断,首先看环上的碳原子是否均处于一个平面内,其次看n 电子数是否符合4n+2.[18]轮烯环上碳原子基本上在一个平面内,n电子数为4n+2(n=4),因此具有芳香性.又如[10]轮烯,n电子数符合4n+2(n=2),但由于环内两个氢原子的空间位阻,使环上碳原子不能在一个平面内,故无芳香性.2,芳香离子:某些烃无芳香性,但转变成离子后,则有可能显示芳香性•如环戊二烯无芳香性,但形成负离子后,不仅组成环的5个碳原子在同一个平面上,且有6个n电子(n=1),故有芳香性.与此相似,环辛四烯的两价负离子也具有芳香性•因为形成负离子后,原来的碳环由盆形转变成了平面正八边形,且有10个n电子(n二2),故有芳香性环戊二烯负离子其它某些离子也具有芳香性,例如,环丙烯正离子(I),环丁二烯两价正离子(n)和两价负离子(川),环庚三烯正离子(W ).因为它们都具有平面结构,且n电子数分别位2,2,6,6,符合4n+2(n 分别位0,0,1,1).具有芳香性的离子也属于非苯芳烃.3,稠环体系:与苯相似,萘,蔥,菲等稠环芳烃,由于它们的成环碳原子都在同一个平面上,且n电子数分别为10和14,符合Huckel规则,具有芳香性. 虽然萘,蔥,菲是稠环芳烃,但构成环的碳原子都处在最外层的环上,可看成是单环共轭多烯,故可用Huckel规则来判断其芳香性.与萘,蔥,等稠环芳烃相似,对于非苯系的稠环化合物,如果考虑其成环原子的外围n 电子,也可用Huckel规则判断其芳香性.例如,薁(蓝烃)是由一个五元环和一个七元环稠合而成的,其成环原子的外围n电子有10个,相当于[10]轮烯,符合Huckel规则(n=2),也具有芳香性.三• n电子数的计算也许你在做题目的时候对于n电子数的计算弄糊涂了,比如:觉得怎么同是N原子怎么有时候要把它的孤对电子算进去,有时候又不要呢•我以前就是这样的,现在基本知道判断芳香性了,只是有点经验,有些具体原理我还是不懂.下面是我的一些心得体会,若有错误还请留言指正.下面用的例子中的杂原子是N,其他原子类推.吡咯的N的孤对电子要算进去,在家两双键上的4个电子,共有6电子,有芳香性.吡啶中N原子上连有双键,N上孤对电子不能算进去,三双键共轭,共有6个n电子, 有芳香性.两个N都与双键相连,孤对电子也都不算,还是6个n电子有一个N与双键相连,有一个没有.按以上的思路,与双键相连的N上的孤对电子不算进去,而右边的N原子上的孤对电子要算进去,结果也是6个n电子这种结构的也具有芳香性, 看起来这个七元环没有达到共轭结构, 我的也是经验两双键中间隔了一个碳正离子,你就把这个碳正离子去掉再来计算n电子数,也是 6 个. 注意: 若隔的是碳负离子就不能这样了, 一定要是碳正离子才可以这样算.这个和上面那个有点相似, 但隔的是碳负离子, 一个碳负离子算2个电子, 图中有2个碳负离子,还有3个双键,有10个n电子.图中左边, 一双键连接两个环, 可以写出它的共振体, 当然尽量往有芳香性的写, 而且芳香性的环稳定,贡献大.这样下面的五元环有6 n电子,上面的三元环有2n 电子. 都有芳香性.因为三键中两n键互相垂直,孤只有一个能与其他双键共轭,。
一,芳香性判据——Hückel规则Hückel规则:一个单环化合物只要具有平面离域体系,它的π 电子数为4n+2(n=0,1,3,…整数),就有芳香性(当 n>7 时,有例外).对能看懂这篇文章的人说:苯有有芳香性,那就是废话了.非苯芳烃:凡符合Hückel规则,不含苯环的具有芳香性的烃类化合物,非苯芳烃包括一些环多烯和芳香离子等.二,一些非苯芳烃1.环多烯烃:(通式CnHn )又称作轮烯(也有人把n≥10 的环多烯烃称为轮烯).环xx,苯,环辛四烯和环十八碳九烯分别称[4]轮烯,[6]轮烯,[8]轮烯和[18]轮烯.它们是否具有芳香性,可按Hückel规则判断,首先看环xx的碳原子是否均处于一个平面内,其次看π 电子数是否符合 4n+2.[18]轮烯环xx碳原子基本xx在一个平面内,π 电子数为 4n+2(n=4),因此具有芳香性.又如[10]轮烯,π 电子数符合 4n+2(n=2),但由于环内两个氢原子的空间位阻,使环xx碳原子不能在一个平面内,故无芳香性.2,芳香离子:某些烃无芳香性,但转变成离子后,则有可能显示芳香性.如环戊二烯无芳香性,但形成负离子后,不仅组成环的 5 个碳原子在同一个平面xx,且有 6 个π 电子(n=1),故有芳香性.与此相似,环辛四烯的两价负离子也具有芳香性.因为形成负离子后,原来的碳环由盆形转变成了平面正八边形,且有 10 个π 电子(n=2),故有芳香性.环戊二烯负离子其它某些离子也具有芳香性,例如,环丙烯正离子(Ⅰ),环xx两价正离子(Ⅱ)和两价负离子(Ⅲ),环庚三烯正离子(Ⅳ).因为它们都具有平面结构,且π电子数分别位 2,2,6,6,符合 4n+2(n 分别位0,0,1,1).具有芳香性的离子也属于非苯芳烃.3,稠环体系:与苯相似,萘,蒽,菲等稠环芳烃,由于它们的成环碳原子都在同一个平面xx,且π 电子数分别为 10 和14,符合Hückel 规则,具有芳香性.虽然萘,蒽,菲是稠环芳烃,但构成环的碳原子都处在最外层的环xx,可看成是单环共轭多烯,故可用Hückel 规则来判断其芳香性.与萘,蒽,等稠环芳烃相似,对于非苯系的稠环化合物,如果考虑其成环原子的外围π 电子,也可用Hückel 规则判断其芳香性.例如,薁(蓝烃)是由一个五元环和一个七元环稠合而成的,其成环原子的外围π 电子有 10 个,相当于[10]轮烯,符合Hückel 规则(n=2),也具有芳香性.三.π 电子数的计算也许你在做题目的时候对于π 电子数的计算弄糊涂了,比如:觉得怎么同是N原子怎么有时候要把它的孤对电子算进去,有时候又不要呢.我以前就是这样的,现在基本知道判断芳香性了,只是有点经验,有些具体原理我还是不懂.下面是我的一些心得体会,若有错误还请留言指正.下面用的例子xx的杂原子是N,其他原子类推.吡咯的N的孤对电子要算进去,在家两双键xx的4个电子,共有6电子,有芳香性.吡啶xxN原子xx连有双键,Nxx孤对电子不能算进去,三双键共轭,共有6个π电子,有芳香性.两个N都与双键相连,孤对电子也都不算,还是6个π电子有一个N与双键相连,有一个没有.按以xx的思路,与双键相连的Nxx的孤对电子不算进去,而右边的N原子xx的孤对电子要算进去,结果也是6个π电子这种结构的也具有芳香性,看起来这个七元环没有达到共轭结构,我的也是经验,两双键xx间隔了一个碳正离子,你就把这个碳正离子去掉再来计算π电子数,也是6个.注意:若隔的是碳负离子就不能这样了,一定要是碳正离子才可以这样算.这个和xx面那个有点相似,但隔的是碳负离子,一个碳负离子算2个电子,图xx有2个碳负离子,还有3个双键,有10个π电子.图xx左边,一双键连接两个环,可以写出它的共振体,当然尽量往有芳香性的写,而且芳香性的环稳定,贡献大.这样下面的五元环有6π电子,xx面的三元环有2π电子.都有芳香性.因为三键xx两π键互相垂直,孤只有一个能与其他双键共轭,。
芳香性判断技巧
HUA system office room 【HUA16H-TTMS2A-HUAS8Q8-HUAH1688】
一,芳香性判据——Hückel规则
Hückel规则:一个单环化合物只要具有平面离域体系,它的π 电子数为
4n+2(n=0,1,3,…整数),就有芳香性(当 n>7 时,有例外).
对能看懂这篇文章的人说:苯有有芳香性,那就是废话了.
非苯芳烃:凡符合Hückel规则,不含苯环的具有芳香性的烃类化合物,非苯芳烃包括一些环多烯和芳香离子等.
二,一些非苯芳烃
1.环多烯烃:(通式
CnHn?)又称作轮烯(也有人把n≥10 的环多烯烃称为轮烯).环丁烯,苯,环辛四烯和环十八碳九烯分别称[4]轮烯,[6]轮烯,[8]轮烯和[18]轮烯.它们是否具有芳香性,可按Hückel规则判断,首先看环上的碳原子是否均处于一个平面内,其次看π 电子数是否符合
4n+2.[18]轮烯环上碳原子基本上在一个平面内,π 电子数为 4n+2(n=4),因此具有芳香性.又如[10]轮烯,π 电子数符合 4n+2(n=2),但由于环内两个氢原子的空间位阻,使环上碳原子不能在一个平面内,故无芳香性.
2,芳香离子:某些烃无芳香性,但转变成离子后,则有可能显示芳香性.如环戊二烯无芳香性,但形成负离子后,不仅组成环的 5 个碳原子在同一个平面上,且有 6 个π 电子(n=1),故有芳香性.与此相似,环辛四烯的两价负离子也具有芳香性.因为形成负离子后,原来的碳环由盆形转变成了平面正八边形,且有 10 个π 电子(n=2),故有芳香性.
环戊二烯负离子
其它某些离子也具有芳香性,例如,环丙烯正离子(Ⅰ),环丁二烯两价正离子(Ⅱ)和两价负
离子(Ⅲ),环庚三烯正离子(Ⅳ).因为它们都具有平面结构,且π 电子数分别位 2,2,6,6,符合 4n+2(n 分别位0,0,1,1).
具有芳香性的离子也属于非苯芳烃.
3,稠环体系:与苯相似,萘,蒽,菲等稠环芳烃,由于它们的成环碳原子都在同一个平面上,且π 电子数分别为 10 和 14,符合Hückel 规则,具有芳香性.虽然萘,蒽,菲是稠环芳烃,但构成环的碳原子都处在最外层的环上,可看成是单环共轭多烯,故可用Hückel 规则来判断其芳香性.
与萘,蒽,等稠环芳烃相似,对于非苯系的稠环化合物,如果考虑其成环原子的外围π 电子,也可用Hückel 规则判断其芳香性.例如,薁(蓝烃)是由一个五元环和一个七元环稠合而成的,其成环原子的外围π 电子有 10 个,相当于[10]轮烯,符合Hückel 规则(n=2),也具
有芳香性.
三.π 电子数的计算
也许你在做题目的时候对于π 电子数的计算弄糊涂了,比如:觉得怎么同是N原子怎么有时候要把它的孤对电子算进去,有时候又不要呢.我以前就是这样的,现在基本知道判断芳
香性了,只是有点经验,有些具体原理我还是不懂.下面是我的一些心得体会,若有错误还请留言指正.下面用的例子中的杂原子是N,其他原子类推.
吡咯的N的孤对电子要算进去,在家两双键上的4个电子,共有6电子,有芳香性.
吡啶中N原子上连有双键,N上孤对电子不能算进去,三双键共轭,共有6个π电子,有芳香性.
两个N都与双键相连,孤对电子也都不算,还是6个π电子
有一个N与双键相连,有一个没有.按以上的思路,与双键相连的N上的孤对电子不算进去,而右边的N原子上的孤对电子要算进去,结果也是6个π电子
这种结构的也具有芳香性,看起来这个七元环没有达到共轭结构,我的也是经验,两双键中间隔了一个碳正离子,你就把这个碳正离子去掉再来计算π电子数,也是6个.注意:若隔的是碳负离子就不能这样了,一定要是碳正离子才可以这样算.
这个和上面那个有点相似,但隔的是碳负离子,一个碳负离子算2个电子,图中有2个碳负离子,还有3个双键,有10个π电子.
图中左边,一双键连接两个环,可以写出它的共振体,当然尽量往有芳香性的写,而且芳香性的环稳定,贡献大.这样下面的五元环有6π电子,上面的三元环有2π电子.都有芳香性.因为三键中两π键互相垂直,孤只有一个能与其他双键共轭,。