2019最新第六章化学热力学初步化学
- 格式:ppt
- 大小:916.04 KB
- 文档页数:68

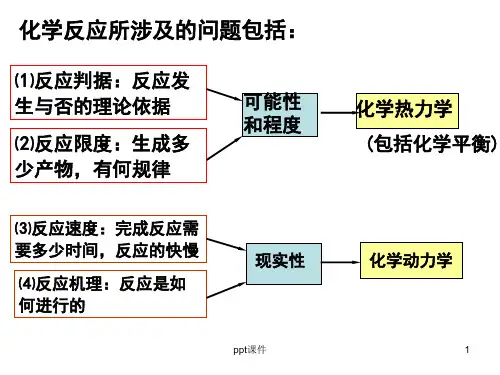

第六章化学热力学初步1、什么是化学热力学?它有什么特点?答:热力学是研究热能和机械能以及其他形式的能量之间的转化规律的一门科学。
用热力学的理论和方法研究化学,则产生了化学热力学。
可以解决化学反应中能量变化问题,同时可以解决化学反应进行的方向和限度问题。
特点:(1)是讨论大量质点的平均行为(宏观性质)不涉及少数或个别的分子,原子的微观性质,不依赖结构知识(战略问题)。
(2)由实践经验可推出热力学三大定律,进而推理演绎出基本的函数。
(3)通常回答是什么或怎么样可能性的问题,并不回答为什么和如何实现的问题。
(4)不涉及时间的概念,不能解决反应速度和反应机理的问题。
(5)热力学三大定律的意义不限制于纯自然科学。
2、什么叫相、系统和环境,开放系统、封闭系统和孤立系统,广度性质和强度性质,过程与途径,状态与状态函数?答:相:在所研究的系统中,物理状态,物理性质与化学性质完全均匀的部分。
要注意的是相与组分,状态是有区别的,讨论相是处于平衡状态的物质系统。
系统:为研究的需要,被划定为研究对象的与周围的物质或空间隔离开来的物质(又叫体系或物系),环境:体系以外,与体系有密切联系的周围部分(外界),注意:系统与环境之间有时有明显的界限(如N2和O2混合气中以O2为开放系统,N2为环境。
按照系统与环境之间的关系,将系统分为三类:广度量:具有加和性的物理量,如质量、物质的量、长度、体积等。
强度量:不具有加和性的物理量,如浓度、压强、温度、密度等。
过程:系统从一个状态(始态)变为另一个状态(终态)就说发生了一个过程。
如:恒温过程:T始=T终;恒压过程:P始=P终;恒容过程:V始=V终;可逆过程:无限接近平衡状态途径:体系由同一始态变为同一终态的状态变化所经历的具体方式。
过程:系统发生的任何变化叫过程,着眼点是始终态。
途径包括过程,即一个途径可能有一个或多个过程,着眼点是具体方式。
从A到B是发生了过程。
而A1、A2、B2、B2为途径。







