第1章实际气体热力性质
- 格式:ppt
- 大小:1.74 MB
- 文档页数:61




气体的热力性质本章提要及安排本章提要:本章主要讲述理想气体性质。
理想气体性质是指可以忽略分子自身占有的体积和分子间的相互作用力对气体宏观热力性质的影响。
在通常的工作参数范围内,按理想气体性质来计算气体工质的热力性质具有足够的精确度,其误差在工程上往往是允许的。
理想气体性质是研究工质热力性质的基础。
理想气体性质反映了气态工质的基本特性,更精确的气体、蒸气的热力性质表达式,往往可以在理想气体性质的基础上引入各种修正得出,本章对此亦作了简单的介绍。
本章要求:1.理解理想气体的概念,掌握理想气体状态方程式的应用。
2.掌握理想气体比热容及热力学能、焓和熵等状态参数的计算。
3.了解实际气体的状态方程式。
4.初步掌握依据实际气体状态方程式导得气体各种状态参数的方法。
学习建议:本章学习时间建议共4学时:1.理想气体性质 1学时2.理想气体比热容及参数计算 1学时3.实际气体状态方程 1学时4 .实际气体比热容及焓、熵函数1学时5.1 理想气体性质本节知识点:理想气体状态方程理想气体热系数理想气体热力学能和焓的特性理想气体熵方程本节参考图片:迈耶波义耳本节疑问解答:思考题5.1 思考题5.2 思考题5.3本节基本概念:阿伏伽德罗假说通用气体常数迈耶公式工质在通常的参数范围内可呈现为气、液、固三种聚集状态,或称三种相。
这里所谓的气体是指在其工作的参数范围内总是呈现为气态的工质。
例如空气、气体燃料、燃气(燃料燃烧生成的气体),以及组成它们的单元气体氮、氢、氧、二氧化碳等等。
本节主要讲述理想气体性质。
理想气体性质是指当压力减小到趋于零时,气体热力性质趋近的极限情况。
这时,表达气体热力性质的各状态函数有最简单的形式。
在压力很低时,气体的比体积大而内部分子自身占有的体积相对极小;分子间的平均距离大,使分子间的相互作用力很小,以致可以忽略分子自身占有的体积和分子间的相互作用力对气体宏观热力性质的影响。
因此,常将分子自身不占有体积和分子之间无相互作用力作为理想气体的微观模型。

气体热力学性质第一节理想气体的性质一、理想气体:1、假设:①气体分子是弹性的、不占据体积的特点;②气体分子间没有相互作用力。
对于气体分子的体积相对气体比容很小,分子间作用力相对于气体压力也很小时,可作为理想气体处理。
2、状态方程理想气体在任一平衡状态时的压力P、温度T、比容v之间的关系应满足状态方程,即克拉佩龙方程Pv=RTmkg质量气体为:Pv=mRT=mR0TR气体常数,反映气体特征的物理量,和气体所处状态无关;n物质的量(千克数或摩尔数);R0通用气体常数,与气体状态、其他性质无关的普适恒量;R0R831415J/KmolKCV,CP分别表示定压比容及定容比容,对于理想气体,他们仅是温度的单值函数,CVCP其CVCPR比值CV/CPk(绝热指数)标准状态时(压力未101.325Kpa,0℃)单原子气体k=1.661.67双原子气体k=1.401.41多原子气体k=1.101.3此外RkkCV/CP1,CV,CPRR1k1二、过程方程及过程功气体在压缩和膨胀过程中,状态的变化应符合动量守恒及转换定律,即内能、外功、热交换三者间应满足dqdUdW,其中dUCVdT,dWPdV压缩过程中的能量关系1、等温过程数字式:Tcont即dT0过程方程式:PVcont过程功:WRTlnV2VPP1V1ln2P1V1ln1V1V1P2内能变化:U2U10热交换:qw等温过程的热交换q和过程功w值相等,且正负号相同,即气体加热进行等温膨胀时,加入的热量全部用于对外膨胀做功,气体被压缩时外界对气体所作的功全部转换为热量的形式排出。
2、绝热过程数字式:q0,dq0过程方程式:PVKcontk1kP2R过程功:WT1[1PR11内能变化:U2U1WV1R]T1[1Vk12K1]功质在绝热过程中与外界没有热量交换,过程功只能来自工质本身的能量,绝热膨胀机等于内能降,绝热压缩时,工质消耗的压缩功等于内能的增加量。
3、多变过程状态变化过程中,状态参数都由显著的变化,存在热交换时他们的过程特征满足过程方程过程功:WP2RT1[1n1P1n1n]k1CV(T1T2)n1内能变化:UCV(T2T1)热量交换:qUW压缩机级的工作工程nkCV(T1T2)n1多变等温绝热在等温与绝热之间的均是多变过程;在等温与绝热之外的均是多变过程;第二节级的理论循环1)压缩机的级:指压缩机中进行连续压缩的单位;2)循环:压缩机曲轴旋转一周,在气缸容积中所进行的各个过程的总和;3)级的理论循环不是指在以下假设条加下的循环:①气缸没有余隙容积,被压缩的气体能全部排出气缸;②进、排气系统没有阻力,阀室容积无限大,并且是绝热的,因此,进排气过程没有压力损失,没有压力脉动,没有热交换(注:没有热交换温度不变化);③气缸压缩容积绝对严密,没有气体泄露;④气体压缩过程中不论由无热交换,其过程指数未定植。
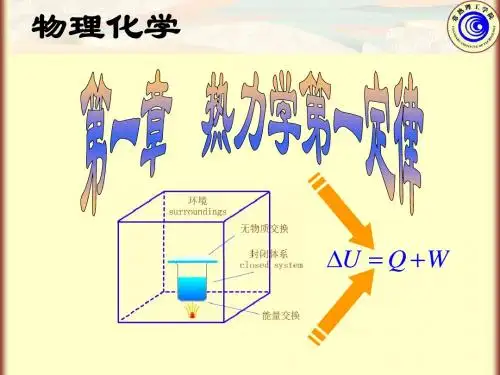



理想气体的热力学热力学是研究能量转化和相互转化的一门科学。
理想气体是热力学中的经典模型之一,它假设气体分子间没有相互作用力,体积可忽略不计。
本文将展开对理想气体的热力学性质进行探讨。
一、理想气体的状态方程热力学中描述气体性质的重要方程即状态方程。
理想气体的状态方程可由玻意尔定律推导而来,即PV=nRT,其中P为气体的压强,V为气体的体积,n为气体的物质量,R为气体常数,T为气体的温度。
根据状态方程,可以得到理想气体的其他性质。
二、理想气体的内能理想气体的内能只与温度有关,与体积和压强无关。
内能的变化可以通过热量和做功来表达,即ΔU=Q-W,其中ΔU为内能的变化量,Q为系统所吸收或放出的热量,W为系统所做的功。
对于理想气体,由于没有相互作用力,因此没有势能的变化,内能的变化只与温度有关。
三、理想气体的熵熵是描述系统无序程度的物理量,也可理解为系统的混乱程度。
对于理想气体,熵的变化可以用熵的增加量ΔS=Q/T来表示,其中Q为系统吸收或放出的热量,T为系统的温度。
熵增加表示系统趋于无序,熵减少则表示系统趋于有序。
四、理想气体的特性函数特性函数是研究系统性质的重要工具,对于理想气体,常用的特性函数有焓、自由能和吉布斯函数。
焓H定义为H=U+PV,表示在恒压过程中系统所吸收或放出的热量;自由能F定义为F=U-TS,表示系统可以利用的最大能量;吉布斯函数G定义为G=H-TS,表示系统的有效能。
五、理想气体的热力学过程热力学过程指系统从一个平衡态到另一个平衡态的过程,常见的热力学过程有等温过程、等容过程、等压过程和绝热过程。
对于理想气体,这些过程有着特定的特征和方程。
例如,在等温过程中,理想气体的状态方程可表示为PV=常数。
六、理想气体的理想等气体与实际气体的差异理想气体假设了气体分子间无相互作用力,而实际气体分子间会存在一定的相互作用。
因此,在高压和低温条件下,理想气体的状态方程与实际气体的表现会有一定的出入。


热力学系统的理想气体与实际气体热力学是研究能量转换和能量传递的学科,而热力学系统是指能够与外界发生能量交换的物体或介质。
在热力学的研究中,我们常常涉及到两种类型的气体:理想气体和实际气体。
本文将探讨理想气体与实际气体之间的差异及其在热力学系统中的应用。
一、理想气体的定义与性质1. 理想气体的定义理想气体是在一定的温度和压力下,具有如下特性:分子之间无相互作用力,分子体积可忽略不计,分子运动符合玻尔兹曼分布定律。
2. 理想气体的性质(1)温度与压力的关系:理想气体的温度与压力成正比,即PV = nRT,其中P为气体的压力,V为气体的体积,n为气体的物质量,R 为气体常数,T为气体的绝对温度。
(2)摩尔体积:理想气体的摩尔体积与温度和压力成反比,即V/n = RT/P。
(3)理想气体的状态方程:理想气体的状态方程可以用来描述气体的状态,即PV = nRT。
(4)理想气体的内能和焓:理想气体的内能只与温度有关,与压力和体积无关;焓是气体的内能与气体对外界做的功之和。
二、实际气体的行为与修正尽管理想气体模型在很多情况下可以提供准确的结果,但在高压、低温等条件下,实际气体的行为与理想气体有很大差异。
实际气体的行为可以通过以下修正来描述。
1. Van der Waals修正Van der Waals修正是一种修正理想气体行为的经验模型。
Van der Waals方程为(P + an²/V²)(V - nb) = nRT,其中a和b分别为Van der Waals方程的修正常数。
这个方程能够更好地描述实际气体的状态。
2. Peng-Robinson修正Peng-Robinson修正是Van der Waals方程的改进版。
Peng-Robinson 方程为P = (RT)/(V - b) - (aα)/(V (V + b)),其中a和b的表示方式与Van der Waals方程略有不同,α是一个校正因子。
理想气体的热力学性质理想气体是一种理论模型,它假设气体分子为无相互作用的点状粒子,并且在有限的温度和压力条件下满足适用于大量分子的统计规律。
在热力学中,理想气体的热力学性质是研究理想气体在不同温度、压力和体积条件下的行为和性质。
本文将从理想气体的状态方程、内能、焓、熵以及热容等方面来讨论理想气体的热力学性质。
一、理想气体的状态方程理想气体的状态方程描述了气体的状态与温度、压力和体积之间的关系。
根据理想气体状态方程可以得到以下形式:PV = nRT其中,P是气体的压力,V是气体的体积,n是气体的摩尔数,R是气体常数,T是气体的温度。
在这个方程中,R是一个常数,与气体的性质相关。
二、理想气体的内能理想气体的内能是指气体分子的平均动能和势能的总和。
由于理想气体的分子间相互作用力很小或者为零,因此它的内能仅与温度有关。
根据理想气体的内能公式可以得到:U = (3/2)nRT其中,U是内能,n是气体的摩尔数,R是气体常数,T是气体的温度。
这个公式表明,理想气体的内能与温度成正比,且与气体的体积和压力无关。
三、理想气体的焓理想气体的焓是指气体的内能与压力的乘积。
在常温常压条件下,理想气体的焓变化可以近似为:ΔH = ΔU + Δ(PV) ≈ ΔU对于理想气体,内能变化主要由温度变化引起,而体积和压力的变化对焓的贡献可以忽略不计。
四、理想气体的熵理想气体的熵是指气体在热平衡和不可逆过程中的熵变。
根据热力学第二定律,理想气体的熵变可以表示为:ΔS = nCvln(T₂/T₁) + nRln(V₂/V₁)其中,ΔS是气体的熵变,n是气体的摩尔数,Cv是气体的摩尔热容,R是气体常数,T₁和T₂分别是气体的初温和末温,V₁和V₂分别是气体的初体积和末体积。
这个公式表明,理想气体的熵变与温度和体积的变化有关。
五、理想气体的热容理想气体的热容是指单位摩尔气体在温度变化时吸收或者释放的热量。
根据理想气体的热容定义可以得到以下公式:Cv = (3/2)RCp = (5/2)R其中,Cv是等体热容,Cp是等压热容。