RIP实验技术
- 格式:docx
- 大小:14.46 KB
- 文档页数:4

实验六:RIP协议一、理论基础1、RIP简介RIP是Routing Information Protocol(路由信息协议)的简称。
它是一种相对简单的动态路由协议,在实践中被广泛的应用。
RIP是基于距离向量路由算法。
这种算法提供了互联网与运行RIP的路由器的有限拓扑网络视图。
在相邻的路由器之间进行广播,以(几乎)完全路由表的形式作周期性的更新。
它通过UDP(User Datagram Protocol)报文交换路由信息,使用跳数(Hop Count)来衡量到达目的地的距离(被称为路由权-Routing cost)。
RIP允许的最大跳数为15,任何大于15的目标地址节点都将视为不可访问的。
RIP最大节点数在大型网络中很大程度上限制它的使用,但是却防止了无限计数问题,从而避免了引起无止境的网络路由环路。
所以RIP一般用于采用同类技术的中等规模的网络,如校园网及一个地区范围内的网络,RIP并非为复杂、大型的网络而设计。
运行RIP协议的路由器间以30秒为间隔周期性的交换路由表信息。
在一个RIP广播信息中,包含了每个IP网络中RIP信息能到达的网络以及此网络的距离(以跳计数)的列表对。
在RIP中,路由器定义为到直接链路网络为一跳,到另一个路由器可达的网络为两跳,如此继续下去。
为提高性能,防止产生路由环,RIP支持水平分割(Split Horizon)、毒性逆转(Poison Reverse),并采用触发更新(Triggered Update)。
RIP的缺点:因为跳数的最大值是15,所以不适合于大型网络。
因为仅依据Hop Count(跳数)作为路由选择的度量标准,所以会选择距离最近的路径,不一定会选择最快的路径。
因为每30秒更新路由信息,所以产生大量的广播,消耗带宽资源。
RIP启动和运行的整个过程可描述如下:(1)某路由器刚启动RIP时,以广播形式向其相邻路由器发送请求报文,相邻路由器收到请求报文后,响应该请求,并回送包含本地路由信息的响应报文。

rip实验原理RIP实验原理。
RIP实验(rest in peace实验)是一种用于研究DNA裂解和细胞凋亡的实验方法。
DNA裂解和细胞凋亡是细胞死亡的两种主要方式,而RIP实验可以帮助科研人员了解这些过程的机制,从而为疾病的治疗提供重要的理论基础。
RIP实验的原理基于DNA的特性和细胞凋亡的过程。
在细胞凋亡的过程中,DNA会出现特征性的裂解,形成一系列特定大小的DNA片段。
这些片段可以通过RIP实验来检测和分析,从而揭示细胞凋亡的发生和发展过程。
RIP实验的步骤包括DNA提取、DNA裂解、DNA片段分析等。
首先,需要从待测细胞中提取DNA样品,然后通过特定的方法进行DNA裂解,使得DNA分子在特定的条件下发生裂解,形成不同大小的DNA片段。
接下来,可以利用凝胶电泳或PCR等技术对DNA片段进行分析,从而得到细胞凋亡的相关信息。
RIP实验的关键是选择合适的DNA裂解方法和分析技术。
常用的DNA裂解方法包括酶切、碱性条件、热处理等,而DNA片段的分析则可以通过凝胶电泳、PCR、DNA测序等方法来进行。
选择合适的方法可以提高实验的准确性和可靠性,从而得到更可靠的结果。
RIP实验在生物医学研究中具有重要的应用。
通过对细胞凋亡的研究,科研人员可以揭示疾病的发生机制,寻找新的治疗靶点,并评估药物的疗效。
此外,RIP实验还可以用于毒性测试、环境监测等领域,具有广泛的应用前景。
总之,RIP实验是一种重要的研究方法,可以帮助科研人员深入了解DNA裂解和细胞凋亡的机制。
通过选择合适的实验方法和分析技术,可以得到准确可靠的实验结果,为疾病的治疗和预防提供重要的理论基础。
希望本文对RIP实验的原理有所帮助,谢谢阅读。

RIPRIP技术(RNA Binding Protein Immunoprecipitation,RNA结合蛋白免疫沉淀),是研究细胞内RNA与蛋白结合情况的技术,是了解转录后调控网络动态过程的有力工具,能帮助我们发现miRNA的调节靶点。
RIP这种新兴的技术运用针对目标蛋白的抗体把相应的RNA-蛋白复合物沉淀下来,然后经过分离纯化就可以对结合在复合物上的RNA进行分析。
RIP可以看成是普遍使用的染色质免疫沉淀ChIP 技术的类似应用,但由于研究对象是RNA-蛋白复合物而不是DNA-蛋白复合物,RIP实验的优化条件与ChIP实验不太相同(如复合物不需要固定,RIP反应体系中的试剂和抗体绝对不能含有RNA酶,抗体需经RIP实验验证等等)。
RIP技术下游结合microarray技术被称为RIP-Chip,帮助我们更高通量地了解癌症以及其它疾病整体水平的RNA变化。
RIP 实验基本原理:1. 用抗体或表位标记物捕获细胞核内或细胞质中内源性的RNA结合蛋白。
2. 防止非特异性的RNA的结合。
3. 免疫沉淀把RNA结合蛋白及其结合的RNA一起分离出来。
4.结合的RNA序列通过microarray(RIP-Chip),定量RT-PCR或高通量测序(RIP-Seq)方法来鉴定。
延伸阅读:95%的人类基因组并不编码基因,而是产生大量的非编码RNA,真正编码蛋白质的基因只占人类总基因组的约2%。
这些非编码RNA在生命的生长发育的各个阶段都发挥着重要的调节作用,与艾滋病、白血病、糖尿病、畸形等多种病变密切相关,并且参与着干细胞和表观遗传学调控。
而RNA-蛋白复合物驱动了几乎所有细胞过程的基因表达的转录后调控,包括剪接(splicing)、出核转运(nuclear export)、mRNA 稳定性以及蛋白转译过程,因此,对基因调控的了解就有赖于确定这些过程中RNA的结合的变化。
因此,RNA研究也被越来越多的科学家重视起来,目前已经成为生命科学研究中一个炙手可热的领域,而RIP 技术也逐渐成为RNA研究领域的一项常规方法,帮助我们了解越来越受关注的转录后调控网络。
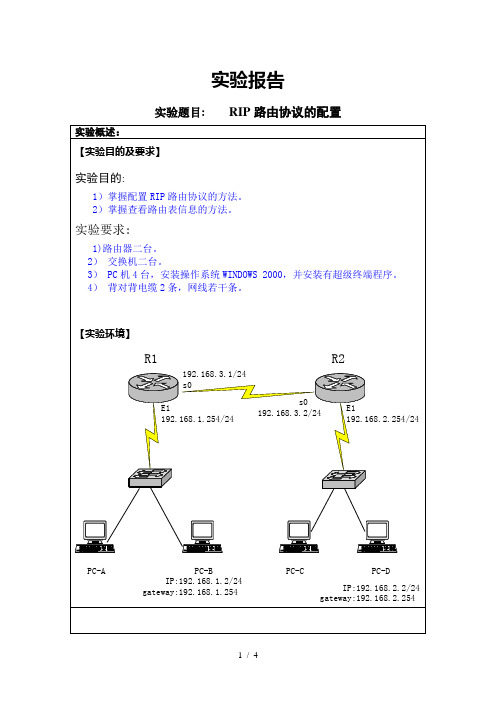

实验二、路由协议实验(RIP,OSPF)
一.实验目的
常见的路由协议有静态RIP,OSPF等,静态路由一般用于较小的网络环境,RIP一般用于不超过15台路由器的环境,OSPF常用于大型的网络环境,是目前主流的网络路由协议之一。
二.实验内容和要求
1.如何配置路由器,并掌握基本的命令
2.学习常见的网络路由协议配置方法
三.实验主要仪器设备和材料
AR28路由器、AR18路由器,一台PC机。
四.实验结果截图
组别为13组,我们作为分组1
(1)RIP实验
1.AR28-1路由表
3.可以PING 通
(2)OSPF实验
1.AR28-1路由表
2.可以PING 通
五、RIP,OSPF的工作原理
RIP是距离矢量路由协议,它通过交换明确的路由来达到全网互通,即是说他所获得的路由都是通过邻居发送过来的。
类似于问路的时候沿路打听。
OSPF是链路状态路由协议,他不发送路由信息。
而是通过发送链路状态LSA来独自计算路由条目。
类似GPS发送给对方方位后具体怎么走是本地系统计算出来的。
六、思考题
1、答:可以同时配置。
OSPF的优先级较高,所以OSPF协议生效。
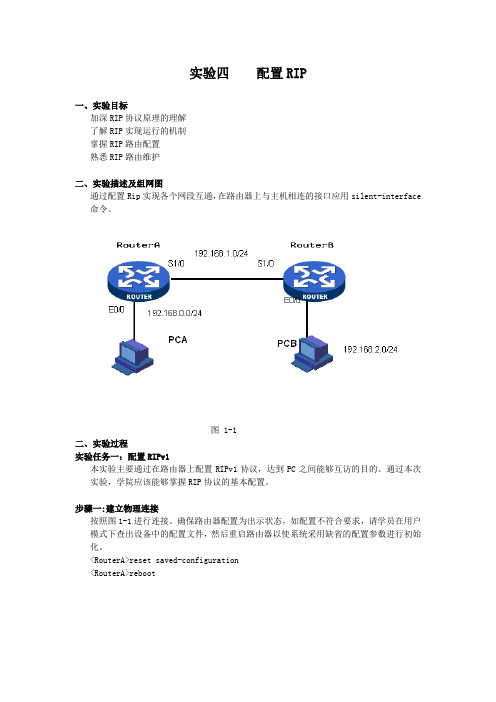
实验四配置RIP一、实验目标加深RIP协议原理的理解了解RIP实现运行的机制掌握RIP路由配置熟悉RIP路由维护二、实验描述及组网图通过配置Rip实现各个网段互通,在路由器上与主机相连的接口应用silent-interface 命令。
图 1-1二、实验过程实验任务一:配置RIPv1本实验主要通过在路由器上配置RIPv1协议,达到PC之间能够互访的目的。
通过本次实验,学院应该能够掌握RIP协议的基本配置。
步骤一:建立物理连接按照图1-1进行连接。
确保路由器配置为出示状态,如配置不符合要求,请学员在用户模式下查出设备中的配置文件,然后重启路由器以使系统采用缺省的配置参数进行初始化。
<RouterA>reset saved-configuration<RouterA>reboot步骤二:在PC和路由器上配置IP地址表1-1 IP地址列表按表1-1所示在路由器接口上配置IP地址。
测试PC到网关的可达性,以RouterA为例C:\Documents and Settings\Administrator>ping 192.168.0.1Pinging 192.168.0.1 with 32 bytes of data:Reply from 192.168.0.1: bytes=32 time<1ms TTL=255Reply from 192.168.0.1: bytes=32 time<1ms TTL=255Reply from 192.168.0.1: bytes=32 time<1ms TTL=255Reply from 192.168.0.1: bytes=32 time<1ms TTL=255Ping statistics for 192.168.0.1:Packets: Sent = 4, Received = 4, Lost = 0 (0% loss),Approximate round trip times in milli-seconds:Minimum = 0ms, Maximum = 0ms, Average = 0ms再测试PC之间的可达性。
rip技术实验原理与实验步骤
RIP技术,即RNA免疫沉淀技术,是一种用于研究RNA与蛋白
质相互作用的实验方法。
其原理是利用抗体特异性结合RNA结合蛋白,然后通过免疫沉淀的方式将RNA结合蛋白从混合物中分离出来,从而研究它们之间的相互作用。
实验步骤大致包括以下几个方面:
1. 细胞裂解,首先需要将待研究的细胞裂解,释放出细胞内的RNA结合蛋白。
2. 抗体结合,将特异性抗体加入到细胞裂解液中,使其与目标RNA结合蛋白结合。
3. 免疫沉淀,通过加入沉淀剂,如蛋白A/G琼脂糖或磁珠,将
抗体-蛋白RNA 复合物沉淀下来。
4. 洗涤,对沉淀的复合物进行洗涤,去除非特异性结合的蛋白
质和RNA。
5. 释放,通过加入去离子水或特定缓冲液,将目标 RNA 结合蛋白从抗体上释放出来。
6. 分析,最后对释放出的 RNA 结合蛋白进行分析,可以使用PCR、Western blot或质谱等技术进行进一步的研究。
这些步骤是基本的RIP技术实验步骤,当然在具体实验中还会根据研究的具体对象和目的进行一些调整和优化。
广州辉骏生物科技有限公司
RIP
一、技术概述
RIP是研究体内蛋白与RNA互作的重要技术。
该技术先用甲醛等试剂交联细胞内的“蛋白-RNA”互作复合物,裂解细胞后,用靶蛋白特异的抗体(或标签抗体)做免疫沉淀,获得“靶蛋白-RNA”互作复合物,去交联分离其中的RNA;针对预测的靶蛋白结合RNA的序列设计引物,做qPCR实验,验证预测的RNA是否与靶蛋白有结合;或者将分离出来的RNA做高通量测序,筛选到可能与靶蛋白结合的RNA。
二、技术应用
RIP可以看成是普遍使用的染色质免疫沉淀ChIP技术的类似应用,但由于研究对象是RNA-蛋白复合物而不是DNA-蛋白复合物。
95%的人类基因组并不编码基因,而是产生大量的非编码RNA,真正编码蛋白质的基因只占人类总基因组的约2%。
这些非编码RNA在生命的生长发育的各个阶段都发挥着重要的调节作用,与艾滋病、白血病、糖尿病、畸形等多种病变密切相关,并且参与着干细胞和表观遗传学调控。
而RNA-蛋白复合物驱动了几乎所有细胞过程的基因表达的转录后调控,包括剪接(splicing)、出核转运(nuclear export)、mRNA 稳定性以及蛋白转译过程,因此,对基因调控的了解就有赖于确定这些过程中RNA的结合的变化。
因此,RNA研究也被越来越多的科学家重视起来,目前已经成为生命科学研究中一个炙手可热的领域,而RIP技术也逐渐成为RNA研究领域的一项常规方法,帮助我们了解越来越受关注的转录后调控网络。
三、技术流程
细胞交联→细胞裂解→免疫共沉淀→去交联→RNA分离→建库→高通量测序(或qPCR)。
rip实验原理与实验步骤RIP(Routing Information Protocol)是一种基于距离向量算法的路由协议,它通过交换路由信息来更新网络的路由表。
本实验将介绍RIP协议的原理和实验步骤。
1. 实验原理RIP协议采用距离向量算法,每个路由器通过向相邻路由器发送自己的路由表来获取网络拓扑信息。
路由器收到路由表后,更新自己的路由表,并将更新后的路由表发送给相邻路由器。
通过不断地交换路由信息,整个网络构建一个路由信息表,路由器就可以根据该表选择最优路径进行数据传输。
RIP协议使用了Hop Count(跳数)作为度量单位,即每个数据包经过的路由器数。
默认情况下,RIP协议的最大跳数限制是15,超过这个跳数的数据包将会被丢弃。
RIP协议还具有自适应能力,如果某个路由器网络的拓扑结构发生了改变,RIP协议将会相应地调整路由表。
2. 实验步骤步骤一:准备实验环境为了进行实验,需要组建一个网络实验环境。
可以通过模拟器或者真实的设备来实现。
在实验环境搭建完成后需要确认网络连接正确,并确保所有路由器和主机设备能够相互通信。
步骤二:启用RIP协议在每个路由器上启用RIP协议,设置相应的参数。
启用RIP协议后,路由器将会开始收集并更新路由信息表。
步骤三:测试路由为了测试RIP协议的工作效果,需要利用ping命令或者traceroute命令来测试路由。
在测试过程中要尽量模拟实际网络环境,进行多次测试并记录测试结果,可以根据测试结果来调整路由器的设置和参数。
步骤四:观察路由信息表在测试过程中需要不断地观察路由信息表,确保路由器的路由信息表与实际网络拓扑相符。
如果出现不符合的情况,需要及时进行调整和更新。
步骤五:调整RIP协议参数在测试中,可能需要调整RIP协议的参数,比如更新频率、路由收敛时间等,来改善网络的质量。
同时也需要关注资源消耗,保证网络的高效性和可靠性。
通过以上实验步骤,可以深入了解RIP协议的工作原理,并且对网络拓扑结构进行更加细致的优化和管理。
rip实验原理随着科学研究的不断发展,RIP(Reaper in Petri)实验也逐渐得到普遍的认可和应用。
RIP实验是一种用来评估实验品中活性成分的受试者实验,它将实验品中活性成分逐步浓缩,表征和提取出来,为我们在研究中更好地分析实验品中活性成分提供了一种简单和便捷的方法。
RIP实验的原理和过程如下:1、准备受试者,用于评估实验品的活性成分。
所使用的受试者材料通常是植物或活性物质。
2、混合和调整实验品,确定最佳浓度。
如果需要,可以混合多种植物或活性物质,以获得最佳浓度。
3、运用Petri实验盘,安放受试者,测试实验物质的活性成分。
运用Petri实验盘,将实验物质涂抹到受试者上,实验用以测量实验物质中活性成分得强度,并判断实验物质的活性成分的稳定性。
4、实施测试,分析受试者的反应,找出实验物质中的活性成分。
实验开始之后,将受试者放入密封容器中,并定期检查受试者的反应,以确定实验物质中的活性成分。
5、收集结果,表达受试者的反应。
收集实验结果,用统计学方法表达受试者的反应,如发育偏差、生长强度及受试者的死亡率等。
6、比较实验结果,得出结论。
通过对实验结果的比较,就可以得出实验物质中活性成分的性质、含量、及其作用机理等结论。
RIP实验是一种重要的实验研究方法,它可以用于评估植物或活性物质中活性成分的性质、含量及作用机理,是一种有效的安全评估手段,可以帮助我们更好的利用和开发实验物质的活性成分。
RIP实验是基于细胞生物学,水文学,分子生物学等科学,它涉及到放射性、细胞毒性、药代动力学和免疫学等方面,在现代实验研究中扮演着不可替代的作用。
RIP实验的过程虽然复杂,但如果按照步骤进行,也是可以得到较为准确的实验结果的。
RIP实验可以用于评估实验物质中活性成分的性质、及其作用机理,提供了一种高效、可靠的实验研究方法,可以有效利用实验品的活性成分,为科研工作者提供便利。
【实验技巧】RIP实验技术RIP实验技术近年来,长非编码RNA(lncRNA)得到了研究界的广泛关注。
如今,人们已经鉴定了大量lncRNA,但大多数lncRNA的功能还未明确。
为了解决这一问题,研究者们开始对lncRNA的互作蛋白进行研究,并为此开发出了越来越多的分析工具。
下面我们来介绍一下RIP技术。
RNA结合蛋白免疫沉淀技术又称为RIP(RNA immunoprecipitation),可以说是RNA版的ChIP(染色质免疫沉淀),该技术能帮助人们分析与RNA结合蛋白相关的核酸。
在RIP试剂盒(如Sigma的Imprint? RNA Immunoprecipitation kit)的帮助下,研究者们能够利用针对RNA 结合蛋白的抗体,从细胞提取物中捕获与蛋白相结合的RNA,再通过qPCR、芯片或二代测序技术对这些RNA进行鉴定。
不论是细胞质还是细胞核,都会发生RNA与蛋白的相互作用。
据Active Motif公司产品经理Kyle Hondorp介绍,该公司的RNA ChIP-IT? kit专用于研究RNA与细胞核染色质的相互作用。
该试剂盒通过甲醛固定来锁定RNA-染色质的互作,随后对染色质进行超声,并用DNAse I处理,最后利用磁珠进行沉淀。
“如你研究的是总mRNA,那么常规RIP试剂盒更合适一些,”Hondorp说,“常规RIP试剂盒可以处理所有细胞裂解物的总mRNA。
”生产Magna RIP? RNA-binding protein immunoprecipitation kit的EMD Millipore公司,也在开发专门针对染色质的RIP试剂盒。
预计这一新产品将于2014年第一季度发布,该产品有化学交联与native两种形式。
据介绍,化学交联可以分析究间接的蛋白-RNA相互作用,研究更高分子量的蛋白复合物。
而native方法展现的是,亲和力更高也更为直接的相互作用。
除RIP以外,CLIP(UV crosslinking and immunoprecipitation)也可以帮助人们捕捉与RNA结合蛋白互作的核酸。
CLIP方案整合了交联与核酸酶消化,不仅允许对RNA-蛋白复合物进行进一步的纯化(如凝胶电泳片段分离),还能够揭示RNA-蛋白互作所发生的位点。
最近人们又开发出了新型CLIP 技术——iCLIP (individual-nucleotide resolution CLIP),该技术能够以单个碱基的分辨率,来展示RNA-蛋白互作的详细信息。
据伦敦大学学院的Jernej Ule教授介绍,CLIP与RIP的关键性差异,在于沉淀复合物后的凝胶纯化步骤。
CLIP技术可以给RNA-蛋白复合物的RNA末端带上放射性标记,并将这些复合物进行SDS-PAGE分离,之后转移到一张膜上。
这样的过程可以提高纯化的特异性,减少非特异性的RNA。
蛋白酶消化可以将RNA从膜上解离下来,用于制备cDNA文库,以备测序分析。
“CLIP要比RIP麻烦一些,不过我认为它很值得采用,”Ule说。
“放射性信号的量及其特异性,能够帮助我们提高cDNA文库的质量,最终得到准确实用的数据。
”一. 细胞裂解液获取A. 单层细胞或者贴壁细胞处理1. 冷PBS清洗培养皿或培养瓶中的细胞两次2. 加入冷PBS后用细胞刮将细胞刮下来,收集至enpendoff管3. 1500rpm,4℃离心5min,弃上清,收集细胞4. 用与细胞等体积的RIP裂解液重悬细胞,吹打均匀后于冰上静置5min5. 每管分装200μl细胞裂解液,贮存于-80℃B. 悬浮细胞处理:先收集细胞再计数,然后清洗裂解C. 组织样品处理1.冷PBS清洗新鲜切下的组织三次2. 加入冷PBS后,用匀浆器或其他细胞分离设备使组织分散为单个细胞,计数3. 1500rpm,4℃离心5min,弃上清,收集细胞4. 用与细胞等体积的RIP裂解液重悬细胞,吹打均匀后置于冰上静置5min5. 每管分装200μl细胞裂解液,贮存于-80℃二. 磁珠的准备A. 实验前准备1、enpendoff管2、磁力架3、冰盒,RIP Wash Buffer置于冰上4、抗体,置于冰上5、涡旋震荡器6、枪、枪头放于超净台照射30min,枪喷DEPC水B. 磁珠准备过程1. 重悬磁珠2. 标记实验所需的enpendoff管,样品包括目的样品,阴性对照与阳性对照3. 吸取50μl 重悬后的磁珠悬液于每个enpendoff管4. 每管加入500μl RIP Wash Buffer,涡旋震荡5. 将enpendoff管置于磁力架上,并左右转动15°使磁珠吸附成一条直线,去上清,重复一次6. 用100μl的RIP Wash Buffer重悬磁珠,加入约5ug相应抗体于每个样品中7. 室温孵育30min8. 将enpendoff管置于磁力架上,弃上清9. 加入500μl RIP Wash Buffer,涡旋震荡后弃上清,重复一次10. 加入500μl RIP Wash Buffer,涡旋震荡后置于冰上三. RNA结合蛋白免疫沉淀A. 准备工作1、冰盒2、360°旋转仪3、RIP Wash Buffer 、0.5M EDTA 、RNase Inhibitor 置于冰上B. RNA结合蛋白免疫沉淀实验过程1. 准备RIP Immunoprecipitation Buffer2. 将前上步的enpendoff管放磁力架上,去上清,每管加入900ul RIP Immunoprecipitation Buffer3. 迅速解冻第一步制备的细胞裂解液,14,000rpm,4℃离心10min。
吸取100μl上清液于上一步的磁珠-抗体复合物中,使得总体积为1ml4. 4℃孵育3h至过夜5. 短暂离心,将enpendoff管放在磁力架上,弃上清6. 加入500μl RIP Wash Buffer,涡旋震荡后将enpendoff管放在磁力架上,弃上清,重复清洗6次四、RNA纯化A. 实验前准备1. 枪、枪头、enpendoff管紫外照射30min,喷DEPC水以除RNA酶2. Salt SolutionⅠ、Salt SolutionⅡ、RIP Wash Buffer、Proteinase K、10%SDS、Precipitate Enhancer 置于冰上3.RNase-free的乙醇、氯仿、异戊醇4.DEPC水置于冰上5. 离心机预冷6. 冰盒B. RNA纯化过程1.准备Proteinase K Buffer。
每个样品需150ul2.用150ul Proteinase K Buffer重悬上述磁珠-抗体复合物3. 55℃孵育30min4. 孵育完之后,将enpendoff管置于磁力架上,将上清液吸入一新的enpendoff管中5. 于每管上清液中加入250μlRIP Wash Buffer6. 于每管加入400μl苯酚:氯仿:异戊醇,涡旋震荡15s,室温下14,000rpm离心10min7. 小心的吸取350μl上层水相,吸入另一新的enpendoff管8. 于每管加入400μl氯仿,涡旋震荡15s,室温下14,000rpm离心10min9. 小心的吸取300μl上层水相,吸入另一新的enpendoff管10. 每管加入50μl Salt SolutionⅠ,15μl Salt SolutionⅡ,5μl Precipitate Enhancer ,850μl 无水乙醇(无RNase),混合,-80℃保持1h至过夜11. 14,000rpm,4℃离心30min,小心去上清12. 用80%乙醇冲洗一次,14,000rpm,4℃离心15min,小心去上清,空气中晾干.13. 10-20μl DEPC水溶解,-80℃保存,送测序1:RIP试验需要注意什么?(1)防止RNA与蛋白非特异性结合。
(2)避免RNA蛋白质结合被破坏。
(3)避免外源RNAse污染。
(4)抑制内源RNase的活性。
(5)选择适合做RIP的抗体。
(6)避免RNA结合蛋白的降解。
2:为什么抗体无法沉淀RIP裂解液中的目标蛋白?(1)先进行IP或者WB,测试抗体可以与目标RBP结合。
(2)另选一个能与抗原其他表位结合的抗体。
(3)尽可能选用密理博RIPAb+抗体。
(4)稀释抗体成浓度梯度,进行IP测试。
(5)4℃过夜孵育抗体与RIP裂解液。
(6)确定抗体类型与Protein A/Protein G匹配。
3:提取RNA时,蛋白酶k消化不完全是什么原因?当进行蛋白酶K消化时,确保水浴温度应设置在55℃左右,长期在65℃以上孵育会导致蛋白酶K失活。
4:提取RNA后,A260/A280比值偏离1.8~2.2区域是什么原因?(1)需要缩短酚氯仿提取RNA的时间间隔。
(2)测试提纯后RNA中是否存在RNA酶,可能RNA发生了降解。
5:做RIP的时候和beads孵育的lysate的浓度如何确定?有些动物的文献提到用细胞板数细胞个数,想知道如果用蛋白浓度的话,大概在什么数量范围的蛋白总量对应50 ul BEADS?50 ul beads对应的是一个reaction,而我们推荐一个reaction是100ul裂解上清(2×107 cells加入100ul RIP lysis buffer得到),所以只需要在裂解前计数一下,并按括号中的比例加入裂解buffer,后续100 ul 裂解上清就是一个reaction的蛋白用量。
不建议通过裂解后测蛋白浓度的方法进行配比。
6:RIP可以分提核浆的RNA-蛋白质复合物吗?理论上,可以采用能分别抽提核浆蛋白的蛋白抽提kit先分离样本,再进行RIP实验。
但需要特别注意的是所用kit中的reagent不能有RNase和DNase,以及要能与下游的抗体beads孵育兼容。
7:因为RIP做完得到的是RNA序列,要做后续检测,比如测序、判断目标序列位置等,是不是都必须要做RT-PCR,得到逆转录的DNA后,后面就跟ChIP相同了?常见的用real time qRT-PCR。
如果对照的目的是保证两个样品间加入的细胞量一致或者进行定量,理论上说,使用input作为判别,计算不同样品上样量的差异。
如果对照的目的是为了看IgG以及目的抗体富集的非特异性mRNA的量的话,那么可以找一个确定不会与目的抗体结合的RNA片段设计primer进行qPCR,用来看IgG以及目的抗体拉下来的背景情况。
RIP可以看成是普遍使用的染色质免疫沉淀ChIP技术的类似应用,但由于研究对象是RNA-蛋白复合物而不是DNA-蛋白复合物,RIP实验的优化条件与ChIP实验不太相同(如复合物不需要固定,RIP反应体系中的试剂和抗体绝对不能含有RNA酶,抗体需经RIP实验验证等等)。