钠的转化关系图
- 格式:docx
- 大小:62.49 KB
- 文档页数:1


天才在于勤奋,聪明在于积累。
班级姓名小组专题复习之各类物质之间的相互转化关系〖复习目标〗:掌握一个知识网络、理解两种反应条件、了解四种离子检验、熟记忆六种物质性质。
1.酸、碱、盐、氧化物之间相互转化关系网络图2.理解两种反应条件复分解反应发生的条件:(1)从定以上分析:复分解反应是两种化合物相互交换成份生成另外两种化合物的反应。
判断一个反应是否是复分解反应不能仅仅依据反应物和生成物的种类来判断,还必须看反应的实质。
如:2NaOH + CO2=Na2CO3+H2O就不属于复分解反应,因为两种反应物没有相互交换成份。
再如:CaCO3+2HCl=CaCl2+H2O+CO2↑,从形式上来看,虽然该反应的产物有三种化合物生成,但却属于复分解反应,该反应的实质是:CaCO3+2HCl=CaCl2+H2CO3,H2CO3不稳定分解为H 2O和CO2,因此该却反应属于复分解反应。
(2)复分解反应发生的条件是:①对于反应物来说:盐与碱、盐与盐反应时,两种反应物必须全部溶于水。
②对于生成物来说要么有水生成,要么有沉淀生成,要么有气体生成。
金属与盐溶液发生置换反应的条件:金属与盐溶液发生置换反应的条件是(1) 金属的位置:只有排在前面的金属才能把后面的金属从其盐溶液中置换出来;(2) 特殊性:由于钾、钙、钠的化学性质非常活泼,在盐溶液中它们会首先与水反应生成相应的碱和氢气,因而不会置换出盐中的金属;(3) 盐必须溶于水。
(4) 铁与盐溶液反应时生成+2价的亚铁盐,金属与铁盐反应时,要用+2价的亚铁盐。
酸、碱、盐及氧化物、金属和非金属单质等物质之间的相互转化关系——八圈图记忆口诀:两条纵线通到底(6条规律)四条横线相联系(5条规律)六条交叉成网络(6条规律)17条规律要牢记(横、纵各有1条重复6+5+6=17)规律:天才在于勤奋,聪明在于积累。
班级姓名小组分解反应以上规律的应用:①可知某物质性质②某物质制法(箭尾)(箭头指向)③各类物质间相互关系从上述规律中可以总结出制盐的十种方法,包括:(2)~(16)【典型例题】[例1] 现有石灰石、水、碳酸钠,怎样制取烧碱(不能引入其他物质),写出化学方程式。

一、初中化学物质的转化关系1、氧气、氧化物、酸、氢气、水H2OKMnO4↘↓↑↗CO、CO2↗SO2H2SO4H2O2→→P2O5+ Mg Al Zn Fe→ H2→H2O ↘MgO HClKClO3↗↓↘Al2O3 Fe3O42、碳与碳的化合物3、氢氧化钠、碳酸钠、氯化钠+ CO2↗ Na2SO4 → BaSO4↓(白)NaOH → Na2CO3 → CaCO3↓(白)(变质)↘ NaCl → AgCl↓(白)4、含钙化合物的关系:↙↗―――――――↘↖CaCO3→CaO→Ca(OH)2→CaCl2↖CO2↙5、氧化钡、氢氧化钡与硫酸钡word.word. ↗BaCl 2 → BaSO 4↓(白)BaO → Ba(OH)2 ↗↘ + CuS O 4↘Cu(OH)2↓(蓝)6、硫酸铜、碳酸氢钙、碳酸氢钠、碳酸氢铵CuO ↗ CO 2↙ ↘ Ca(HCO 3)2 → CaCO 3→CaOCuSO 4.5H 2O →CuSO 4→ Cu ↘ H 2O↗Na 2CO 3 ↗ NH 3 → NH 3.H 2ONaHCO 3 →CO 2 NH 4HCO 3 → H 2O↘H 2O → H 2CO 3 ↘ CO 2 → H 2CO 37、铝、镁、锌、铁、铜及其化合物↗ZnSO 4↖ ↗ AlCl 3↖Zn → ZnO Al → Al 2O 3 ↘ZnCl 2↙ ↘Al 2(SO 4)3↙Fe Al↗MgCl 2↖ ↙﹉﹉﹉﹉↗ CuCl 2↘↖Mg → MgO Cu ←→CuO Cu(OH)2 ↘MgSO 4↙ ↖____↘ CuSO 4↗↙Fe Al↙ FeCl 3 ↖ C CO H 2 Mg Al ↗FeSO 4Fe(OH)3 Fe 2O 3 ←――――→ Fe↖Fe 2(SO 4)3↙ O 2 H 2O ↘ FeCl 28、常见物质的相互转化关系(即注明必要的反应物、反应条件)CO 2 CO C 或O 2 O 2 H 2O H 2O 2Al 2O 3 AlCl 3 Al CuO CuSO 4 Cu ⑴ ⑵ ⑶ ⑷ MgO MgSO 4 Mg Cu H 2 Fe CaO Ca(OH)2 CaCO 3 CaCl 2 Ca(OH)2CaCO 3 ⑸ ⑹ ⑺ ⑻word.最新文件---------------- 仅供参考--------------------已改成word 文本 --------------------- 方便更改 CaCO 3 Na 2CO 3 CO 2 CO 2 NaOH Na 2CO 3 CO 2 O 2 H 2O NaOH NH 4ClNH 3 ⑼ ⑽ ⑾ ⑿。

初中化学常见物质转化关系
一.基本素材 (一)一变二
1.
2.
3.
4.
5.
1.
2.
3.
4.
1.置换类
2.还原类
3.氧化类
4.氧化物、酸碱盐类
二.特定素材 (一)直线型互变
1.直线型“两点”互变(含同元素)
(1) (2
) (3)
(4)
(5) (6)
(7)
(8)
2.直线型“三点”互变
(1 (2
(3
(4
三.试题常用框图素材 (一)同元素变化 1.循环类三角形变化
2.指向类三角形变化
3.指向返回类三角型变化
4.循环返回类三角型变化
(二)异元素变化 指向型三角形变化
(三)四边形类变化 1.殊途同归
2. 循环
(四)杂类 1.一变三
2.“二”变“三”
3.二变三
四.六个“核心”变化
O 2、H 2 、H 2O 、CO 2、CO 和Na 2CO 3等六种物质,在中考推断题中是不可缺少的命题“元素”,相关变化列举如下。
(一).二氧化碳的变化
(二).水的变化
(三).氧气的变化
(四).一氧化碳的变化
(五).氢气的变化
(六).碳酸钠的变化。

常见元素及其化合物性质与转化一、典型元素及其化合物的转化关系
1.氯气及其化合物间的转化关系
2.硫及其化合物间的转化关系
3.氮气及其化合物间的转化关系
4.钠及其化合物间的转化关系5.铝及其化合物间的转化关系6.铁及其化合物间的转化关系
、典型非金属单质的化学性质
、典型非金属氧化物性质
四、典型金属氧化物性质
五、典型金属氢氧化物性质
六、物质的特殊转化关系1.交叉型转化
2.三角型转化
七、特征反应
通电
2NaCl +2H2O 2NaOH+Cl2↑+H2↑
通电
2CuSO4 +2H2O 2Cu+O2↑+2H2SO4
通电
4AgNO 3 +2H2O 4Ag+O2↑+4HNO3
少量单质乙过量单质乙
少量O2过量O2 CO 2 C 2CO2
少量Fe 过量Fe
在溶液中:FeCl3Cl2FeCl2 ( FeBr3 Br2 FeBr2 )
化合物B 少量单质乙
单质甲化合物
A
少量O2过量O2
Na2O 2 Na 2Na2O2型的反应:
电解生成三种物质的反应。
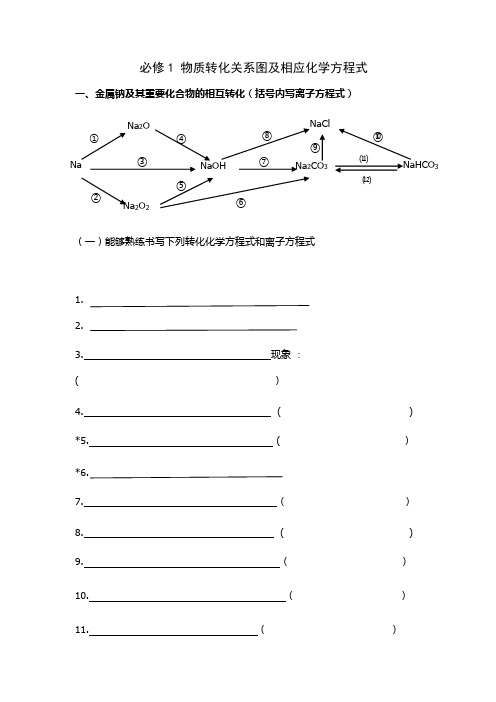
必修1 物质转化关系图及相应化学方程式一、金属钠及其重要化合物的相互转化(括号内写离子方程式)(一)能够熟练书写下列转化化学方程式和离子方程式1. 2.3. 现象 : ( )4. ( ) *5. ( ) *6.7. ( ) 8. ( ) 9. ( ) 10. ( ) 11. ( )Na 2O Na ①NaCl NaHCO 3Na 2CO 3NaOH Na 2O 2②③④⑤⑥⑦⑧ ⑨ ⑩⑾⑿[NaHCO 3固体](二) 熟记下列物质的颜色状态Na: Na 2O: Na 2O 2: NaHCO 3: Na 2CO 3:(三) 熟记下列信息溶解度: NaHCO 3 Na 2CO 3溶液碱性强弱: NaHCO 3 Na 2CO 3 俗名: NaHCO 3: Na 2CO 3: Na 的保存: Na 2O 2的用途:二、金属铝及其重要化合物的相互转化(括号内写离子方程式)1. 2.3. ( )AlAl (OH )3NaAlO 2Al 2O 3AlCl 3 ①② ③ ④ ⑤ ⑥ ⑦ ⑧5. ( ) 6. ( ) 7. ( ) 8. ( ) 9.实验制取Al (OH )3:( ) 10.Al 2O 3的用途:三、金属铁及其化合物的相互转化(括号内写离子方程式)1.2. ( )3. ( )4. ( )5. ( )①Fe 3O 4②23⑿7. ( )8. ( )9. ( )10.属于化合反应的 ( )印刷腐蚀电路板的 ( )11.12.白色沉淀,然后迅速变为灰绿色,最后变为红褐色13.离子颜色:Fe2+ Fe3+四、非金属氯及其化合物的相互转化(括号内写离子方程式)1.2.3.4. NaCl23AgCl⑤⑥⑦⑧6. ( )7. ( )8. ()9. ()10. ()11. ()12. ()13. ()()14.五、非金属硫及其化合物转化关系1.2.3.9.10111213182021六、氮及其化合物相互转化。