物质转化关系图
- 格式:doc
- 大小:944.50 KB
- 文档页数:8
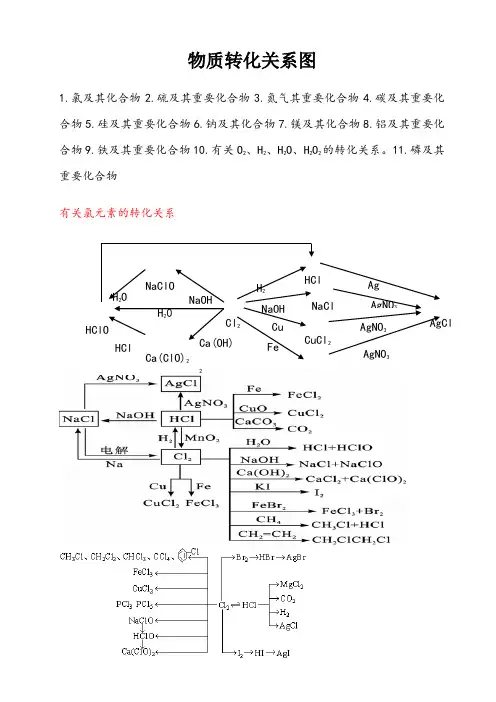


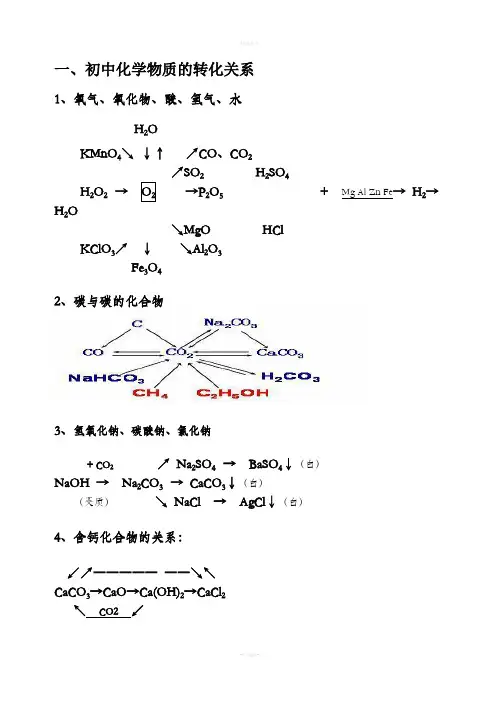
一、初中化学物质的转化关系1、氧气、氧化物、酸、氢气、水H2OKMnO4↘↓↑↗CO、CO2↗SO2H2SO4H2O2→→P2O5+ Mg Al Zn Fe→ H2→H2O ↘MgO HClKClO3↗↓↘Al2O3 Fe3O42、碳与碳的化合物3、氢氧化钠、碳酸钠、氯化钠+ CO2↗ Na2SO4 → BaSO4↓(白)NaOH → Na2CO3 → CaCO3↓(白)(变质)↘ NaCl → AgCl↓(白)4、含钙化合物的关系:↙↗―――――――↘↖CaCO3→CaO→Ca(OH)2→CaCl2↖CO2↙5、氧化钡、氢氧化钡与硫酸钡1 / 32 /3 ↗BaCl 2 → BaSO 4↓(白)BaO → Ba(OH)2 ↗↘ + CuS O 4↘Cu(OH)2↓(蓝)6、硫酸铜、碳酸氢钙、碳酸氢钠、碳酸氢铵CuO ↗ CO 2↙ ↘ Ca(HCO 3)2 → CaCO 3→CaOCuSO 4.5H 2O →CuSO 4→ Cu ↘ H 2O↗Na 2CO 3 ↗ NH 3 → NH 3.H 2O NaHCO 3 →CO 2 NH 4HCO 3 → H 2O↘H 2O → H 2CO 3 ↘ CO 2 → H 2CO 37、铝、镁、锌、铁、铜及其化合物↗ZnSO 4↖ ↗ AlCl 3↖Zn → ZnO Al → Al 2O 3 ↘ZnCl 2↙ ↘Al 2(SO 4)3↙Fe Al↗MgCl 2↖ ↙﹉﹉﹉﹉↗ CuCl 2↘↖Mg → MgO Cu ←→CuO Cu(OH)2 ↘MgSO 4↙ ↖____↘ CuSO 4↗↙ Fe Al↙ FeCl 3 ↖ C CO H 2 Mg Al ↗FeSO 4Fe(OH)3 Fe 2O 3 ←――――→ Fe↖Fe 2(SO 4)3↙ O 2 H 2O ↘ FeCl 2 8、常见物质的相互转化关系(即注明必要的反应物、反应条件)CO 2 CO C 或O 2 O 2 H 2O H 2O 2Al 2O 3 AlCl 3 Al CuO CuSO 4 Cu ⑴ ⑵ ⑶ ⑷ MgO MgSO 4 Mg Cu H 2 Fe CaO Ca(OH)2 CaCO 3 CaCl 2 Ca(OH)2CaCO 3 ⑸ ⑹ ⑺ ⑻CaCO3Na2CO3CO2CO2NaOHNa2CO3CO2O2H2ONaOH NH4ClNH3⑼⑽⑾⑿3 / 3。
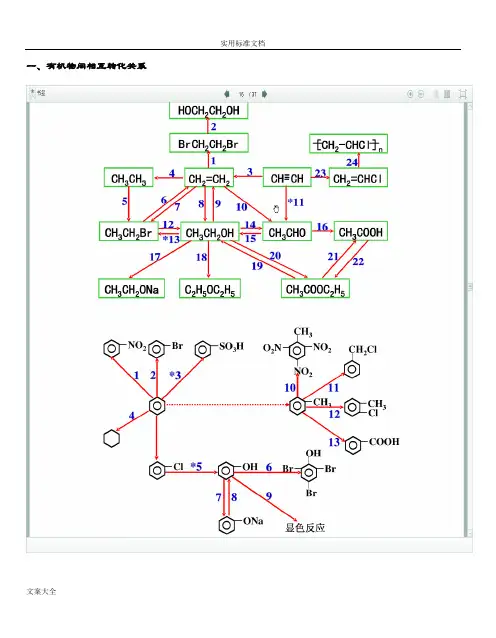
一、有机物间相互转化关系二、能与溴水发生化学反应而使溴水褪色或变色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等)⑷ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑸ 天然橡胶(聚异戊二烯)2、无机物:⑴ -2价的S (硫化氢及硫化物)⑵ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑶ + 2价的Fe6FeSO 4 + 3Br 2 = 2Fe 2(SO 4)3 + 2FeBr 36FeCl 2 + 3Br 2 = 4FeCl 3 + 2FeBr 32FeI 2 + 3Br 2 = 2FeBr 3 + 2I 2⑷ Zn 、Mg 等单质 如⑸ -1价的I (氢碘酸及碘化物)变色 ⑹ NaOH 等强碱、Na 2CO 3和AgNO 3等盐 Br 2 + H 2O = HBr + HBrO2HBr + Na 2CO 3 = 2NaBr + CO 2↑+ H 2O HBrO + Na 2CO 3 = NaBrO + NaHCO 3三、能萃取溴而使溴水褪色的物质上层变无色的(ρ>1):卤代烃(CCl 4、氯仿、溴苯等)、CS 2等;下层变无色的(ρ<1):直馏汽油、煤焦油、苯及苯的同系物、低级酯、液态环烷烃、液态饱和烃(如己烷等)等 四、能使酸性高锰酸钾溶液褪色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等) ⑷ 醇类物质(乙醇等)⑸ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑹ 天然橡胶(聚异戊二烯) ⑺ 苯的同系物变色 Mg + Br 2 === MgBr 2 (其中亦有Mg 与H +、Mg 与HBrO 的反应) △2、无机物:⑴ 氢卤酸及卤化物(氢溴酸、氢碘酸、浓盐酸、溴化物、碘化物) ⑵ + 2价的Fe (亚铁盐及氢氧化亚铁) ⑶ -2价的S (硫化氢及硫化物)⑷ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑸ 双氧水(H 2O 2)五、常见的各类有机物的官能团,结构特点及主要化学性质(1) 烷烃A) 官能团:无 ;通式:C n H 2n +2;代表物:CH 4B) 结构特点:键角为109°28′,空间正四面体分子。

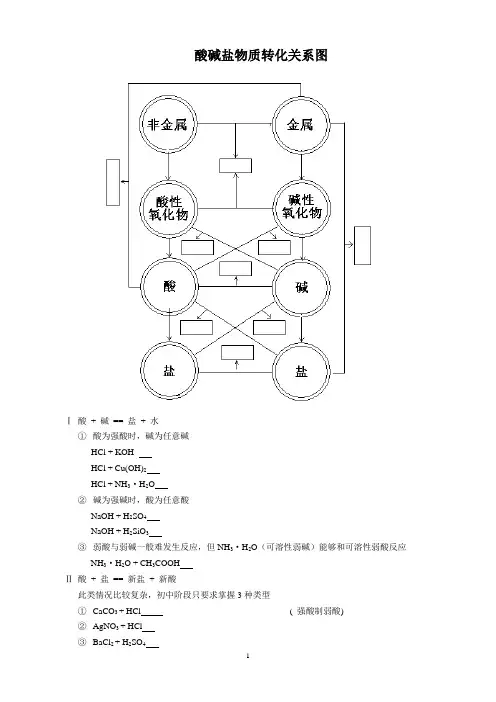
酸碱盐物质转化关系图
Ⅰ酸+ 碱== 盐+ 水
①酸为强酸时,碱为任意碱
HCl + KOH
HCl + Cu(OH)2
HCl + NH3·H2O
②碱为强碱时,酸为任意酸
NaOH + H2SO4
NaOH + H2SiO3
③弱酸与弱碱一般难发生反应,但NH3·H2O(可溶性弱碱)能够和可溶性弱酸反应
NH3·H2O + CH3COOH
Ⅱ酸+ 盐== 新盐+ 新酸
此类情况比较复杂,初中阶段只要求掌握3种类型
①CaCO3 + HCl ( 强酸制弱酸)
②AgNO3 + HCl
③BaCl2 + H2SO4
Ⅲ碱+ 盐== 新盐+ 新碱
反应条件:反应物均能溶于水,产物应有沉淀或气体生成
①NaOH + CuSO4
②NaOH + NH4Cl
Ⅳ盐+ 盐== 新盐+ 新盐
反应条件:反应物均能溶于水,产物至少有一种沉淀
①AgNO3 + NaCl
②BaCl2 + CuSO4
酸、碱、盐、氧化物、单质之间的转化关系
例:用七种方法制取MgCl2
Ⅰ.Mg + Cl2 ==== MgCl2①
Ⅱ.MgO + HCl ==== MgCl2 + H2O ②
Ⅲ.Mg(OH)2 +2HCl ==== MgCl2 +2H2O ④
Ⅳ.MgCO3+2HCl === MgCl2 +H2O+CO2↑⑥
Ⅴ.MgSO4 + BaCl2 === MgCl2 + BaSO4↓⑦
Ⅵ.Mg + CuCl2 ==== MgCl2 + Cu ⑧
Ⅶ.Mg + 2HCl ==== MgCl2 + H2↑⑨。
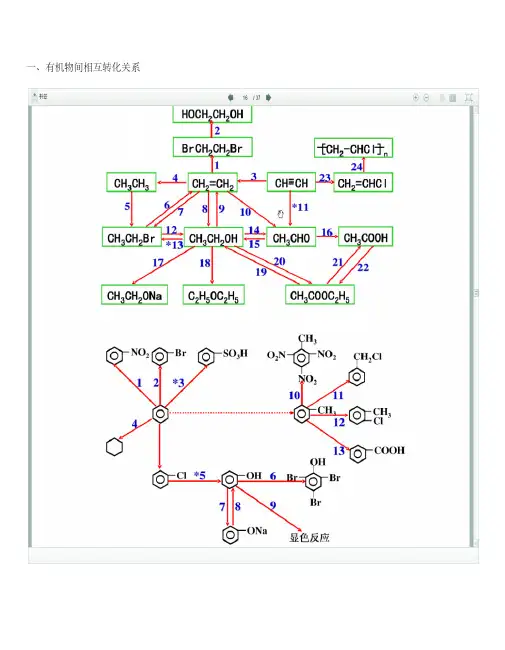
一、有机物间相互转化关系二、能与溴水发生化学反应而使溴水褪色或变色的物质1、有机物:⑴不饱和烃(烯烃、炔烃、二烯烃等)⑵不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等)⑶石油产品(裂化气、裂解气、裂化汽油等)⑷含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等)⑸天然橡胶(聚异戊二烯)2、无机物:⑴-2价的S (硫化氢及硫化物)⑵+ 4价的S (二氧化硫、亚硫酸及亚硫酸盐)⑶+ 2价的Fe6FeSO 4 + 3Br 2 = 2Fe 2(SO 4)3 + 2FeBr 36FeCl 2 + 3Br 2 = 4FeCl 3 + 2FeBr 32FeI 2 + 3Br 2 = 2FeBr 3 + 2I 2⑷Zn 、Mg 等单质如⑸-1价的I (氢碘酸及碘化物)变色⑹NaOH 等强碱、Na 2CO 3和AgNO 3等盐Br 2 + H 2O = HBr + HBrO2HBr + Na 2CO 3 = 2NaBr + CO 2↑+ H 2O HBrO + Na 2CO 3 = NaBrO + NaHCO 3三、能萃取溴而使溴水褪色的物质上层变无色的(ρ>1):卤代烃(CCl 4、氯仿、溴苯等)、CS 2等;下层变无色的(ρ<1):直馏汽油、煤焦油、苯及苯的同系物、低级酯、液态环烷烃、液态饱和烃(如己烷等)等四、能使酸性高锰酸钾溶液褪色的物质1、有机物:⑴不饱和烃(烯烃、炔烃、二烯烃等)⑵不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等)⑶石油产品(裂化气、裂解气、裂化汽油等)⑷醇类物质(乙醇等)⑸含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等)⑹天然橡胶(聚异戊二烯)⑺苯的同系物变色Mg + Br 2 === MgBr 2(其中亦有Mg 与H +、Mg 与HBrO 的反应)△2、无机物:⑴氢卤酸及卤化物(氢溴酸、氢碘酸、浓盐酸、溴化物、碘化物)⑵+ 2价的Fe (亚铁盐及氢氧化亚铁)⑶-2价的S (硫化氢及硫化物)⑷+ 4价的S (二氧化硫、亚硫酸及亚硫酸盐)⑸双氧水(H 2O 2)五、常见的各类有机物的官能团,结构特点及主要化学性质(1) 烷烃A)官能团:无;通式:C n H 2n+2;代表物:CH 4B) 结构特点:键角为109°28′,空间正四面体分子。

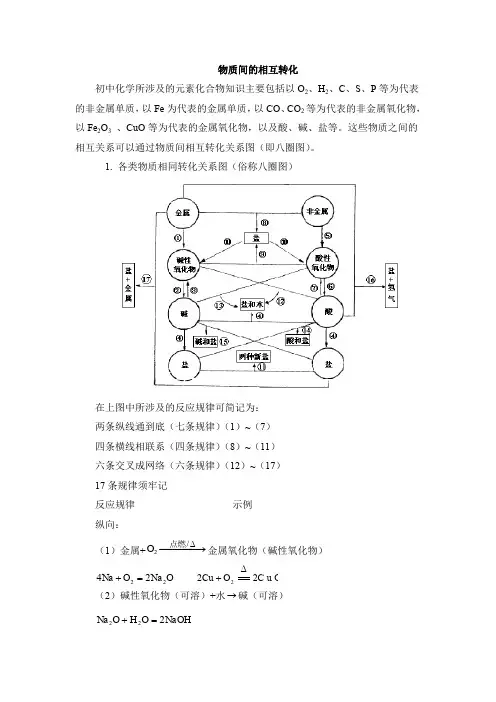
物质间的相互转化初中化学所涉及的元素化合物知识主要包括以O 2、H 2、C 、S 、P 等为代表的非金属单质,以Fe 为代表的金属单质,以CO 、CO 2等为代表的非金属氧化物,以Fe 2O 3 、CuO 等为代表的金属氧化物,以及酸、碱、盐等。
这些物质之间的相互关系可以通过物质间相互转化关系图(即八圈图)。
1. 各类物质相同转化关系图(俗称八圈图)在上图中所涉及的反应规律可简记为:两条纵线通到底(七条规律)(1)~(7)四条横线相联系(四条规律)(8)~(11)六条交叉成网络(六条规律)(12)~(17)17条规律须牢记反应规律示例纵向:(1)金属+−−−→−∆/2点燃O 金属氧化物(碱性氧化物) O Na O Na 2224=+ C u O O Cu 222∆+(2)碱性氧化物(可溶)+水→碱(可溶)NaOH O H O Na 222=+(3)碱(难溶)−−−→−∆高温/碱氧(难溶) + 水∆==2)(OH Cu O H CuO 2+(4)酸+碱→盐+水 O H PO Na PO H NaOH 2434333+=+O H C u S O SO H OH Cu 244222)(+=+ (5)非金属+−−→−点燃2O 非金属氧化物(酸性氧化物) 22CO O C 点燃+ 522254O P O P 点燃+ (6)酸性氧化物(易溶)+水→酸(易溶)3222CO H O H CO =+ 4325223PO H O H O P =+(7)酸(易挥发 / 难溶)→酸氧+水(易挥发 / 难溶)↑+=2232CO O H CO H 2232S i O O H S i O H +∆从纵向来看,金属→碱性氧化物→碱→盐,其中金属元素相同。
非金属→酸性氧化物→酸(含氧酸)→盐,其中非金属元素相同。
横向:(8)金属+非金属→(无氧酸)盐NaCl Cl Na 222点燃+(9)碱氧+酸氧→(含氧酸)盐 32CaSiO SiO CaO 高温+(10)含氧酸盐→碱氧+酸氧↑+23CO CaO CaCO 高温(11)盐+盐→两种新盐↓+=+AgCl NaNO AgNO NaCl 33交叉:(12)酸+碱氧→盐+水O H CuSO CuO SO H 2442+=+(13)碱+酸氧→盐+水O H CO Na CO NaOH 23222+=+(14)酸+盐→新酸+新盐32423242CO H SO Na CO Na SO H +=+↑+=2232CO O H CO H(15)碱+盐→新碱+新盐↓+=+2424)(2OH Cu SO Na CuSO NaOH(16)金属+酸→盐+↑2H↑+=+2442)(H ZnSO SO H Zn 稀(17)金属+盐→新盐+新金属44ZnSO Cu CuSO Zn +=+以上十七条规律的应用:(1)可知某物质的性质。
