镁及其化合物转化关系图
- 格式:docx
- 大小:40.35 KB
- 文档页数:1

(19)镁、铝及其化合物ꢀ考纲要求:1.了解镁、铝及其重要化合物的制备方法。
(宏观辨识与微观探析、变化观念与平衡思想)ꢀ2.掌握镁、铝单质及其重要化合物的主要性质及其应用。
(科学探究与创新意识、科学态度与社会责任)回归教材一、镁1.结构和存在第3周期第ⅡA 族ꢀꢀ镁位于元素周期表ꢀꢀꢀꢀꢀꢀꢀꢀꢀ,原子结构示意图化合ꢀꢀ,镁性质活泼,在自然界中的镁全部以ꢀꢀꢀ态为ꢀ存在。
ꢀ2.物理性质:银白色ꢀꢀꢀꢀꢀ镁是具有ꢀꢀꢀꢀ金属光泽的固体,密度、硬度均较小,熔点较低,有良好的导电、导热性和延展性。
ꢀ3.化学性质:①与非金属反应,如与N、Cl、O的反应:222ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ、ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ、ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ。
ꢀ②与CO2反应:ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ。
ꢀ③与H O反应:Mg+2H OꢀMg(OH)+H↑。
2222Mg+2H+==Mg2++H↑ꢀ④与强酸反应:ꢀ2。
ꢀ4.镁的重要化合物:MgO+2H+==Mg2++H2OMg(OH)+2H+==Mg2++2H O225.镁及其化合物的用途:ꢀꢀꢀ镁应用于生产合金,冶金工业上用作还原剂和脱氧剂。
耐火ꢀMgO熔点很高,可作ꢀꢀꢀꢀ材料。
ꢀ二、铝1.结构和存在铝的原子结构示意图为ꢀꢀꢀꢀ。
铝位于元素周期第3周期第ⅢA族化合表ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ,自然界中的铝全部以ꢀꢀꢀ态存在。
2.物理性质:银白ꢀ较小ꢀꢀꢀꢀꢀ铝是ꢀꢀꢀꢀ色、具有金属光泽的固体,硬度ꢀꢀꢀ,具有良好的ꢀꢀ导ꢀ电ꢀ性ꢀꢀ、导热性和延展性。
ꢀ3.化学性质:写出图中有关反应的化学方程式或离子方程式:4Al+3O2Al O①_________2______________________________________。
232Al+Fe O2Fe+Al O②_______________________________________________。

元素化合物及其价类二维图引子:元素化合物的知识给人的感觉就是“繁、乱、杂、难”,我们认为以物质的类别为横坐标,以某元素的化合价为纵坐标,在二维平面内,绘制含有某元素的物质的转化图像,既能体现“元素观”也能体现“分类观”和转化观,进而实现对元素化合物知识的系统化,有助于建立系统的知识体系,明确学习要点,形成化学基本观念。
思路点拨分析物质的通性分析氧化性和还原性元素的最高价态只有氧化性,元素的中间价态既有氧化性又有还原性,元素的最低价态只有还原性。
分析离子反应离子反应发生的条件包括生成沉淀、弱电解质或气体的复分解反应,也包括因氧化还原反应的导致的离子反应,还包括相互促进的彻底水解、沉淀的转化、络合反应等。
一、钠元素及其化合物1.价类二维图2.核心物质的性质3.重要化学方程式的书写0101钠和氧气在加热条件下的反应(化) 2Na +O 2=====△Na 2O 20102钠和氯气在加热条件下的反应(化) 2Na+Cl 2=====△2NaCl0103过氧化钠和水反应(化)2Na2O2+2H2O===4NaOH+O2↑0104过氧化钠和二氧化碳反应(化)2Na2O2+2CO2===2Na2CO3+O20105钠和水反应(离)2Na+2H2O===2Na++2OH-+H2↑0106氢氧化钠与过量二氧化碳反应(离)OH-+CO2===HCO3-0107钠和乙醇反应(化)2CH3CH2OH+2Na→2CH3CH2ONa+H2↑0108过量钠与氯化铝溶液反应,先后可能发生的三个反应(化)2Na+2H2O===2NaOH+H2↑AlCl3+3NaOH===Al(OH)3↓+3NaCl Al(OH)3+NaOH===Na[Al(OH)4]二、氯元素及其化合物1.价类二维图2.核心物质的性质3.重要化学方程式的书写0201向氯化亚铁溶液中滴加氯水(化) 2FeCl 2+Cl 2=2FeCl 30202铁在氯气中燃烧(化)2Fe+3Cl 22FeCl 30203氯气的尾气吸收(离) Cl 2+2OH -===ClO -+Cl -+H 2O 0204漂白粉的制备(化)2Ca(OH)2+2Cl 2===CaCl 2+Ca(ClO)2+2H 2O 0205漂白粉的失效(2 化)Ca(ClO)2+CO 2+H 2O===CaCO 3↓+2HClO 2HClO2HCl+O 2↑0206氯气的实验室制备(离)4H ++2Cl -+MnO 2=====△Mn 2++Cl 2↑+2H 2O0207将等物质的量的二氧化硫和氯气通入水中(离) SO 2+Cl 2+2H 2O===SO 2-4+2Cl -+4H +0208工业上盐酸的制备(化)Cl2+H22HCl0209氯离子检验(证明存在)过程中一定会发生的离子方程式(离)Cl-+Ag+===AgCl↓三、铁元素及其化合物1.价类二维图2.核心物质的性质3.重要化学方程式的书写0301铁在高温条件下与水蒸气反应(化)3Fe+4H 2O Fe 3O 4+H 2↑0302铁与硫化合(化) Fe+S =====△FeS0303铁与非氧化性强酸反应(离) Fe+2H +=== Fe 2++H 2↑0304铁和硫酸铜溶液反应(离) Fe+ Cu 2+=== Fe 2++ Cu0305铁和氯化铁溶液反应(离) Fe +2Fe 3+===3Fe 2+0306向氯化亚铁溶液中通入氯气(离) 2Fe 2++Cl 2===2Fe 3++2Cl -0307向硝酸亚铁溶液中滴加稀硫酸(离) 3Fe 2++NO 3-+4H +===3Fe 3++NO ↑+2H 2O0308向硫酸亚铁溶液(酸性)中滴加过氧化氢溶液(离)2Fe2++H2O2+2H+===2Fe3++2H2O0309向硫酸铁溶液中通入二氧化硫气体(离)2Fe2++SO2+2H2O===2Fe3++SO42-+4H+0310氢氧化亚铁露置在空气中(化)4Fe(OH)2+O2+2H2O===4Fe(OH)3四、碳元素及其化合物1.价类二维图2.核心物质的性质3.重要化学方程式的书写0401碳和浓硫酸在加热条件下反应(化)C+2H2SO4(浓)CO2↑+2SO2↑+2H2O0402碳和水在高温条件下反应(化)C+H2O CO+H20403向次氯酸钠溶液中通入过量二氧化碳(离)ClO-+CO2+ H2O=HCO3-+HClO0404实验室制备二氧化碳(离)CaCO3 + 2H+ = Ca2++CO2↑+ H2O0405可溶性碳酸盐与强酸反应(离)CO32- + 2H+=CO2↑+ H2O0406碳酸氢钠溶液与氢氧化钠溶液反应(离)HCO3-+OH-=CO32- + H2O0407向碳酸氢钠溶液中滴加盐酸(离)HCO3-+H+=CO2↑+ H2O0408向可溶性碳酸盐溶液中加入氯化钡溶液(离)CO32- +Ba2+=BaCO3↓0409向氢氧化钡溶液中通入少量二氧化碳气体(离)Ba2++2OH-+CO2 =BaCO3↓+H2O0410加热碳酸氢钠固体(化)2NaHCO3Na2CO3+CO2↑+ H2O五、氮元素及其化合物1.价类二维图2.核心物质的性质3.重要化学方程式的书写 0501工业制氨气(化)N 2+3H 22NH 30502实验室制氨气(化)2NH 4Cl +Ca(OH)2=====△CaCl 2+2NH 3↑+2H 2O 0503铜与稀硝酸反应(离)3Cu +2NO -3+8H +===3Cu 2++2NO ↑+4H 2O 0504碳与浓硝酸的反应(化)C +4HNO 3(浓) =====△CO 2↑+4NO 2↑+2H 2O 0505氨的催化氧化(化) 4NH 3+5O 2=====催化剂△4NO +6H 2O 0506氯化铝溶液与氨水的反应(离)Al 3++3NH 3·H 20=A1(OH)3↓+3NH 4+0507氯化铵和氢氧化钠溶液在加热条件下反应(离) NH 4++OH -=====△NH 3↑+H 20 0508碳酸铵的受热分解(化)(NH 4)2CO 3=====△2NH 3↑+CO 2↑+H 20六、硫元素及其化合物 1.价类二维图2.核心物质的性质3.重要化学方程式的书写 0601铜与硫的化合(化) 2Cu+S =====△Cu 2S0602硫与浓硫酸的反应(化) S+2H 2SO 4(浓)=====△3SO 2↑+2H 2O 0603硫化氢和二氧化硫的反应(化) 2H 2S +SO 2===3S ↓+2H 2O 0604二氧化硫尾气的吸收(化) 2NaOH+SO 2=Na 2SO 3+H 2O0605二氧化硫的催化氧化(工业制备硫酸)(化) 2SO 2↑+O 2=====催化剂△2SO 3 0606将二氧化硫通入到溴水中(化) SO 2+Br 2+2H 2O===H 2SO 4+2HBr 0607浓硫酸和碳反应(化)C +2H 2SO 4(浓)=====△CO 2↑+2SO 2↑+2H 2O 0608浓硫酸和铜反应(化)Cu +2H 2SO 4(浓)=====△CuSO 4+SO 2↑+2H 2O七、镁元素及其化合物 1.价类二维图2.核心物质的性质3.重要化学方程式的书写0701镁与空气中燃烧时可能发生的反应(3 化)2Mg+ O22MgO 3Mg+N2Mg3N22Mg+ CO22MgO+C 0702工业上镁的炼制(化)MgCl2Mg+Cl2↑0703氢氧化镁与盐酸反应(离)Mg(OH)2+2H+===Mg2++2H2O0704氯碱工业(化)2NaCl+2H2O2NaOH+Cl2↑+H2↑0705向溴化钠溶液中滴加氯水(离)2Br-+Cl2===2Cl-+Br20706向碘化钾溶液中滴加溴水(离)2I-+Br2===2Br-+I2八、硅元素及其化合物1.价类二维图2.核心物质的性质3.重要化学方程式的书写0801硅与氧气在加热条件下的反应(化) Si+O 2=====△SiO 20802不能用带玻璃塞的试剂瓶保存碱性溶液的原因(化) SiO 2+2NaOH===Na 2SiO 3+H 2O 0803玻璃刻蚀过程中发生的反应(化) SiO 2+4HF===SiF 4↑+2H 2O 0804工业上硅的制备(化)SiO 2+2C Si+2CO0805玻璃制备过程发生的反应(2 化)Na 2CO 3+SiO 2Na 2SiO 3+CO 2↑ CaCO 3+SiO 2CaSiO 3+CO 2↑0806能证明碳酸酸性比硅酸酸性强的反应(化) Na 2CO 3+CO 2+H 2O===H 2SiO 3↓+Na 2CO 3 0807硅酸的受热分解(化) H 2SiO 3=====△SiO 2+H 2O 九、铝元素及其化合物 1.价类二维图2.核心物质的性质3.重要化学方程式的书写0901铝与氢氧化钠溶液反应(离)2Al+2OH-+2H2O===2AlO-2+3H2↑0902铝与四氧化三铁在高温条件下的反应(化)8Al+3Fe3O44Al2O3+9Fe0903氧化铝与氢氧化钠溶液反应(离)Al 2O 3+2OH -===2AlO -2+H 2O 或Al 2O 3+2OH -+3H 2O===2[Al(OH)4]- 0904实验室中氢氧化铝的制备(离) Al 3++3NH 3·H 2O===Al(OH)3↓+3NH +40905氯化铝溶液与过量氢氧化钠溶液反应(离) Al 3++4OH -===[Al(OH)4]-0906向四羟基合铝酸钠溶液中通入过量二氧化碳气体(离) [Al(OH)4]-+CO 2===Al(OH)3↓+HCO 3- 0907氢氧化铝的受热分解(化) 2Al(OH)3=====△Al 2O 3+3H 2O 0908工业上铝的冶炼(化)2Al 2O 34Al+3O 2↑十、铜元素及其化合物 1.价类二维图2.核心物质的性质3.重要化学方程式的书写 1001铜与浓硫酸的反应(化)Cu +2H 2SO 4(浓)=====△CuSO 4+SO 2↑+2H 2O 1002铜与稀硝酸的反应(化)3Cu +8HNO 3===3Cu(NO 3)2+2NO ↑+4H 2O 1003氧化铜溶于盐酸中(离) CuO+2H +===Cu 2++H 2O1004铜与氯化铁溶液反应(离) Cu+2Fe 3+===Cu 2++2Fe 2+1005氧化铜高温条件下分解(化)4CuO2Cu 2O+O 2↑1006气体中少量水的检验过程中发生反应(化) CuSO 4+5H 2O ===CuSO 4?5H 2O1007铜在潮湿空气中被腐蚀生成铜绿(化) 2Cu+O 2+CO 2+H 2O ===Cu 2(OH)2CO 3。


2019高考钠、镁、铝试题的解题方法与技巧!高考对钠及其化合物的考查重点是钠的氧化物和钠盐的性质、推断、计算和实验探究。
钠的化合物的转化关系是联系生产、生活实际的重要切入点。
常以框图题形式出现在综合题中,应用心体会。
镁、铝及其化合物的知识点丰富,性质应用广泛,命题空间大。
以实验为手段,以工业生产为背景,以图像分析和计算为重点,题型灵活、是高考的热点。
预计2018年仍以实际情景为依托,以元素化合物知识为载体,融元素化合物、化学基本理论、化学实验、化学计算、图像分析等知识于一体,既考查考生对知识的整合能力,又考查新课标的三种能力,并提高从化学视角分析和解决实际问题的能力。
题型有选择题和填空题;以选择题形式考查Na、Mg、Al单质及其化合物的性质和应用,在Ⅱ卷中与化学反应原理结合考查综合推断,实验探究和无机化工流程图,以填空题形式考查。
一、钠及其化合物1.氧化钠和过氧化钠:Na2O和Na2O2的比较2.碳酸钠与碳酸氢钠1.金属钠与酸溶液反应:Na与H2O反应的实质是Na置换H2O电离出的H +。
酸溶液中H +主要由酸电离得到,所以Na投入酸溶液中时,首先与酸反应,且比在纯水中反应剧烈,只有当酸反应完后,才与水反应。
例如少量Na投入盐酸中先发生反应:2Na+2HCl=2NaCl+H2↑。
2.钠与盐溶液的反应:钠与盐溶液反应,不能置换出盐中的金属,这是因为金属阳离子在水中一般是以水合离子形式存在,即金属离子周围有一定数目的水分子包围着,不能和钠直接接触,所以钠先与水反应,然后生成的碱再与盐反应。
例如钠与氯化铁溶液反应:2Na+2H2O=2NaOH+H2↑,3NaOH+FeCl3=Fe(OH)3↓+3NaCl。
3.过氧化钠的特性及计算规律:(1)Na2O2的强氧化性:①Na2O2与SO2反应:Na2O2+SO2=Na2SO4。
②Na2O2投入FeCl2溶液中,可将Fe2+氧化成Fe3+,同时生成Fe(OH)3沉淀。
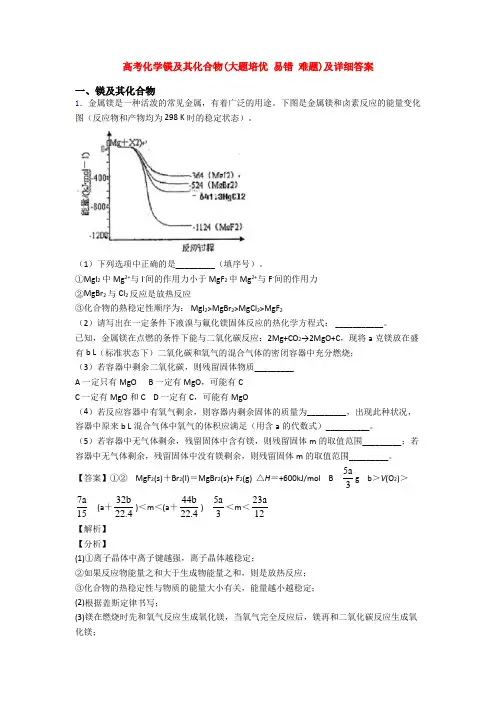
高考化学镁及其化合物(大题培优易错难题)及详细答案一、镁及其化合物1.金属镁是一种活泼的常见金属,有着广泛的用途。
下图是金属镁和卤素反应的能量变化图(反应物和产物均为298 K时的稳定状态)。
(1)下列选项中正确的是_________(填序号)。
①MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力②MgBr2与Cl2反应是放热反应③化合物的熟稳定性顺序为: MgI2>MgBr2>MgCl2>MgF2(2)请写出在一定条件下液溴与氟化镁固体反应的热化学方程式: ___________。
已知,金属镁在点燃的条件下能与二氧化碳反应:2Mg+CO2→2MgO+C,现将a克镁放在盛有b L(标准状态下)二氧化碳和氧气的混合气体的密闭容器中充分燃烧;(3)若容器中剩余二氧化碳,则残留固体物质_________A 一定只有MgOB 一定有MgO,可能有CC 一定有MgO和CD 一定有C,可能有MgO(4)若反应容器中有氧气剩余,则容器内剩余固体的质量为_________,出现此种状况,容器中原来b L混合气体中氧气的体积应满足(用含a的代数式)__________。
(5)若容器中无气体剩余,残留固体中含有镁,则残留固体m的取值范围_________;若容器中无气体剩余,残留固体中没有镁剩余,则残留固体m的取值范围_________。
【答案】①② MgF2(s)+Br2(l)=MgBr2(s)+ F2(g) △H=+600kJ/mol B 5a3g b>V(O2)>7a 15 (a+32b22.4)<m<(a+44b22.4)5a3<m<23a12【解析】【分析】(1)①离子晶体中离子键越强,离子晶体越稳定;②如果反应物能量之和大于生成物能量之和,则是放热反应;③化合物的热稳定性与物质的能量大小有关,能量越小越稳定;(2)根据盖斯定律书写;(3)镁在燃烧时先和氧气反应生成氧化镁,当氧气完全反应后,镁再和二氧化碳反应生成氧化镁;(4)若氧气有剩余,则镁只和氧气反应生成氧化镁,根据原子守恒计算;采用极限的方法计算;(5)若容器中无气体剩余,残留固体中含有镁,假设气体全部为氧气或二氧化碳,然后采用极限的方法解答;若容器中无气体剩余,残留固体中没有镁剩余,说明二者完全反应。

化工生产中镁、铝及其化合物的转化关系1.从海水中提取镁的流程 (1)流程:(2)主要化学反应:①制石灰乳:CaCO 3=====高温CaO +CO 2↑、CaO +H 2O===Ca(OH)2;②沉淀Mg 2+:Mg 2++2Ca(OH)2===Mg(OH)2↓+Ca 2+;③制备MgCl 2:Mg(OH)2+2HCl===MgCl 2+2H 2O ;④电解MgCl 2:MgCl 2(熔融)=====电解Mg +Cl 2↑。
2.工业炼铝的流程铝是地壳中含量最多的金属元素,在自然界主要以化合态形式存在于氧化铝中。
铝土矿的主要成分是Al 2O 3,此外还含有少量SiO 2、Fe 2O 3等杂质,冶炼金属铝很重要的一个过程是Al 2O 3的提纯。
由于Al 2O 3是两性氧化物,而杂质SiO 2是酸性氧化物,Fe 2O 3是碱性氧化物,因而可设计出两种提纯氧化铝的方案。
方案一:碱溶法讨论回答下列问题: (1)写出①、③两步骤中可能发生反应的离子方程式。
答案 ①Al 2O 3+2OH -===2AlO -2+H 2O ,SiO 2+2OH -===SiO 2-3+H 2O③AlO -2+CO 2+2H 2O===Al(OH)3↓+HCO -3,SiO 2-3+2CO 2+2H 2O===H 2SiO 3↓+2HCO -3(2)步骤③中不用盐酸(或H 2SO 4)酸化的理由是________________________________________________________________________。
答案 因为AlO -2与酸反应生成的Al(OH)3具有两性,可溶于强酸,不易控制酸的量;CO 2廉价而且生成的副产物NaHCO 3用途广泛,经济效益好(3)步骤④中得到较纯的Al 2O 3,可能含有________杂质,在电解时它不会影响铝的纯度的原因:________________________________________________________________________。

天才在于勤奋,聪明在于积累。
班级姓名小组专题复习之各类物质之间的相互转化关系〖复习目标〗:掌握一个知识网络、理解两种反应条件、了解四种离子检验、熟记忆六种物质性质。
1.酸、碱、盐、氧化物之间相互转化关系网络图2.理解两种反应条件复分解反应发生的条件:(1)从定以上分析:复分解反应是两种化合物相互交换成份生成另外两种化合物的反应。
判断一个反应是否是复分解反应不能仅仅依据反应物和生成物的种类来判断,还必须看反应的实质。
如:2NaOH + CO2=Na2CO3+H2O就不属于复分解反应,因为两种反应物没有相互交换成份。
再如:CaCO3+2HCl=CaCl2+H2O+CO2↑,从形式上来看,虽然该反应的产物有三种化合物生成,但却属于复分解反应,该反应的实质是:CaCO3+2HCl=CaCl2+H2CO3,H2CO3不稳定分解为H 2O和CO2,因此该却反应属于复分解反应。
(2)复分解反应发生的条件是:①对于反应物来说:盐与碱、盐与盐反应时,两种反应物必须全部溶于水。
②对于生成物来说要么有水生成,要么有沉淀生成,要么有气体生成。
金属与盐溶液发生置换反应的条件:金属与盐溶液发生置换反应的条件是(1) 金属的位置:只有排在前面的金属才能把后面的金属从其盐溶液中置换出来;(2) 特殊性:由于钾、钙、钠的化学性质非常活泼,在盐溶液中它们会首先与水反应生成相应的碱和氢气,因而不会置换出盐中的金属;(3) 盐必须溶于水。
(4) 铁与盐溶液反应时生成+2价的亚铁盐,金属与铁盐反应时,要用+2价的亚铁盐。
酸、碱、盐及氧化物、金属和非金属单质等物质之间的相互转化关系——八圈图记忆口诀:两条纵线通到底(6条规律)四条横线相联系(5条规律)六条交叉成网络(6条规律)17条规律要牢记(横、纵各有1条重复6+5+6=17)规律:天才在于勤奋,聪明在于积累。
班级姓名小组分解反应以上规律的应用:①可知某物质性质②某物质制法(箭尾)(箭头指向)③各类物质间相互关系从上述规律中可以总结出制盐的十种方法,包括:(2)~(16)【典型例题】[例1] 现有石灰石、水、碳酸钠,怎样制取烧碱(不能引入其他物质),写出化学方程式。

镁的单质及其化合物化学式Mg,它是一种银白色的轻质碱土金属,化学性质活泼,能与酸反应生成氢气,具有一定的延展性和热消散性。
镁元素在自然界广泛分布,是人体的必需元素之一,原子结构示意图:。
物理性质:具有银白色光泽,略有延展性。
镁的密度小,离子化倾向大。
在空气中,镁的表面会生成一层很薄的氧化膜,使空气很难与它反应。
化学性质:镁具有比较强的还原性,能与沸水反应放出氢气,燃烧时能产生眩目的白光,镁与氟化物、氢氟酸和铬酸不发生作用,也不受苛性碱侵蚀,但极易溶解于有机和无机酸中。
镁的日常用途医疗用途:治疗缺镁和痉挛。
体育用途:在紧张运动几小时前注射镁化合物,或在紧张运动后注射以弥补镁的流失。
体操运动员常涂碱式碳酸镁来增加摩擦力。
医疗中:如果注射镁盐速度太快,会造成发烧和全身不适。
金属镁能与大多数非金属和酸反应;在高压下能与氢直接合成氢化镁;镁能与卤化烃作用合成格氏试剂,广泛应用于有机合成。
镁具有生成配位化合物的明显倾向。
氧化镁:化学式MgO是镁的氧化物,一种离子化合物。
常温下为一种白色固体。
氧化镁以方镁石形式存在于自然界中,是冶镁的原料。
氢氧化镁:总反应:MgCl2(熔融)Mg+Cl2↑Mg-2e-==Mg2+②镁与非金属反应O2+2Mg2MgOCl2+Mg MgCl2S+Mg MgS3Mg+N2Mg3N2说明在常温下,镁能与空气里的氧气发生反应,生成一层致密的氧化物薄膜,从而使金属失去光泽。
由于这层氧化物薄膜能阻止金属的继续氧化,所以镁有抗腐蚀性。
③镁与酸反应2HCl+Mg==MgCl2+H2↑2H++Mg==Mg2++H2↑镁跟硝酸、浓硫酸反应时,硝酸中的氮元素、硫酸中的硫元素被还原,不生成氢气。
④镁跟某些氧化物反应2Mg+CO2C+2MgO⑤镁跟水反应Mg+2H2O Mg(OH)2+H2↑说明:镁跟冷水反应非常缓慢.2白色难溶于水的固体,其水溶液中c(OH-)很小,可以使酚酞溶液变成浅红色Mg(OH)2(s)Mg2+(aq)+2OH-(aq)①可与酸反应生成盐和水,如Mg(OH)2+2HCl==MgCl2+2H2O②热稳定性差,受热容易分解Mg(OH)2MgO+H2O。

元素及其化合物价类⼆维图元素化合物及其价类⼆维图引⼦:元素化合物的知识给⼈的感觉就是“繁、乱、杂、难”,我们认为以物质的类别为横坐标,以某元素的化合价为纵坐标,在⼆维平⾯内,绘制含有某元素的物质的转化图像,既能体现“元素观”也能体现“分类观”和转化观,进⽽实现对元素化合物知识的系统化,有助于建⽴系统的知识体系,明确学习要点,形成化学基本观念。
思路点拨分析物质的通性分析氧化性和还原性元素的最⾼价态只有氧化性,元素的中间价态既有氧化性⼜有还原性,元素的最低价态只有还原性。
分析离⼦反应离⼦反应发⽣的条件包括⽣成沉淀、弱电解质或⽓体的复分解反应,也包括因氧化还原反应的导致的离⼦反应,还包括相互促进的彻底⽔解、沉淀的转化、络合反应等。
⼀、钠元素及其化合物1.价类⼆维图2.核⼼物质的性质3.重要化学⽅程式的书写0101钠和氧⽓在加热条件下的反应(化) 2Na +O 2=====△Na 2O 20102钠和氯⽓在加热条件下的反应(化) 2Na+Cl 2=====△2NaCl0103过氧化钠和⽔反应(化)2Na2O2+2H2O===4NaOH+O2↑0104过氧化钠和⼆氧化碳反应(化)2Na2O2+2CO2===2Na2CO3+O20105钠和⽔反应(离)2Na+2H2O===2Na++2OH-+H2↑0106氢氧化钠与过量⼆氧化碳反应(离)OH-+CO2===HCO3-0107钠和⼄醇反应(化)2CH3CH2OH+2Na→2CH3CH2ONa+H2↑0108过量钠与氯化铝溶液反应,先后可能发⽣的三个反应(化)2Na+2H2O===2NaOH+H2↑AlCl3+3NaOH===Al(OH)3↓+3NaCl Al(OH)3+NaOH===Na[Al(OH)4]⼆、氯元素及其化合物1.价类⼆维图2.核⼼物质的性质3.重要化学⽅程式的书写0201向氯化亚铁溶液中滴加氯⽔(化) 2FeCl 2+Cl 2=2FeCl 30202铁在氯⽓中燃烧(化)2Fe+3Cl 22FeCl 30203氯⽓的尾⽓吸收(离) Cl 2+2OH -===ClO -+Cl -+H 2O 0204漂⽩粉的制备(化)2Ca(OH)2+2Cl 2===CaCl 2+Ca(ClO)2+2H 2O 0205漂⽩粉的失效(2 化)Ca(ClO)2+CO 2+H 2O===CaCO 3↓+2HClO 2HClO2HCl+O 2↑0206氯⽓的实验室制备(离)4H ++2Cl -+MnO 2=====△Mn 2++Cl 2↑+2H 2O0207将等物质的量的⼆氧化硫和氯⽓通⼊⽔中(离) SO 2+Cl 2+2H 2O===SO 2-4+2Cl -+4H +0208⼯业上盐酸的制备(化)Cl2+H22HCl0209氯离⼦检验(证明存在)过程中⼀定会发⽣的离⼦⽅程式(离)Cl-+Ag+===AgCl↓三、铁元素及其化合物1.价类⼆维图2.核⼼物质的性质3.重要化学⽅程式的书写0301铁在⾼温条件下与⽔蒸⽓反应(化)3Fe+4H 2O Fe 3O 4+H 2↑0302铁与硫化合(化) Fe+S =====△FeS0303铁与⾮氧化性强酸反应(离) Fe+2H +=== Fe 2++H 2↑0304铁和硫酸铜溶液反应(离) Fe+ Cu 2+=== Fe 2++ Cu0305铁和氯化铁溶液反应(离) Fe +2Fe 3+===3Fe 2+0306向氯化亚铁溶液中通⼊氯⽓(离) 2Fe 2++Cl 2===2Fe 3++2Cl -0307向硝酸亚铁溶液中滴加稀硫酸(离) 3Fe 2++NO 3-+4H +===3Fe 3++NO ↑+2H 2O0308向硫酸亚铁溶液(酸性)中滴加过氧化氢溶液(离)2Fe2++H2O2+2H+===2Fe3++2H2O 0309向硫酸铁溶液中通⼊⼆氧化硫⽓体(离)2Fe2++SO2+2H2O===2Fe3++SO42-+4H+0310氢氧化亚铁露置在空⽓中(化)4Fe(OH)2+O2+2H2O===4Fe(OH)3四、碳元素及其化合物1.价类⼆维图2.核⼼物质的性质3.重要化学⽅程式的书写0401碳和浓硫酸在加热条件下反应(化)C+2H2SO4(浓)CO2↑+2SO2↑+2H2O0402碳和⽔在⾼温条件下反应(化)C+H2O CO+H20403向次氯酸钠溶液中通⼊过量⼆氧化碳(离)ClO-+CO2+ H2O=HCO3-+HClO 0404实验室制备⼆氧化碳(离)CaCO3 + 2H+ = Ca2++CO2↑+ H2O0405可溶性碳酸盐与强酸反应(离)CO32- + 2H+=CO2↑+ H2O0406碳酸氢钠溶液与氢氧化钠溶液反应(离)HCO3-+OH-=CO32- + H2O0407向碳酸氢钠溶液中滴加盐酸(离)HCO3-+H+=CO2↑+ H2O0408向可溶性碳酸盐溶液中加⼊氯化钡溶液(离)CO32- +Ba2+=BaCO3↓0409向氢氧化钡溶液中通⼊少量⼆氧化碳⽓体(离)Ba2++2OH-+CO2 =BaCO3↓+H2O 0410加热碳酸氢钠固体(化)2NaHCO3Na2CO3+CO2↑+ H2O五、氮元素及其化合物1.价类⼆维图2.核⼼物质的性质3.重要化学⽅程式的书写 0501⼯业制氨⽓(化)N 2+3H 22NH 30502实验室制氨⽓(化)2NH 4Cl +Ca(OH)2=====△CaCl 2+2NH 3↑+2H 2O 0503铜与稀硝酸反应(离)3Cu +2NO -3+8H +===3Cu 2++2NO ↑+4H 2O 0504碳与浓硝酸的反应(化)C +4HNO 3(浓) =====△CO 2↑+4NO 2↑+2H 2O 0505氨的催化氧化(化) 4NH 3+5O 2=====催化剂△4NO +6H 2O 0506氯化铝溶液与氨⽔的反应(离)Al 3++3NH 3·H 20=A1(OH)3↓+3NH 4+0507氯化铵和氢氧化钠溶液在加热条件下反应(离) NH 4++OH -=====△NH 3↑+H 20 0508碳酸铵的受热分解(化)(NH 4)2CO 3=====△2NH 3↑+CO 2↑+H 20六、硫元素及其化合物 1.价类⼆维图2.核⼼物质的性质3.重要化学⽅程式的书写 0601铜与硫的化合(化) 2Cu+S =====△Cu 2S0602硫与浓硫酸的反应(化) S+2H 2SO 4(浓)=====△3SO 2↑+2H 2O 0603硫化氢和⼆氧化硫的反应(化) 2H 2S +SO 2===3S ↓+2H 2O 0604⼆氧化硫尾⽓的吸收(化)2NaOH+SO 2=Na 2SO 3+H 2O0605⼆氧化硫的催化氧化(⼯业制备硫酸)(化) 2SO 2↑+O 2=====催化剂△2SO 3 0606将⼆氧化硫通⼊到溴⽔中(化) SO 2+Br 2+2H 2O===H 2SO 4+2HBr 0607浓硫酸和碳反应(化)C +2H 2SO 4(浓)=====△CO 2↑+2SO 2↑+2H 2O 0608浓硫酸和铜反应(化)Cu +2H 2SO 4(浓)=====△CuSO 4+SO 2↑+2H 2O七、镁元素及其化合物 1.价类⼆维图2.核⼼物质的性质3.重要化学⽅程式的书写0701镁与空⽓中燃烧时可能发⽣的反应(3 化)2Mg+ O22MgO 3Mg+N2Mg3N22Mg+ CO22MgO+C 0702⼯业上镁的炼制(化)MgCl2Mg+Cl2↑0703氢氧化镁与盐酸反应(离)Mg(OH)2+2H+===Mg2++2H2O0704氯碱⼯业(化)2NaCl+2H2O2NaOH+Cl2↑+H2↑0705向溴化钠溶液中滴加氯⽔(离)2Br-+Cl2===2Cl-+Br20706向碘化钾溶液中滴加溴⽔(离)2I-+Br2===2Br-+I2⼋、硅元素及其化合物1.价类⼆维图2.核⼼物质的性质3.重要化学⽅程式的书写0801硅与氧⽓在加热条件下的反应(化) Si+O 2=====△SiO 20802不能⽤带玻璃塞的试剂瓶保存碱性溶液的原因(化) SiO 2+2NaOH===Na 2SiO 3+H 2O 0803玻璃刻蚀过程中发⽣的反应(化) SiO 2+4HF===SiF 4↑+2H 2O 0804⼯业上硅的制备(化)SiO 2+2C Si+2CO0805玻璃制备过程发⽣的反应(2 化)Na 2CO 3+SiO 2Na 2SiO 3+CO 2↑ CaCO 3+SiO 2CaSiO 3+CO 2↑0806能证明碳酸酸性⽐硅酸酸性强的反应(化) Na 2CO 3+CO 2+H 2O===H 2SiO 3↓+Na 2CO 3 0807硅酸的受热分解(化) H 2SiO 3=====△SiO 2+H 2O 九、铝元素及其化合物 1.价类⼆维图2.核⼼物质的性质3.重要化学⽅程式的书写0901铝与氢氧化钠溶液反应(离)2Al+2OH-+2H2O===2AlO-2+3H2↑0902铝与四氧化三铁在⾼温条件下的反应(化)8Al+3Fe3O44Al2O3+9Fe0903氧化铝与氢氧化钠溶液反应(离)Al 2O 3+2OH -===2AlO -2+H 2O 或Al 2O 3+2OH -+3H 2O===2[Al(OH)4]- 0904实验室中氢氧化铝的制备(离) Al 3++3NH 3·H 2O===Al(OH)3↓+3NH +40905氯化铝溶液与过量氢氧化钠溶液反应(离) Al 3++4OH -===[Al(OH)4]-0906向四羟基合铝酸钠溶液中通⼊过量⼆氧化碳⽓体(离) [Al(OH)4]-+CO 2===Al(OH)3↓+HCO 3- 0907氢氧化铝的受热分解(化) 2Al(OH)3=====△Al 2O 3+3H 2O 0908⼯业上铝的冶炼(化)2Al 2O 34Al+3O 2↑⼗、铜元素及其化合物 1.价类⼆维图2.核⼼物质的性质3.重要化学⽅程式的书写 1001铜与浓硫酸的反应(化)Cu +2H 2SO 4(浓)=====△CuSO 4+SO 2↑+2H 2O 1002铜与稀硝酸的反应(化)3Cu +8HNO 3===3Cu(NO 3)2+2NO ↑+4H 2O 1003氧化铜溶于盐酸中(离) CuO+2H +===Cu 2++H 2O 1004铜与氯化铁溶液反应(离) Cu+2Fe 3+===Cu 2++2Fe 2+1005氧化铜⾼温条件下分解(化)4CuO2Cu 2O+O 2↑1006⽓体中少量⽔的检验过程中发⽣反应(化) CuSO 4+5H 2O ===CuSO 4?5H 2O1007铜在潮湿空⽓中被腐蚀⽣成铜绿(化) 2Cu+O 2+CO 2+H 2O ===Cu 2(OH)2CO 3。

高考化学推断题综合题专题复习【镁及其化合物】专题解析及详细答案一、镁及其化合物1.硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。
从硼镁泥中提取MgSO4·7H2O的流程如下:根据题意回答下列问题:(1)实验中需用1mol/L的硫酸80mL,若用98%的浓硫酸来配制,除量筒、玻璃棒外,还需要的玻璃仪器有_________。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有_________。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式_________。
在调节pH=5-6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为________________。
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法_________。
(5)已知MgSO4、CaSO4的溶解度如下表:温度(℃)40506070MgSO430.933.435.636.9CaSO40.2100.2070.2010.193“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤_________、_________。
(6)如果提供的硼镁泥共100 g,得到的MgSO4·7H2O 196.8 g,则MgSO4·7H2O的产率为_________。
【答案】烧杯、100mL的容量瓶、胶头滴管 SiO2 Mn2++ ClO-+ H2O → MnO2↓ + 2H++ Cl-2Fe2++ ClO-+ 2H+→ 2Fe3++ Cl-+ H2O 取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+。
蒸发浓缩趁热过滤80%【解析】【详解】(1)配制溶液时还需要的玻璃仪器有烧杯、100mL的容量瓶、胶头滴管,(2)由于pH=5-6溶液呈酸性,所以滤渣中还有二氧化硅。
2020-2021高考化学镁及其化合物(大题培优易错难题)含答案解析一、镁及其化合物1.已知A为单质,B、C、D、E为化合物,它们之间存在如下转化关系:(1)若A为非金属单质,B为镁条在空气中燃烧的产物之一,其与水反应可生成气体C,D为无色气体,在空气中可变成红棕色,C与HCl气体反应生成E时产生大量白烟,则B 的化学式为,由C转化为D的化学方程式为,上述反应中属于氧化还原反应的有。
(2)若A为生活中常见的金属单质,B为A与盐酸反应的产物,C可通过单质间的化合反应制得,加热蒸干并灼烧C的溶液可得到红棕色的D,将C滴入沸水中可得E的胶体,则由B转化为C的离子方程式为,加热蒸干并灼烧C的溶液可得D的原因是。
【答案】(1)Mg3N24NH3+ 5O2 4NO +6H2O ①②③⑤(2)2Fe2++Cl2= 2Fe3++2Cl-FeCl3水解吸热,且水解产物HCl易挥发,从而彻底水解生成Fe(OH)3,灼烧时分解生成Fe2O3。
【解析】试题分析:(1)镁条在空气中燃烧的主要产物有氧化镁和氮化镁,因B可与水反应生成气体C,所以A为N2,B为Mg3N2,C为NH3,D在空气中由无色变红棕色,故D为NO,NH3与HCl气体反应生成NH4Cl时产生大量白烟,所以E为NH4Cl。
根据反应过程中是否存在元素化合价变化,可判断出氧化还原反应有①②③⑤。
(2)由C可通过单质间的化合反应制得,加热蒸干并灼烧C的溶液可得到红棕色的D,且B为A与盐酸反应的产物,可判断A为Fe,B为FeCl2,C为FeCl3,D为Fe2O3,E为Fe(OH)3。
考点:元素化合物2.已知X溶液有如图所示转化关系:(1)根据上述转化关系,写出下列物质的化学式:X_____、Y_______、Z________、试剂甲________,试剂乙__________。
(2)写出上述各步反应①~④的离子方程式:①__________________________________;②____________________________;③___________________________________;④_____________________________。
金属及其化合物之间的相互转化(尽量写出下列转化的化学方程式或离子方程式) (1)钠及其化合物(2)镁、铝及其化合物(3)铁、铜、银及其化合物Na Na 2S NaOH Na 2CO 3 NaHCO 3 CO 2 H 2O ①△②OH -CO 2 Ca(OH)2 H 2O SNa 2O 2 H 2O O 2点燃 CO 2C 2H 5ONa NaCl C 2H 5OH 电解水溶液HCl △ Mg MgOMgCO 3 Mg(OH)2 MgCl 2MgSO 4 H 2SO 4 H 2SO 4 H 2SO 4 电解 沸水HClNaOH Ca(OH)2H 2O 煅烧 ①O 2点燃 ②CO 2点燃 Cl 2 Fe FeO H 2SO 4 Cl 2 FeFeCl 2 FeS FeSO 4 Fe 2O 3 FeCl 3Fe(SCN)3 Fe(OH)3 Fe(OH)2 Fe 3O 4 H 2SO 4 H 2SO 4H 2SO 4 HCl NaOH HCl NaOH C O 2 Al H 2O C O 2 AlCO O 2 O 2 H 2O△S △ KSCN Al Al 2O 3 NaAlO 2AlCl 3 Al(OH)3 ①O 2点燃②Fe 2O 3高温电解 NaOH NaOHNaOH NaOH 、NH 3·H 2O HCl HCl HClHCl 、CO 2 △H 2SO 4 △ NaOHFeFe HNO 3Cu H 2SO 4△HNO 3 CuO Cu(OH)2Cu 2OCu(NO 3)2CuSO 4Cu 2S CuSH 2S浓H 2SO 4S 点燃O 2 △CO △ HNO 3 高温 RCHO 水浴加热 AgOHNa 2SS △FeAgAgNO 3Ag 2SAg(NH 3)2OHRCHO 水浴加热Ag 2CO 3AgI AgBr AgClH 2SHNO 3 HNO 3 NH 3·H 2O NH 3·H 2OHCl硅及其化合物之间的相互转化关系氯气及其化合物相互转化关系Cl2PCl 3、PClO 2②点燃NaClAgClNaOH光照3硫及其化合物相互转化关系H3Na SO 4223H 22SO 4O ,燃烧2NaOHO 2BaCl 2H 2O2氮及其化合物相互转化关系NH 4N NO 3243N 23·H 2ONH 4+ OH +H 2,催化剂高温 高压O 2 , 放电2O 2浓H 2SO 4△①浓酸,Cu ②见光或△③C点燃2O。
聊聊镁和它的那些“小伙伴”——镁化合物
嘿,朋友们,今天咱们来聊聊一个听起来挺高端,其实跟咱们生活息息相关的东西——镁,还有它的那些“小伙伴”,也就是镁的化合物们。
镁啊,你可别小看它,虽然它在元素周期表里不起眼,但在咱们的世界里,那可是扮演着举足轻重的角色呢!
首先说说镁本身吧。
镁,它是个银白色的金属,轻飘飘的,放在手里感觉就像拿着一块小云朵。
不过,别看它轻,它的作用可大了去了。
在咱们的身体里,镁可是个重要的矿物质,参与了好多生物化学反应,帮助咱们维持心脏健康、调节神经肌肉功能,还跟骨骼健康有着密切的关系呢。
所以啊,平时多吃点儿富含镁的食物,比如坚果、绿叶蔬菜啥的,对身体可是大有裨益的。
再来说说镁的化合物吧。
这些家伙啊,简直就是镁的“变形金刚”,各有各的本事。
比如氧化镁,它是一种白色的粉末,别看它不起眼,但它可是个优秀的耐火材料,能在高温下保持稳定,保护咱们的设备不被烧坏。
还有氢氧化镁,它是一种碱性的化合物,可以用来中和胃酸,缓解胃痛。
再来说说硫酸镁吧,这家伙在医学上可是个宝,能用来治疗便秘、缓解痉挛,还能作为导泻剂使用呢。
除了这些常见的镁化合物外啊,还有很多其他的种类呢。
它们在不同的领域里发挥着各自的作用,比如工业上用
来制造合金、催化剂;农业上作为肥料、杀虫剂;甚至在环保领域里也有它们的身影呢!
所以啊朋友们啊看到没镁和它的化合物们虽然听起来高大上但其实跟咱们的生活是紧密相连的。
它们默默地在背后支持着咱们的生活和工作让咱们的世界变得更加美好和便利。
所以啊咱们可得好好珍惜和利用它们哦!。
1.镁及其化合物转化关系2.铝及其化合物转化关系氢氧化铝的两性 H2O+ AlO-2+H+Al(OH)3Al3++3OH-(酸式电离) (碱式电离) 3.Al3+、Al(OH)3、AlO-2之间的转化关系Al 3++--23AlO +6H 2O 4Al(OH)3↓ Al 3+只能存在于酸性溶液中,AlO -2只能存在碱性溶液中,若将两种溶液混和且适量将全部生成Al(OH)3沉淀.4.Al(OH)3的制备:①用弱碱氨水与可溶性铝盐反应.Al 3++3NH 3·H 2O Al(OH)3↓+3NH +4.②用可溶性偏铝酸盐与CO 2反应:AlO -2+2H 2O+CO 2(过量)Al(OH)3↓+--3HCO 2AlO -2+3H 2O+CO 2(少量) Al(OH)3↓+--23CO例1 把等质量的金属镁分别放在①纯氧气(O 2)中②二氧化碳气体中 ③空气中,完全燃烧后,得到的固体物质的质量分别对应的是w 1g ,w 2g 和w 3g.以三者的关系正确的是( ) DA.w 1>w 2>w 3B.w 3>w 1>w 2C.w 3>w 2>w 1D.w 2>w 1>w 3例3:将一块10gMg 和Al 的合金完全溶解于500ml4mol/L 的盐酸中,再往所得溶液中加入多少毫升8mol/L 的NaOH 溶液,得到的沉淀最多? (250ml )分析:本题旨在考查读者思维的灵活性.分析题中反应过程:铝热反应(1)定义:Al+Mx O y M+Al 2O 3 +铝热剂 引发反应发生 特点使高熔点金属熔化(2)原因: ①Al 的强还原性②Al 的亲氧性强(3)应用: ①冶炼高熔点金属(如Fe 、Cr 、V 、Mn 等)②焊接金属。
高温《铝及其化合物》练习题1. 某无色透明溶液能与铝作用放出氢气, 此溶液中一定能大量共存的离子组是()A. Cl-、SO42-、Na+、K+B. K+、ClO-、Na+、NO3-C. HCO3-、Na+、NO3-、K+D. NO3-、Ba2+、Cl-、NH4+2. 两份铝屑,第一份与过量的盐酸反应,第二份与过量的NaOH溶液反应,产生氢气的体积比为1:2,则第一份与第二份铝屑的质量比为()A、1:1B、1:2C、1:3D、1:43. 能用铝为原料来冶炼难熔的金属主要是因为()A.铝的密度小, 熔点较低B.铝在空气中燃烧, 放出大量的热C.铝在金属活动性顺序表排在较前面D.铝具有还原性.发生氧化还原反应时放出大量的热4. 将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是()A.稀硝酸B.稀盐酸C.硝酸铜D.氢氧化钠5. 由锌、铁、镁、铝四种金属中的两种组成的混合物10g,与足量的盐酸反应生成的氢气在标准状况下为11.2L,则混合物中一定含有的金属是()A.锌B.铁C.铝D.镁6. 下列用途主要是体现铝的物理性质的是()①家用铝锅②盛浓硝酸的容器③制导线④焊接钢轨⑤包装铝箔⑥炼钢的脱氧剂⑦做防锈油漆⑧做合金用作飞机制造业材料⑨工业做热交换器A.①②③④B.③④⑥⑦⑧⑨C.①③⑤⑦⑧⑨D.①③②④⑥⑧7. 有关Al与NaOH溶液的反应的说法中,正确的是 ( )A.铝是还原剂,其氧化产物是Al(OH)3B.NaOH是氧化剂,其还原产物是H2C.铝是还原剂,H2O和NaOH都是氧化剂D.H2O是氧化剂,Al被氧化8. 向某溶液中投入铝片后有大量H2放出,则溶液中不可能大量存在的离子是( )A.Cl-B.H+C.OH-D.HCO-39. 向NaAlO2溶液中持续通入一种气体,开始时产生沉淀,随后沉淀又逐渐溶解,该气是()A.NO2B.CO2C.NH3D.CO10. 镁、铝、铜三种金属粉末混合物, 加入过量盐酸充分反应, 过滤后向滤液中加入过量烧碱溶液, 再过滤, 滤液中存在的离子有() B.Cu2+ C.Al3+D.Mg2+A.AlO211.常温下能用铝制容器盛放的是()A.浓盐酸B.浓硝酸C.稀硝酸D.稀硫酸12.下列所用的材料不属于合金的是()A.家用的铝窗B.建筑用的钢筋C.铸造用的黄铜D.温度计用的水银13.将一块镁铝合金溶于盐酸后,再加入过量NaOH溶液,所得的溶液中主要存在的离子是()A. AlO2-、OH-、Na+、Cl-B. Na+、OH-、Al3+、Cl-C. AlO2-、OH-、Mg2+、Cl-D. Na+、Mg2+、Al3+、Cl-14.下列有关合金的说法,错误的是()A.青铜是人类历史上使用最早的合金,至今已有三千多年的历史B.世界上最常见的,用量最大的合金是钢C.合金的硬度一般比它的各成分金属的小,熔点一般也比它的各成分金属的高D.合金可以由金属和非金属融合而成16. 下列关于Al(OH)3的性质的叙述错误的是()A. Al(OH)3是难溶于水的白色沉淀B. Al(OH)3能吸附水中的悬浮物C. Al(OH)3能溶于氨水D. Al(OH)3属于两性氢氧化物17.既能与NaOH溶液反应,又能与H2SO4溶液反应的物质是()A.NaHCO3B.Al(OH)3C.NaHSO4D.Na2CO318.在使溶液中的AlO2-完全转化成Al(OH)3,应选择的最好试剂是()A.H 2SO4B.HClC.CO2D.NH3·H2O。