江苏省九年级化学 第三章 第二节 构成物质的基本微粒(第一课时)教案 沪教版
- 格式:doc
- 大小:91.50 KB
- 文档页数:4

第三章物质构成的奥秘
第二节构成物质的基本微粒
教学过程
一、相对原子质量
1、是个比值,单位是1
2、以碳原子质量的1/12为标准
(讲解概念:以一种碳原子的质量的1/12作为基准,其它原子的质量与之一基准值的比值,称为这种原子的相对原子质量)
过渡:分子是由原子构成的,我们可以用相对分子质量表示分子质量的大小
二、相对分子质量
相对分子质量等于构成分子的各原子的相对原子质量的综合
讲解计算方法
演示例题
引导练习、展示题板,指引个别学生到黑板板书,评价总结注意事项
三、离子
6.指导学习
【设疑】根据上节课所学知识(教师画出Na和Cl原子的结构示意图),并请讨论这两种原子在化学反应中电子可能的转移方式。
【问题】元素的原子失去最外层电子或得到电子后,是否呈电中性?
【讲解】化学上我们把这种带电的原子就称为离子,下面我们通过视频和动画来看一下,原子在什么情况下、又是如何转变成离子的。
【讲解】原子得失电子后形成的离子分别带上负电荷和正电荷,我们把带正电荷的离子称为阳离子;把带负电荷的离子称为阴离子。
【讲解】为了方便我们在元素符号的右上角写上离子所带的电荷数及所带电荷的正负来表示离子。
例如:镁原子最外层电子数为2,失2个电子后带2个单位的正电荷,所以镁离子的符号为Mg2+。
氧原子最外电子层电子数为6,得2个电子后,带2个单位得负电荷,所以氧离子符号为O2-。
【问题】铝离子,镁离子,硫离子,氯离子的符号如何写?
教学意图:知道原子得失电子会变成离子认识一些常见原子的结构示意图、离子符号、离子结构示意图。



第三章第二节构成物质的基本微粒【学习目标】1、知道分子、原子、离子都是构成物质的微粒。
2、知道在化学反应中分子可以分解为原子,原子可以结合成分子,原子和离子通过得失电子可以相互转化。
3、知道原子是由原子核和核外电子构成的。
4、能根据相对原子质量求算相对分子质量。
5、初步认识物质结构学习中的模型方法。
6、建立物质无限可分的观点。
【知识结构】1、开门见山,说明构成物质的微粒有原子、离子和分子,并出示彩图,分别介绍由分子、原子、离子构成的物质和它们的结构。
2、由实验现象的微观图示,物质结构的示意图,真实的分子、原子图像、化学发展史料等,让学生认识分子、原子、离子的特殊性质和它们的区别、联系以及原子的结构等。
3、由原子的质量描述极不方便,引入相对原子质量和相对分子质量,为有关化学式计算打下基础。
【重点难点】1、认识构成物质的粒子有分子、原子、离子。
知道分子、原子、离子的不同和相互关系。
2、知道原子的结构,建立物质无限可分的观点。
3、能正确求算相对分子质量。
【基本设想】第1课时分子、原子分子、原子内容比较抽象,尽可能利用多媒体课件,将化学变化中分子、原子的行为生动直观地表现出来,或者用球棍模型展示水分子、二氧化碳分子、金刚石、氯化钠的结构等,让学生感受分子、原子、离子的真实存在。
第2课时原子的构成、离子由汤姆生发现电子和卢瑟福用α粒子轰击金箔的实验现象,联想与启示。
让学生通过讨论、交流得出原子的构成。
第3课时原子的质量建议将相对原子质量的计算过程由学生一步一步演算出来,这更利于学生理解,如m(碳)=1.993X10-26Kg,m(氧)=2.657X10-26Kg,m(碳)/12=1.993X10-26Kg/12= 1.66X10-27Kg,氧的相对原子质量= 1.993X10-26Kg/1.66X10-27Kg=16。
再求一下钠、铝的相对原子质量,巩固概念,通过练习让学生熟练掌握。
【教学过程】第1课时分子、原子〖引入〗投影展示干冰、金属铜、氯化钠、金刚石等物质的微粒构成示意图。

第一节构成物质的根本微粒第一课时教学目标:知识与技能:〔1〕知道微粒的性质以及分子、原子、离子都是构成物质的根本微粒。
〔2〕知道在化学反响中分子可以分成原子,原子可以结合成分子。
〔3〕是学生认识到分子、原子、离子存在的真实性。
过程与方法:〔1〕积极主动与他人进展交流和讨论,清楚的表达自己的观点。
〔2〕提出问题,进展初步的科学研究。
情感态度与价值观:〔1〕初步建立物质无限可分的观点。
〔2〕提高学生的想象能力、创新能力。
学习重难点:1、知道分子、原子、离子都是构成物质的微粒。
2、知道在化学反响中分子可以分成原子,原子可以结合成分子。
学习重难点:在实验中建立分子、原子、粒子在化学变化重的形象,完成对化学变化宏观现象中的微观解释。
课前准备教师:1、不同微粒构成的物质。
2、氢气、氧气、水的性质实验。
学生:在日常生活中,感受到分子真实存在的例子。
教学过程:一.微粒的性质【引入】有句俗语叫酒香不怕巷子深,意思是如果酒酿得好,就是在很深的巷子里,也会有人闻香知味,前来品尝。
那大家有没有思考过,为什么我们能闻到酒的闻到,为什么我们平时能闻到花香,闻到香水味?这节课我们就来解答下这些问题我们知道世界是由物质组成的,那物质又是由什么组成的呢?【学生】微粒【教师】对了,物质是由我们肉眼看不到的微粒组成的,说明微粒都很小,但是微粒有一定的质量【板书】一、微粒的性质1、微粒都非常小,但有一定质量这些微粒是我们下面几节课要学习的分子、原子和离子。
为什么我们能闻到各种味道,为什么能远远的闻到花香?【分析】因为构成酒和花的微粒,扩散到了空气中,接触到了我们的嗅觉器官,所以我们闻到了闻到,通过这个分析我们可以推测构成物质的微粒能运动,那是不是真的能运动呢,我们通过一个实验来检验下【实验】探究微粒运动实验【现象】1、甲是无色溶液,参加酚酞后,变成了红色溶液2、甲溶液变红【分析】这里我们来了解下酚酞溶液,酚酞和我们学过的紫色石蕊试剂一样,是一种酸碱指示剂,酚酞遇到酸变色,遇到碱变红色,可以用于检验溶液是否显碱性,以后酚酞以后我们还会接触到,这里的氨水是显碱性的,所以在酚酞中参加氨水以后,溶液会变红【提问】实验1中我们参加了氨水,溶液显碱性了,所以溶液变红,那实验二中的甲溶液为什么变红呢?【学生】变红证明溶液显碱性,说明B中的氨气微粒跑到了装有酚酞的A 的烧杯中,这说明了微粒能运动【教师】上述的实验说明了构成物质的微粒是不断运动的【板书】2、微粒是不断运动的【提问】晒衣服的时候,为什么太阳大衣服比拟容易干?糖水为什么温度高的时候比拟容易溶解?【分析】温度越高,微粒运动的越快【提问】水有三态,但都是水这种物质,大家知道水为什么有三态吗?我们也听说过热胀冷缩,你能解释这是为什么吗?【教师】要解释这个现象,我们先来看下下面这个实验【实验】水与酒精混合实验【现象】1、把玻璃管颠倒数次以后,玻璃管内出现了间隙【分析】这是因为微粒之间有间隙,当玻璃管颠倒数次之后,酒精微粒和红墨水微粒会相互占据微粒之间的间隙,所以最后体积缩小〔酒精微粒比拟大,水的比拟小,可以画模型表示,大球和大球之间的间隙可以塞下一个小球〕【板书】3、微粒之间有间隙【提问】那是不是所有的物质微粒的的间隙都一样大呢?【学生】不是,在固体,液体间的间隙比拟小,气体的间隙比拟大,物质存在三态的原因是因为微粒间的间隙不一样【教师】那是不是这样的呢,我们通过实验来验证下【实验2】水和空气的压缩实验【现象】吸有空气的的那支注射器比拟容易被压缩【分析】这说明气体微粒间的间隙比拟大,所以容易被压缩,那压缩前后的气体,哪种间隙比拟大?【学生】压缩前的【教师】压缩后气体间的压强比拟大,间隙比拟小,说明气体的微粒间间隙和压强有关,压强越大微粒间的间隙越小【提问】物体热胀冷缩,这是大家在物理里面学到的原理,大家能说明为什么吗?【学生】跟物体微粒间的间隙有关,间隙大了,物体的体积就大了,所以热胀说明温度升高,微粒间的间隙会变大【总结】这节课学习了微粒的特性,第一是微粒在不断的运动,第二是微粒之间有间隙,现在大家做几道题目1.为什么夏天给自行车打气不应打太满2.为什么铁路上的铁轨之间应稍留缝隙【教师】经科学家研究,构成物质的微粒有分子,原子和离子,有些物质由分子构成,如干冰、水、氮气等,有些物质由原子构成,如金刚石和一些常见的金属物质还有稀有气体。
第二节构成物质的基本微粒学习目标:认知目标:1.知道分子、原子、离子都是构成物质的微粒;2.知道在化学反应中分子可以分解为原子,原子可以结合成分子,原子和离子通过得失电子可以相互转换;3.知道原子是由原子核和核外电子构成的能力目标:1.初步学会根据实验现象,来推导原子的组成2.能够根据相对原子质量求算相对分子质量情感目标:逐步建立物质无限可分的观点教学重点:1.从微观角度来理解化学反应的本质;2.相对质量的计算3.原子的构成探究实验:通过虚拟实验来探究原子的结构教学过程:引入:物质都是由肉眼看不见的,极其微小的微粒构成的。
不同的物质由不同的微粒构成的,那么我这个物质世界构成的微粒主要有原子(atom)、离子(ion)和分子(molecule)等。
介绍:如氧气、氢气、二氧化碳、红磷、氯化氢、味精、蔗糖等都是由分子构成的;铜、铁、镁、金刚石等都是有原子直接构成的;氯化钠、氢氧化钙、碳酸钙等是由离子构成的。
我们人类也是有很多细胞构成的,而细胞则是由许多蛋白质分子构成的。
一、分子和原子共同点:1.分子和原子都能直接构成物质2.分子和原子都是微粒(1)质量小,体积小18g ×1023个水分子,每个水分子质量大约为3×10-23g 。
一滴水与一个水分子比较就相当于是一个地球和一个乒乓球的体积比(2)分子和原子都在不断的运动(3)分子和原子之间都有间隙3.分子和原子都能保持物质的化学性质(1)由分子构成的物质,分子能保持其化学性质(2)由原子构成的物质,原子能保持其化学性质观察:P63页,对分子和原子的表观上的了解分析:水通电电解的微观分析水是由大量的水分子聚集而成的,水分子在直流电场的作用下,被解离出氧原子和氢原子,每两个氧原子形成一个氧分子,每两个氢原子形成一个氢分子,大量的氧分子聚集成氧气,大量的氢分子聚集成氢气,所以在宏观的角度来看,我们认识到水发生化学反应生成氧气和氢气。
总结:化学反应的本质是原子间的重新组合,分子在化学变化过程中能分为原子,各原子经过重新组合又能形成新的分子,即发生了化学变化。
化学初三沪教版第三章第二节组成物质的基本微粒(第一课时)教课设计教课目的:知识与技术:〔1〕知道分子、原子、离子都是组成物质的基本微粒。
〔2〕知道在化学反响中分子能够分红原子,原子能够联合成分子。
〔3〕是学生认识到分子、原子、离子存在的真切性。
过程与方法:〔1〕踊跃主动与别人进行沟通和议论,清楚的表达自己的看法。
〔2〕提出问题,进行初步的科学研究。
感情态度与价值观:〔1〕初步成立物质无穷可分的看法。
〔2〕提升学生的想象能力、创新能力。
学习重难点:1、知道分子、原子、离子都是组成物质的微粒。
2、知道在化学反响中分子能够分红原子,原子能够联合成分子。
学习重难点:在实验中成立分子、原子、粒子在化学变化重的形象,达成对化学变化宏观现象中的微观解说。
课前准备教师: 1、大屏幕;不一样微粒组成的物质。
2、氢气、氧气、水的性质实验。
学生:在平时生活中,感觉到分子真切存在的例子。
教课过程:教课环节教师调控学生活动设计企图创建情形引入新课,组成物质的基本微粒有哪些呢?分子、原子、离子是组成物质的三种微粒。
物质拥有不一样的性质,是因为组成物质的微粒不一样造成的。
大屏幕演示:不一样微粒组成的物质创建情形:你能举例说明组成物质的三种微粒是什么?创建情形:1、演示氢气、氧气、水的性质的实验。
观看思虑、沟通、议论观看这样的引课比较有趣,极大的激发了学生的学习兴趣,使学生对分子、原子、离子组成的物质又很深的印象。
创建这个问题,让学生知道不一样物质由不一样微粒组成。
经过实验能够调换学生的踊跃性。
在化学变化中,分2、为何氧气、氢子分红原子,原子气、水的性质不一样不行再分。
呢?学生谈感想创建情形:1 、我们学过水通电生成氢气和氧气,你能有分子原子的观点解说这个化学变化吗?2、投影水分解过程的微观解说。
3 、在上述过程中,发生变化的是什么?不变的又是什么?你有什么收获?思虑、沟通、议论沟通与议论观看投影。
思虑回答以下问题。
谈收获经过沟通与议论,是学生在沟通中相互学习,相互帮助,并能够清楚的表达自己的看法。
3.1 构成物质的基本微粒教学目标1、知道物质是由微粒构成的,微粒处于不断运动中,微粒之间存在空隙。
2、能用微粒的观点解释某些常见现象。
重难点能用微粒的观点解释某些常见现象。
教学过程原子的结构任务:合作探究谁通过α粒子散射实验(轰击金箔实验)进一步探究了原子的结构?原子由原子核和电子构成,原子核在原子中所占体积最小,但却几乎集中了原子的全部质量.规律总结(1)气体微粒间的间隔大于固体、液体微粒间的间隔,所以气体物质往往较容易被压缩,固体和液体物质不易被压缩。
(2)同一物质,随着三态的变化,微粒间的间隔也发生变化。
(3)热胀冷缩的现象是因为构成物质的微粒之间的间隔受热时增大,遇冷时减小,而微粒本身并没有改变。
构成物质的微粒构成物质的微粒有:分子、原子、离子。
1. 由分子构成的物质:如氧气、水、干冰等。
2. 由原子直接构成的物质:如金属、稀有气体、金刚石等。
3. 由离子直接构成的物质:如氯化钠由氯离子和钠离子构成。
原子结构示意图(直观清晰的表示原子结构):圆圈表示,11表示,+表示,弧线表示,弧线上的数字2、8、1分别表示。
原子结构示意图画法:画圆圈,标质子,弧线呈扇面,数字一条线。
核外电子的排布规律:⑴第一层最多排2个e ;第二层最多排8个e;⑵次外层最多排8个e(第一层为最外层则最多排2个e);⑶据能量最低原理,先排满第一层,再排第二层,依次向外。
分子、原子的区别与联系区别:在化学变化中分子可分,而原子不可分。
联系:(1)分子和原子都可以直接构成物质。
(2)分子是由原子构成的,同一种原子可以构成不同的分子,如氧原子可以构成氧分子(O2),也可构成臭氧分子(O3)。
原子的构成原子是由带正电荷的原子核和带负电荷的核外电子构成的,原子核又由质子(每个质子带1个单位的正电荷)和中子(不带电)构成,且每个中子的质量和每个质子的质量几乎相等。
原子的结构:相对分子质量(Mr)已知:H:1、O:16、C:12那么,CO2 、H2O 的相对分子质量是多少呢?核外电子的分层排布1. 核外电子绕核不停地做高速运动。
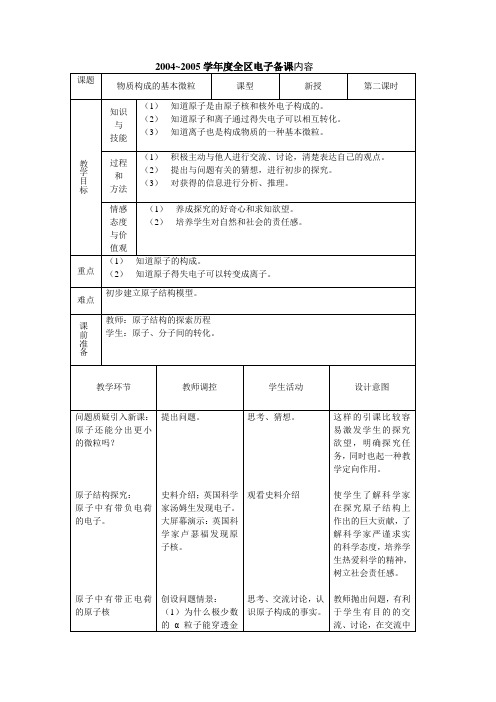
第二节构成物质的基本微粒(第一课时)
教学目标:
知识与技能:
(1)知道分子、原子、离子都是构成物质的基本微粒。
(2)知道在化学反应中分子可以分成原子,原子可以结合成分子。
(3)是学生认识到分子、原子、离子存在的真实性。
过程与方法:
(1)积极主动与他人进行交流和讨论,清楚的表达自己的观点。
(2)提出问题,进行初步的科学研究。
情感态度与价值观:
(1)初步建立物质无限可分的观点。
(2)提高学生的想象能力、创新能力。
学习重难点:
1、知道分子、原子、离子都是构成物质的微粒。
2、知道在化学反应中分子可以分成原子,原子可以结合成分子。
学习重难点:
在实验中建立分子、原子、粒子在化学变化重的形象,完成对化学变化宏观现象中的微观解释。
课前准备
教师:1、大屏幕;不同微粒构成的物质。
2、氢气、氧气、水的性质实验。
学生:在日常生活中,感受到分子真实存在的例子。
教学过程:
在化学变化中,分子分成原子,原子不可再分。
学生谈感想2、为什么氧气、氢
气、水的性质不同
呢?
创设情景:
1、我们学过水通电
生成氢气和氧气,你
能有分子原子的观
点解释这个化学变
化吗?
2、投影
水分解过程的微观
解释。
3、在上述过程中,
发生变化的是什
么?不变的又是什
么?
你有什么收获?
思考、交流、讨论
交流与讨论
观看投影。
思考回答问题。
谈收获
通过交流与讨论,是
学生在交流中互相
学习,互相帮助,并
能够清楚的表达自
己的观点。
是不同层
次的学生在交流中
都有收获。
通过交流与讨论,是
学生从宏观物质走
进微观世界,提高
学生的想象力和创
新精神。
使学生在认识分子、
原子的基础上解释
化学反应的原因,是
学生从微观角度巩
固和加深对化学变
化的理解。
通过交流和讨论,是
学生明确化学变化
的本质,明确分子、
原子的本质区别。
小 结
1、知道分子、原子、离子都是构成物质的基本微粒。
2、知道在化学反应中分子可以分成原子,原子可以结合成分子。
3、在实验中建立分子、原子、粒子在化学变化重的形象,完成对化学变化宏观现象中的微观解释。
板书设计:
一、分子、原子、离子是构成物质的三种微粒。
分子和原子共同点:
1.分子和原子都能直接构成物质
2.分子和原子都是微粒
(1)质量小,体积小
(2)分子和原子都在不断的运动
(3)分子和原子之间都有间隙
3.分子和原子都能保持物质的化学性质
(1)由分子构成的物质,分子能保持其化学性质
(2)由原子构成的物质,原子能保持其化学性质
二、化学变化中,分子分成原子,原子不可再分。
分子−−−→−分解形成 原子 −−−→−重新组合 新分子。