专题13 构成物质的基本粒子 元素
- 格式:ppt
- 大小:1.60 MB
- 文档页数:26







构成物质的微粒有哪些
构成物质的微粒包括原子、分子和离子。
这些微粒是物质的基本组成单位,根据物质的性质和化学结构的不同,它们可以以不同的方式组合和排列。
1. 原子:原子是构成物质的最基本的微粒,是化学元素的基本单位。
每种元素都由一种特定类型的原子组成,其化学性质由其原子的结构和排列决定。
2. 分子:分子是由两个或更多个原子以共价键相连形成的结构单元。
分子可以是同一种元素的原子组成的,也可以是不同元素的原子组成的化合物。
例如,氧气分子(O2)由两个氧原子以共价键连接形成。
3. 离子:离子是由失去或获得一个或多个电子而带有电荷的原子或分子。
正离子是失去了一个或多个电子的,带有正电荷;负离子是获得了一个或多个电子的,带有负电荷。
离子通过离子键相互吸引形成化合物,如氯化钠(NaCl)中的钠离子和氯离子。
这些微粒以不同的方式组合和排列形成各种不同类型的物质,如元素、化合物和混合物。
对于理解物质的性质和行为,以及化学反应的机理和速率等方面都至关重要。
1/ 1。



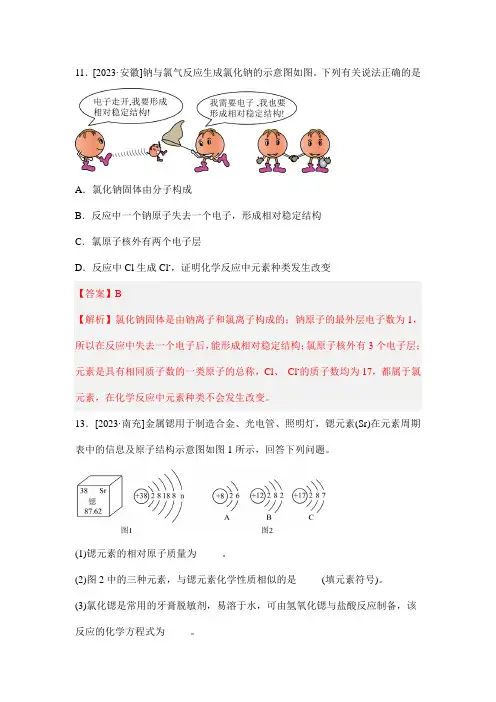
11.[2023·安徽]钠与氯气反应生成氯化钠的示意图如图。
下列有关说法正确的是A.氯化钠固体由分子构成B.反应中一个钠原子失去一个电子,形成相对稳定结构C.氯原子核外有两个电子层D.反应中Cl生成Cl-,证明化学反应中元素种类发生改变【答案】B【解析】氯化钠固体是由钠离子和氯离子构成的;钠原子的最外层电子数为1,所以在反应中失去一个电子后,能形成相对稳定结构;氯原子核外有3个电子层;元素是具有相同质子数的一类原子的总称,Cl、Cl-的质子数均为17,都属于氯元素,在化学反应中元素种类不会发生改变。
13.[2023·南充]金属锶用于制造合金、光电管、照明灯,锶元素(Sr)在元素周期表中的信息及原子结构示意图如图1所示,回答下列问题。
(1)锶元素的相对原子质量为_____。
(2)图2中的三种元素,与锶元素化学性质相似的是_____(填元素符号)。
(3)氯化锶是常用的牙膏脱敏剂,易溶于水,可由氢氧化锶与盐酸反应制备,该反应的化学方程式为_____。
【答案】(1)87.62(2)Mg(3)Sr(OH)2+2HCl=== SrCl2+2H2O【解析】(1)由锶在元素周期表中的信息可知,锶元素的相对原子质量为87.62。
(2)在原子中,质子数=核外电子数,n=38-2-8-18-8=2,锶原子最外层电子数是2,最外层电子数相等则化学性质相似,故图乙中与锶元素化学性质相似的是B 所示原子,其质子数为12,是镁元素,符号为Mg。
(3)锶原子最外层电子数是2,易失去最外层2个电子形成锶离子,则锶离子带2个单位正电荷,氯化锶的化学式为SrCl2,氢氧化锶与盐酸反应生成氯化锶和水,化学方程式Sr(OH)2+2HCl=== SrCl2+2H2O。
17.[2023·自贡]在宏观、微观和符号之间建立联系是学习化学的重要思维方式。
(1)从宏观角度分析,氧气是由氧_____(填“元素”或“原子”)组成的。
培优专题讲解《构成物质的基本粒子——分子、原子和离子》构成物质的基本粒子——分子、原子和离子【赛点图解】【技法透析】1.如何理解分子的定义分子是保持物质化学性质的最小粒子。
理解该定义要注意以下四点:(1)“保持”是指构成物质的每个分子的化学性质与该物质的化学性质完全相同,如氧分子保持氧气的化学性质;(2)分子保持的是物质的化学性质而不是物质的物理性质。
因为物理性质是物质大量分子聚集所表现的属性,是宏观的,故单个分子是不能表现物理性质的。
(3)保持物质化学性质的粒子除了分子外,还有其它粒子。
如:汞是由汞原子直接构成的,汞的化学性质是由汞原子保持着。
(4)同种物质的分子化学性质相同,不同物质的分子化学性质不同。
2.如何理解原子的定义?原子是化学变化中的最小的粒子,理解该定义要注意以下三点:(1)“最小”意及“不可分”,故原子又可定义为:原子是化学变化中不可分的粒子或原子是用化学方法不可分的粒子。
(2)“最小”、“不可分”是有条件的,即“在化学变化中”这个条件,也就是说:原子的“最小”和“不可分”是相对于化学变化而言的,因为从结构上看,原子可分成原子核和核外电子。
(3)原子在化学反应中不可分,不是说原子在化学反应中不发生任何变化。
在化学变化中,原子的核外电子,尤其是最外层电子数会发生变化。
3.怎样认识原子的结构(1)原子的结构(2)在原子中,由于原子核带正电,带的正电荷数(即核电荷数)与核外电子带的负电荷数(数值上等于核外电子数)相等,电性相反,所以原子不显电性。
由此得出,质子数一核电荷数一电子数。
(3)不同种类的原子,核内的质子数不相同,核外电子数也不相同。
(4)相对来说,原子里有很大的空间,电子在其中作高速运动。
(5)原子的质量主要集中在原子核上。
4.相对原子质量的计算方法(1)相对原子质量=某原子的质量碳原子质量的1/12(2)相对原子质量与原子核内微粒的关系:相对原子质量(近似值)=质子数+中子数5.如何区分原子结构示意图和离子结构示意图?(1)原子或离子结构示意图的画法:画圆圈,标核电,划弧线,中间数字一条线。
构成物质的基本粒子物质是由各种不同的基本粒子组成的。
这些基本粒子包括质子、中子、电子、中微子和反粒子等。
这些基本粒子的性质和相互作用决定了物质的性质和行为。
在本文中,我们将探讨这些基本粒子的性质和相互作用。
质子质子是构成原子核的基本粒子之一。
它的电荷为正电荷,质量为1.0072766质子质量单位。
质子的数量决定了元素的原子序数。
例如,氢原子只有一个质子,因此它的原子序数为1。
氦原子有两个质子,因此它的原子序数为2。
质子的相互作用是通过强相互作用来实现的。
强相互作用是一种非常强大的相互作用力,它可以将质子和中子紧密地结合在一起形成原子核。
强相互作用的作用范围非常短,只有原子核内部的距离才能感受到它的作用。
中子中子是构成原子核的基本粒子之一。
它的电荷为零,质量为1.0086649质子质量单位。
中子的数量决定了原子核的质量。
例如,氢原子只有一个质子和一个中子,因此它的原子核质量为2。
中子的相互作用也是通过强相互作用来实现的。
中子和质子之间的相互作用力非常强大,可以将它们结合在一起形成原子核。
中子还可以通过弱相互作用与质子发生相互作用,从而导致放射性衰变。
电子电子是负电荷的基本粒子。
它的质量非常轻,只有0.00054858质子质量单位。
电子的数量决定了原子的电荷。
例如,氢原子只有一个电子,因此它的电荷为负一。
电子的相互作用是通过电磁相互作用来实现的。
电磁相互作用是一种非常强大的相互作用力,可以将电子和原子核结合在一起形成原子。
电子还可以通过电磁相互作用与其他电子相互作用,从而导致化学反应和电子传导。
中微子中微子是一种非常轻的基本粒子,它的质量比电子还要轻得多。
中微子没有电荷,因此它们不受电磁相互作用的影响。
中微子的相互作用是通过弱相互作用来实现的。
弱相互作用是一种非常弱的相互作用力,可以导致放射性衰变和其他核反应。
反粒子反粒子是一种与基本粒子相对应的粒子,它们具有相反的电荷和相反的量子数。
例如,反质子具有负电荷和相反的质子量子数。
构成物质的基本粒⼦课题:构成的物质的基本粒⼦【学习⽬标】1、知道物质是由分⼦、原⼦和离⼦构成的,能初步判断物质组成与构成能从宏观和微观的⾓度描述物质的组成与构成;2、理解分⼦、原⼦、离⼦概念及相互联系和区别,能解释⾃然界中的⼀些化学现象;3、理解元素性质与原⼦结构的关系及元素与原⼦的区别与联系;了解原⼦结构与核外电⼦排布的初步知识。
⾃主复习1、构成物质的粒⼦、、。
2、分⼦是;原⼦是;离⼦是。
3、分⼦和原⼦的区别是;联系是。
4、原⼦是由构成的,原⼦核通常是构成的。
5、在元素周期表中,原⼦序数等于。
6、在原⼦中,数 == 数 == 数。
7、在离⼦中,离⼦的电荷数 == 数—数;在阳离⼦中,质⼦数== 数 + 数;在阴离⼦中,质⼦数 == 数 - 数。
8、相对原⼦质量≈数 + 数。
9、元素的种类是由数或数决定的,元素的化学性质主要是由原⼦结构中的数决定的。
本节归纳:请同学们归纳出我们学过的常见物质类别它们由哪种微粒构成:原⼦:分⼦:离⼦:合作探究1`、如图所⽰,把充满红棕⾊⼆氧化氮⽓体和⽆⾊氢⽓的集⽓瓶中间玻璃⽚抽⾛,使两瓶⼝密合在⼀起(不要振荡),可观察到A中两瓶⽓体的颜⾊很快趋于⼀致(两者不反应),⽽B中需要长时间才能达到同样的效果。
观察对⽐实验现象,由此可得到那些结论?【巩固练习】1、保持氢⽓化学性质的粒⼦是()A、HB、H20C、H2D、2H2、有⼈通过闻茶的⽅法就能判断出茶的产地。
⼈们能够闻到茶⾹的原因是()A.分⼦之间有间隔 B.分⼦在不断运动C.分⼦的质量和体积都很⼩ D.分⼦是由原⼦构成的3、下列结构⽰意图所表⽰的粒⼦属于稀有⽓体元素的是()4、下列原⼦结构⽰意图所表⽰的元素中,属于⾦属元素的是()5.下列四种粒⼦的结构⽰意图中,说法正确的是()①②③④A .它们表⽰四种不同的元素B .②表⽰的元素在化合物中通常显+2价C .①③④表⽰的元素都是⾮⾦属元素D .①④表⽰的是阳离⼦5、航天飞船常⽤铝粉与⾼氯酸铵(NH4ClO4)的混合物作为固体燃料,⾼氯酸铵中Cl 元素的化合价为()A .+1B .+3C .+5D .+76、1996年科学家在宇宙深处发现了 H 3 + 离⼦和H 3分⼦。