化学反应热的计算最全版
- 格式:doc
- 大小:701.50 KB
- 文档页数:8

化学反应热的计算知识点
化学反应热的计算主要涉及到几个关键知识点:
反应热的概念:化学反应的热效应,通常称为反应热,其符号为Qp。
当反应在恒压下进行时,反应热称为等压热效应。
反应热的计算公式:Qp = △U + p△V = △U + RT∑vB。
其中,△U表示反应产物的内能减去反应物的内能,p是压力,△V是反应产物的体积减去反应物的体积,R是气体常数,T 是绝对温度,∑vB(g) = △n(g)/mol,即发生1mol反应时,产物气体分子总数与反应物气体分子总数之差。
焓的定义:由于U、p、V都是状态函数,因此U+pV也是状态函数,我们将其定义为焓,符号为H。
于是,反应热可以表示为:Qp = △H = H终态- H始态。
反应热的测量与计算:反应热可以通过实验测量得到,也可以通过化学反应方程式和比热容公式进行计算。
另外,反应热与反应物各物质的物质的量成正比。
利用键能计算反应热:通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能,键能通常用E表示,单位为kJ/mol。
反应热等于反应物的键能总和与生成物键能总和之差,即△H = ΣE(反应物) - ΣE(生成物)。
由反应物和生成物的总能量计算反应热:△H = 生成物总能量- 反应物的总能量。

r m r m化学反应热效应测定一、实验目的1. 了解测定化学反应焓变的原理和方法,测定锌和硫酸铜反应的热效应;2. 练习天平、容量瓶的使用等基本操作,熟悉准确浓度溶液的配制方法;3. 掌握利用外推法校正温度改变值的作图方法。
二、实验原理化学反应通常是在等压条件下进行的,此时的反应热叫做等压反应热,常以焓变 Δr Ηθ来表示,在热化学中规定,放热反应的焓变Δr Ηθ为负值,吸热反应的焓变 Δr Ηθ为正值。
例如,锌与硫酸铜溶液的反应,是一个自发进行的反应,在 298.15K 下,每摩尔反应的CuSO 4 与 Zn 放出 216.8kJ 热量,即Zn + CuSO 4 = ZnSO 4 + Cu∆ H θ = -216,8kJ / mol放热反应焓变的测定方法很多,本实验是通过如图 3-l 所示的量热器来测定的。
测定焓变的原理是根据能量守恒定律,即反应所放出的热量促使量热器本身和反应体系温度升高,因此,由图 3-l 反应热测定装置示意图 l —橡胶塞;2—温度计;3—真空隔热层;4—保温杯外壳;5—CuSO 4 溶液溶液的比热和反应前后溶液的温度变化,可求得上述反应的焓变。
计算公式如下: ∆ r H m = -∆T ⋅ 1 ⋅ n 1 1000• (cVd + c p ) 式中∆ H θ ——反应的焓变,kJ/mol ; ΔT ——反应前后溶液温度的变化,K ;c ——溶液的比热容,实验时测定;V ——反应时所用 CuSO 4 溶液的体积(mL );d ——CuSO 4 溶液的密度,近似用水的密度 1.00g/mL 代替;n ——VmL 溶液中 CuSO 4 的物质的量;c p ——量热器等压热容,指量热器每升高一度所需的热量,J/K 。
θ本实验采用标准物质法进行量热计能当量的标定。
c p = -[m 1c p ,m (KCl ,s ) + m 2c p ,m (H 2O ,l ) + (m 1∆solH m )/(M 1∆T)] 其中: m 1 , m 2 分别为溶解过程中加入的K Cl (s )和 H 2O (l )的质量, c p ,m 为物质的恒压比热容,即单位质量的物质的等压热容,c p ,(m KC l,s )= 0.699kg /(kg • K), c p ,(m H 2O ,l )= 4.184kJ /(kg • K ), M 1 为K Cl 的摩尔质量, ∆T 为溶解前后系统温度的差值, ∆solH m 为 1mol K Cl溶解于 200 mol H 2O 的积分溶解热,其不同温度下的积分溶解热数值见附录,通过公式可以计算量热器的c p 值。



以高考题为例详解利用盖斯定律进行化学反应热的计算为了方便,这里以ΔH4=ΔH1+ΔH2+ΔH3为例说明。
对既有总反应和分步反应而言,考生未必知道哪个是总反应,哪些是分步反应。
而确定总反应和分步的反应依据就是ΔH4=ΔH1+ΔH2+ΔH3,而这个关系式在题目中恰恰是我们需要求解的。
为了解决这个问题,就需要将ΔH4=ΔH1+ΔH2+ΔH3移项,得到ΔH4-(ΔH1+ΔH2+ΔH3)=0,这个方程式中既有相加也有相减,这符合题目实际情况。
接下来一个问题是做加法和减法各有什么用处?他们都是消去某个中间反应物质的,如果一个物质在三个反应中都有,是不能一步消去的;只能选择在2个方程式中出现的某个物质。
如果该物质都在两个方程式的一边,此时用减法。
如果在方程式的两边,此时用加法。
如果系数不相等,通过相乘或相除让要消去的物质系数相同。
如果两个方程做过一次加减,后续运算不能再使用,只能将新得到的方程和未做运算的方程做运算,最后通过一系列的加减,总能够得到ΔH4-(ΔH1+ΔH2+ΔH3)=0这样的式子,最后移项就能得到ΔH总=ΔH1+ΔH2+ΔH3。
例1:利用盖斯定律计算反应热。
【2010年天津理科综合化学部分第10第(3)问,有改动】利用水煤气合成二甲醚的三步反应如下:① 2H2(g) + CO(g) C H3O H(g);ΔH1=-90.8 kJ·mol-1② 2CH3OH(g) CH3OCH3(g) + H2O(g);ΔH2=-23.5 kJ·mol-1③ CO(g) + H2O(g) C O2(g) + H2(g);ΔH3=-41.3 kJ·mol-1总反应:3H2(g) + 3CO(g) CH3OCH3(g) + C O2 (g)的ΔH4=___________解题步骤:第一步:选择利用两个方程式能消去某个物质。
其中只出现在两个方程式的物质有:CH3OH CH3OCH3, H2O,CO2。


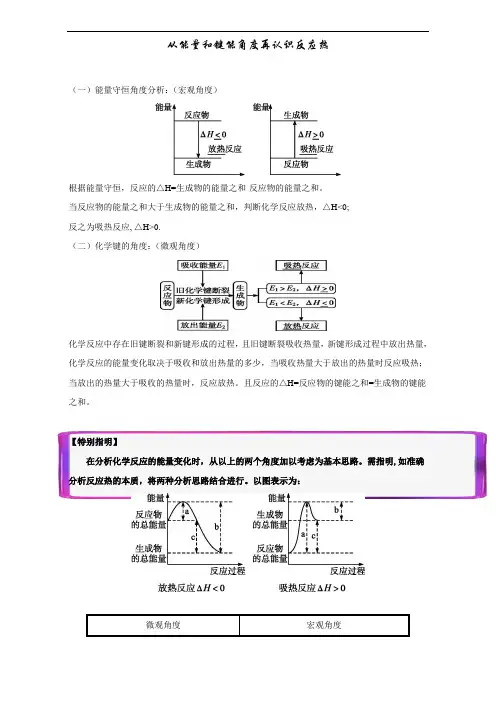
从能量和键能角度再认识反应热(一)能量守恒角度分析:(宏观角度)根据能量守恒,反应的△H=生成物的能量之和-反应物的能量之和。
当反应物的能量之和大于生成物的能量之和,判断化学反应放热,△H<0;反之为吸热反应, △H>0.(二)化学键的角度:(微观角度)化学反应中存在旧键断裂和新键形成的过程,且旧键断裂吸收热量,新键形成过程中放出热量,化学反应的能量变化取决于吸收和放出热量的多少,当吸收热量大于放出的热量时反应吸热;当放出的热量大于吸收的热量时,反应放热。
且反应的△H=反应物的键能之和=生成物的键能之和。
【特别指明】在分析化学反应的能量变化时,从以上的两个角度加以考虑为基本思路。
需指明,如准确分析反应热的本质,将两种分析思路结合进行。
以图表示为:微观角度宏观角度结合上表,不管从微观角度还是宏观角度分析反应焓变均为△H=a-b。
【深度剖析】键能、反应热和稳定性的关系1、键能定义:在101kPa、298K条件下,1mol气态AB分子全部拆开成气态A原子和B原子时需吸收的能量,称AB 间共价键的键能,单位为kJ·mol –1。
2、键能与反应热:化学反应中最主要的变化是旧化学键的断裂和新化学键的形成。
化学反应中能量的变化也主要决定于这两个方面吸热与放热,可以通过键能计算得到近似值。
①放热反应或吸热反应:旧键断裂吸收的能量大于新键形成放出的能量,为吸热反应;旧键断裂吸收的能量小于新键形成所放出的能量,该反应为放热反应。
②反应热:化学反应中吸收或放出的热量称反应热,符号ΔH,单位kJ·mol –1,吸热为正值,放热为负值。
可以通过热化学方程式表示。
反应热的大小与多个因素有关,其数据来源的基础是实验测定。
由于反应热的最主要原因是旧化学键断裂吸收能量与新化学键形成放出能量,所以通过键能粗略计算出反应热。
ΔH(反应热)== =反应物的键能总和—生成物键能总和。
为方便记忆,可作如下理解:断裂旧化学键需吸热(用“+”号表示),形成新化学键则放热(用“-”号表示),化学反应的热效应等于反应物和生成物键能的代数和,即ΔH=(+反应物的键能总和)+(—生成物键能总和),若ΔH<0,为吸热,若ΔH>0,为放热。

(完整版)化学选修4(新人教版)新人教版《化学反应原理》全册知识点归纳第一章化学反应与能量一、焓变反应热1.反应热(Q):一定条件下,一定物质的量的反应物之间完全反应所放出或吸收的热量2.焓变(ΔH)的意义:在恒压条件下进行的化学反应的热效应(1).符号:△H(2).单位:kJ/mol(3)△H=H(生成物)-H(反应物)3.微观角度解释产生原因:化学键断裂——吸热化学键形成——放热放出热量的化学反应。
(放热>吸热)△H为“-”或△H<0吸收热量的化学反应。
(吸热>放热)△H为“+”或△H>0注:(高中阶段Q与△H二者通用)(4)影响晗变的主要因素:①发生变化的物质的物质的量,在其他条件一定时与变化物质的物质的量程正比。
②物质的温度和压强☆常见的放热反应:①所有的燃烧反应②酸碱中和反应③大多数的化合反应④金属与酸或水的反应⑤生石灰和水反应⑥浓硫酸稀释、氢氧化钠固体溶解等☆常见的吸热反应:①晶体Ba(OH)2?8H2O与NH4Cl②大多数的分解反应③以H2、CO、C为还原剂的氧化还原反应④铵盐溶解等二、热化学方程式书写化学方程式注意要点:①热化学方程式必须标出能量变化。
②热化学方程式中必须标明反应物和生成物的聚集状态(g,l,s分别表示固态,液态,气态,水溶液中溶质用aq表示)③热化学反应方程式要指明反应时的温度和压强。
④热化学方程式中的化学计量数可以是整数,也可以是分数⑤各物质系数加倍,△H加倍;反应逆向进行,△H改变符号,数值不变三、燃烧热1.概念:25℃,101kPa时,1mol纯物质完全燃烧生成稳定的化合物时所放出的热量。
燃烧热的单位用kJ/mol表示。
※注意以下几点:①研究条件:101kPa②反应程度:完全燃烧,产物是稳定的氧化物。
③燃烧物的物质的量:1mol④研究内容:放出的热量。
(ΔH<0,单位kJ/mol)四、中和热1.概念:在稀溶液中,酸跟碱发生中和反应而生成1molH2O,这时的反应热叫中和热2.强酸与强碱的中和反应其实质是H+和OH-反应,其热化学方程式为:H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ/mol3.弱酸或弱碱电离要吸收热量,所以它们参加中和反应时的中和热小于57.3kJ/mol。

化学反应热燃烧反应的热效应计算化学反应的热效应是指化学反应过程中伴随产生或吸收的热量。
其中,燃烧反应是一种重要的化学反应类型。
本文将介绍燃烧反应的热效应计算方法。
一、燃烧反应的热效应定义燃烧反应是指物质与氧气发生反应,产物中释放出大量热能的过程。
燃烧反应的热效应可以用焓变来表示,即反应前后系统的焓差。
根据能量守恒定律,反应前后系统吸收的热量等于反应中释放出的热量。
二、燃烧反应热效应计算方法1. 根据反应热的定律,对于一个化学反应rA + sB → tC + uD,其燃烧反应焓变ΔH可表示为:ΔH = [tΔHf(C) + uΔHf(D)] - [rΔHf(A) + sΔHf(B)]其中,ΔHf表示相应物质的标准生成焓,它表示单位物质在标准状态下形成的反应焓。
ΔHf的值可以通过热化学数据库查询获得。
2. 如果反应中有气体生成或消耗,还需要考虑气体在反应过程中的状态变化对热效应的影响。
根据理想气体状态方程PV=nRT,可以得到以下公式来计算气体状态的变化:ΔrH = ΔH - ΔnRT其中,Δn表示反应物和生成物气体摩尔数的差值,R为气体常数,T为反应温度。
3. 如果反应是在常压下进行(例如在开放空气中),则焓变即为热效应;如果反应是在恒定压力下进行(例如在密闭容器中),则焓变需要加上外界对系统所作的功,即ΔH = ΔU + PΔV。
其中,ΔU为反应过程中系统内能的变化,PΔV为外界对系统所作的压力-体积功。
三、示例计算以燃烧反应丙烷(C3H8,液态)+ 氧气(O2,气态)→ 二氧化碳(CO2,气态)+ 水蒸气(H2O,气态)为例,计算其热效应。
首先,查找热化学数据库,获取相关反应物和生成物的标准生成焓:ΔHf(C3H8) = -104.7 kJ/mol,ΔHf(CO2) = -393.5 kJ/mol,ΔHf(H2O) = -285.830 kJ/mol。
根据化学方程式,可得到该反应的热效应计算公式:ΔH = [1 * ΔHf(CO2) + 4 * ΔHf(H2O)] - [1 * ΔHf(C3H8) + 5 * ΔHf(O2)] = [1 * (-393.5) + 4 * (-285.8)] - [1 * (-104.7) + 5 * 0]= -2220.4 kJ/mol如果该反应是在常压下进行,热效应即为焓变:ΔH = -2220.4kJ/mol。
13化学反应热的计算解析化学反应热是指在进行化学反应时产生或吸收的热量,是一个重要的热力学概念。
化学反应热的计算可以帮助我们了解反应的放热或吸热程度,从而预测反应的方向或速率。
在进行化学反应热的计算时,通常使用反应焓变来表示反应热量的变化。
反应焓变是化学反应过程中,反应物和生成物之间焓的变化量。
化学反应的热量可以通过以下两种方式进行计算:1. 通过反应焓变的计算:反应焓变可以通过反应物和生成物之间的焓差来计算。
反应焓变的公式可以表示为ΔH = ΣH(生成物) - ΣH(反应物)。
其中ΔH表示反应焓变,ΣH(生成物)表示生成物的总焓,ΣH(反应物)表示反应物的总焓。
反应焓变的单位通常为焦耳/mol或千焦/mol。
2.通过热量平衡方程进行计算:热量平衡方程可以用来计算化学反应的热量。
热量平衡方程表示为Σq=0,其中Σq为反应物和生成物之间吸热和放热的总和。
通过热量平衡方程可以计算出反应的热量变化。
在进行化学反应热的计算时,需要注意以下几点:1.反应物和生成物的热化学性质需要事先确定:在进行反应焓变计算时,需要确保反应物和生成物的热化学性质是准确的。
通常可以通过实验方法或文献数据来获取反应物和生成物的热化学性质。
2.反应物和生成物的物质量需要明确:在计算反应焓变时,需要明确反应物和生成物的物质量,以便正确计算反应的热量变化。
3.考虑反应的放热或吸热性质:在计算反应焓变时,需要考虑反应是放热还是吸热的性质。
放热反应ΔH为负值,吸热反应ΔH为正值。
综上所述,化学反应热的计算是一个重要的热力学问题,可以通过反应焓变或热量平衡方程来计算。
在进行化学反应热的计算时,需要注意反应物和生成物的热化学性质、物质量和反应的放热或吸热性质。
通过正确计算反应热,我们可以更好地了解化学反应的热力学性质,为实验设计和反应优化提供参考。
《化学反应原理》知识点总结篇一:焓变知识点总结一、焓变、反应热要点一:反应热(焓变)的概念及表示方法化学反应过程中所释放或吸收的能量,都可以用热量来描述,叫做反应热,又称焓变,符号为ΔH,单位为kJ/mol,规定放热反应的ΔH为“—”,吸热反应的ΔH为“+”。
特别提醒:(1)描述此概念时,无论是用“反应热”、“焓变”或“ΔH”表示,其后所用的数值必须带“+”或“—”。
(2)单位是kJ/mol,而不是kJ,热量的单位是kJ。
(3)在比较大小时,所带“+”“—”符号均参入比较。
要点二:放热反应和吸热反应1.放热反应的ΔH为“—”或ΔH<0 ;吸热反应的ΔH为“+”或ΔH >0?H=E(生成物的总能量)-E(反应物的总能量)?H=E(反应物的键能)- E(生成物的键能)2.常见的放热反应和吸热反应①放热反应:活泼金属与水或酸的反应、酸碱中和反应、燃烧反应、多数化合反应。
②吸热反应:多数的分解反应、氯化铵固体与氢氧化钡晶体的反应、水煤气的生成反应、炭与二氧化碳生成一氧化碳的反应3.需要加热的反应,不一定是吸热反应;不需要加热的反应,不一定是放热反应4.通过反应是放热还是吸热,可用来比较反应物和生成物的相对稳定性。
如C(石墨,s(金刚石,s)△H3= +/mol,该反应为吸热反应,金刚石的能量高,石墨比金属石稳定。
二、热化学方程式的书写书写热化学方程式时,除了遵循化学方程式的书写要求外,还要注意以下几点:1.反应物和生成物的聚集状态不同,反应热的数值和符号可能不同,因此必须注明反应物和生成物的聚集状态,用s、l、g分别表示固体、液体和气体,而不标“↓、↑”。
2.△H只能写在热化学方程式的右边,用空格隔开,△H值“—”表示放热反应,△H值“+”表示吸热反应;单位为“kJ/mol”。
3.热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子数或原子数,因此,化学计量数可以是整数,也可以是分数。
也就是说,化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。
如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的,这就是盖斯定律。
[投影]
[讲]根据图示从山山的高度与上山途径无关及能量守衡定律来例证盖斯定律。
[活动]学生自学相关内容后讲解
[板书]1、盖斯定律:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。
[讲]盖斯定律在生产和科学研究中有很重要的意义。
有些反应的反应热虽然无法直接测得,但利用盖斯定律不难间接计算求得。
[板书]2、盖斯定律在生产和科学研究中有很重要的意义
[科学探究]对于反应:C(s)+ O2(g)=CO(g)因为C燃烧时不可能完全生成CO,总有一部分CO2生成,因此这个反应的ΔH无法直接测得,请同学们自己根据盖斯定律设计一个方案反应的ΔH。
[师生共同分析]我们可以测得C与O2反应生成CO2以及CO与O2反应生成CO2的反应热:C(s)+O2(g) =CO2(g);ΔH=-393.5 kJ/mol
CO(g)+ O2(g)=CO2(g);ΔH=-283.0 kJ/mol
[投影]
[讲]根据盖斯定律.可以很容易求算出C(s)+ O2(g)=CO(g)的ΔH。
∵ΔH1=ΔH2+ΔH3∴ΔH2=ΔH1-ΔH3=-393.5kJ/mol-(-283.0kJ/mol)=-110.5 kJ/mol即:C(s)+ O2(g)=CO(g)的ΔH=-110.5 kJ/mol
[投影]
[点击试题]例1、通过计算求的氢气的燃烧热:可以通过两种途径来完成如上图表:
已知:H2(g)+O2(g)=H2O(g);△H1=-mol
H2O(g)=H2O(l);△H2=-mol
根据盖斯定律,则
△H=△H1+△H2=-mol+(-mol)=-mol
[点击试题]例2、实验中不能直接测出由石墨和氢气生成甲烷反应的ΔH,但可测出CH4燃烧反应的ΔH1,根据盖斯定律求ΔH4
CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH1=·mol-1 (1)
C(石墨)+O2(g)=CO2(g);ΔH2=-393·5kJ·mol-1 (2)
H2(g)+O2(g)=H2O(l);ΔH3=·mol-1 (3)
C(石墨)+2H2(g)=CH4(g);ΔH4(4)
[投影]
[讲]利用盖斯定律时,可以通过已知反应经过简单的代数运算得到所求反应,以此来算得所求反应的热效应。
也可以设计一个途径,使反应物经过一些中间步骤最后回复到产物:因为反应式(1),(2),(3)和(4)之间有以下关系: (2)+(3)×2-(1)=(4)所以ΔH4=ΔH2+2ΔH3-ΔH1= kJ·mol-1+2 kJ·mol-1- kJ·mol-1=·mol-1
[小结]可间接计算求得某些无法直接测得的反应热,如 C 与O2生成 CO 的△H。
[点击试题]例3、物质的生成热可定义为由稳定单质生成1 mol物质所放出的热量,如二氧化碳气体的生成热就是的反应热.已知下列几种物质的生成热:葡萄糖(C6H12O6):1259kJ/mol H2O (1):mol CO2:mol试计算1kg 葡萄糖在人体内完全氧化生成二氧化碳气体和液态水,最多可提供的能量.
教案
P s P s 4
4(),白磷(,红磷)=;∆H k J m o l =-292./。
白磷转化为红磷是放热反应,稳定性比红磷低(能量越低越稳定)。
[随堂练习]由金红石TiO 2制取单质Ti ,涉及到的步骤为:: TiO 2TiCl 4Ti
已知:① C s +O 2
g =CO 2g ;H =393
5 kJ ·mol 1
② 2CO g +O 2g =2CO 2g ;H =
566 kJ ·mol 1
③ TiO 2s +2Cl 2g =TiCl 4
s +O 2g ;H =+141 kJ ·mol
1
则TiO 2s +2Cl 2g
+2C s =TiCl 4s +2CO
g 的
H
=。
题型三:根据一定量的物质参加反应放出的热量(或根据已知的热化学方程式),进行有关反应热的计算或比较大小。
例3、已知下列两个热化学方程式: H 2 (g) + 1/2 O 2(g) == H 2O (l) H =
kJ ·mol 1
C 3H 8(g)+5O 2(g) == 3 CO 2(g) +4H 2O (l) H = kJ ·mol 1
实验测得氢气和丙烷的混合气体共5 mol ,完全燃烧时放热3847kJ ,则混合气体中氢气和丙烷的体积比是_______,两者放出的热量之比约为_____
A 、1:3
B 、3:1
C 、1:4
D 、5:13 解法一:十字交叉法 解法二:估算排除法 答案:BD [随堂练习]已知:;
;欲得到相同的热量,需分别燃烧固体碳和氢气的质量比约为
A. 2:
B. 12:
C. 1:1
D. : 解析:由题意可列得方程 答案: B
题型四:反应热大小比较
例4、在同温同压下,下列各组热化学方程式中,的是 A. B. C.
2005广东
22·4
答案:80
kJ ·mol 1。