初三化学 燃烧及其利用
- 格式:ppt
- 大小:1.30 MB
- 文档页数:20

燃烧及其利用是九年级化学中的重要知识点之一,下面是对燃烧及其利用知识点的详细总结。
一、燃烧的基本概念1.燃烧是指物质与氧气或其他氧化剂接触时,并伴有发热和发光现象的化学反应过程。
2.参与燃烧反应的物质称为燃料,主要包括固体燃料、液体燃料和气体燃料。
3.通常燃烧需要三个条件:燃料、氧气(或其他氧化剂)和足够的温度。
二、燃烧的类型1.全燃烧:燃料完全与氧气反应,产生大量的热能和光能。
2.不完全燃烧:燃料只与氧气部分反应,产生少量的碳氧化物和水蒸气,同时释放出较少的热能和光能。
3.反燃烧:物质自身反应生成较稳定氧化物。
三、燃烧的方程式1.燃料+氧气→二氧化碳+水+热能2.燃料+氧气→氧化物+热能四、燃烧产物1.燃烧产物中主要包括二氧化碳、水和二氧化硫等无害物质,还可能包括一些有毒物质和固体颗粒物。
2.燃烧产物的污染对环境和人体健康造成不良影响,如大气污染、酸雨、温室效应等。
五、燃烧与能源利用1.燃烧是主要的能源利用方式,主要包括化石燃料的利用和可再生能源的利用。
2.化石燃料主要有煤炭、石油和天然气,其燃烧产生的二氧化碳是主要的温室气体之一,对全球气候变化产生影响。
3.可再生能源包括太阳能、风能、水能、地热能等,其燃烧过程中不产生二氧化碳等大气污染物,对环境更友好。
六、燃烧与生活1.燃料在日常生活中广泛应用,如煤气、汽油、柴油、燃气等。
2.点火器制作火光、炉子加热食物、车辆燃油驱动、电源发电等都与燃烧有关。
3.燃烧的安全性和环保性是我们生活中需要关注的重要问题,正确使用和管理燃料能够减少事故和环境污染。
七、燃烧实验1.木材燃烧实验:通过将不同木材放入燃烧器中进行燃烧实验,观察燃烧现象并比较燃烧产物与燃料的关系。
2.燃烧剂实验:通过使用不同的燃烧剂(如氧气、氯气、氟气等)进行燃烧实验,研究燃烧剂对燃烧反应的影响。
总结:燃烧及其利用是九年级化学中的重要知识点,燃烧是物质与氧气或其他氧化剂接触时产生发热和发光现象的化学反应过程。


九年级上册化学第七单元笔记第七单元燃烧及其利用一、燃烧的定义和条件燃烧是一种发光、发热的化学反应,通常伴随着火焰的产生。
燃烧的条件是可燃物、助燃物(通常是氧气)和点火源。
只有当这三个条件同时满足时,燃烧才会发生。
二、灭火的方法和原理1.清除可燃物:将可燃物与点火源分离,使其无法发生燃烧。
2.隔绝助燃物:使用灭火器等设备将氧气与可燃物隔离,使燃烧无法继续进行。
3.降低温度:使用水、泡沫等物质降低可燃物的温度,使其无法达到燃烧点。
三、燃料的选择和利用4.煤是常用的燃料之一,它含有碳、氢等元素,燃烧时会产生二氧化碳和水蒸气等产物。
煤的燃烧效率取决于其含碳量、煤粉的细度和空气的供应量。
5.石油是一种重要的能源,它主要用于生产汽油、柴油和润滑油等。
石油的开采和加工需要耗费大量的能源和资源,且会产生严重的环境污染。
6.天然气是一种清洁的能源,它主要成分是甲烷,燃烧时只产生二氧化碳和水蒸气。
天然气在燃烧时产生的热量比煤炭和石油更高,因此是一种高效的能源。
7.太阳能是一种无限的能源,它可以通过太阳能电池板转化为电能或热能。
太阳能的利用不会产生任何污染物,因此是一种非常环保的能源。
8.风能是一种清洁的能源,它可以通过风力发电机转化为电能。
风能的利用不会产生任何污染物,并且风能资源丰富,因此是一种非常有前途的能源。
四、能源的利用和环境保护9.能源的分类:能源可以分为可再生能源和不可再生能源。
可再生能源包括太阳能、风能、水能等,而不可再生能源包括煤炭、石油、天然气等。
10.能源的转化:能源可以从一种形式转化为另一种形式,例如太阳能可以转化为电能或热能,煤炭可以转化为电能或热能等。
11.能源的利用:能源的利用需要考虑到环境保护和可持续发展。
在利用能源的过程中,应该采取有效的措施减少污染物的排放,同时开发清洁、高效的能源技术,以实现能源的可持续发展。
12.环保措施:为了保护环境,可以采取一系列的措施,例如开发清洁能源、推广节能技术、加强环境监测和治理等。

九年级上化学燃烧及其利用知识点
九年级上化学中,燃烧及其利用是一个重要的知识点。
以下是涵盖了燃烧及其利用的
一些主要知识点:
1. 燃烧的定义和特征:燃烧是指物质与氧气发生化学反应,产生能量、产物和火焰的
过程。
燃烧通常伴随着火焰、光、热和气体等现象。
2. 燃烧的必备条件:燃烧必须具备三个条件,即可燃物质、氧气和足够高的温度。
这
些条件统称为“燃烧三要素”。
3. 燃烧反应的类型:根据可燃物质的状态及产生的产物,燃烧反应可分为氧化性燃烧、还原性燃烧和完全燃烧等。
4. 燃烧产物及其特征:燃烧反应产生的主要产物包括二氧化碳、水蒸气和其他氧化物等。
燃烧产物通常具有较高的能量,是燃烧过程所释放的能量。
5. 燃烧的利用:燃烧能够产生大量的热能,被广泛应用在生活和工业中。
如利用燃烧
产生的热能来加热、煮食、发电等。
同时,燃烧还可以用作化学反应的驱动力,如用
燃料燃烧来驱动燃料电池。
6. 燃烧的环境问题:燃烧会产生废气、废水和固体废弃物等,其中包括二氧化碳、二
氧化硫等有害物质。
这些有害物质会直接或间接地对环境造成污染和破坏。
以上是九年级上化学燃烧及其利用的一些主要知识点,希望对你有所帮助。

初中燃烧及其利用教案教学目标:1. 了解燃烧的概念、条件和灭火方法。
2. 掌握燃烧的原理和灭火的原理。
3. 能够运用燃烧和灭火的知识解释日常生活中的问题。
教学重点:1. 燃烧的条件。
2. 灭火的原理。
教学难点:1. 燃烧的条件。
2. 灭火的原理。
教学准备:1. 教材《燃烧及其利用》。
2. 实验器材:酒精灯、火柴、蜡烛、水、灭火器等。
教学过程:一、导入(5分钟)1. 教师通过展示火焰图片,引导学生思考燃烧的现象。
2. 学生分享对燃烧的认知,教师总结并板书燃烧的概念。
二、探究燃烧的条件(15分钟)1. 教师提出问题:“燃烧需要哪些条件?”2. 学生分组讨论,教师引导学生通过实验观察燃烧现象。
3. 学生汇报实验结果,教师总结燃烧的条件。
三、学习灭火的原理(15分钟)1. 教师提出问题:“如何灭火?”2. 学生分组讨论,教师引导学生通过实验观察灭火现象。
3. 学生汇报实验结果,教师总结灭火的原理。
四、燃烧与灭火的应用(15分钟)1. 教师提出问题:“燃烧和灭火在生活中的应用有哪些?”2. 学生举例说明,教师引导学生思考燃烧和灭火的重要性。
五、课堂小结(5分钟)1. 教师引导学生总结本节课所学内容。
2. 学生分享学习收获。
六、作业布置(5分钟)1. 教师布置作业:探究燃烧和灭火在生活中的应用。
教学反思:本节课通过实验和讨论的方式,让学生深入了解燃烧和灭火的原理,并能够运用所学知识解释日常生活中的问题。
在教学过程中,要注意引导学生积极参与,培养学生的实验操作能力和思考能力。
同时,要注重学生的安全教育,教育学生正确使用火源和灭火器材。
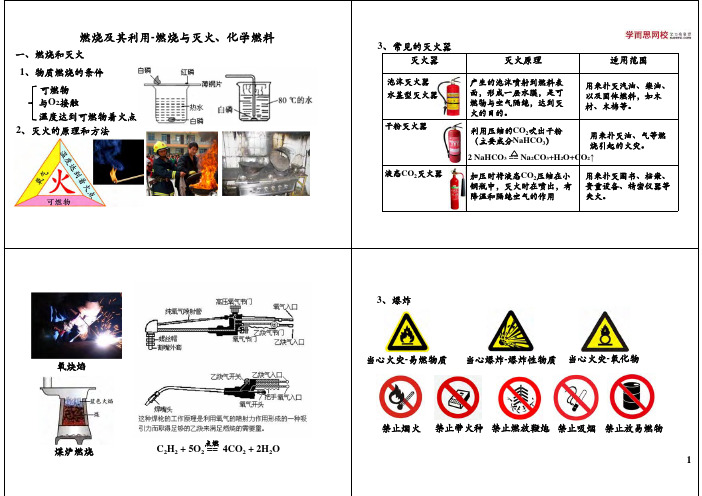
温度达到可燃物着火点2、灭火的原理和方法
灭火器
灭火原理
适用范围
干粉灭火器
利用压缩的CO 2吹出干粉(主要成分NaHCO 3)
3、常见的灭火器
泡沫灭火器产生的泡沫喷射到燃料表面,形成一层水膜,是可燃物与空气隔绝,达到灭火的目的。
液态CO 2灭火器
加压时将液态CO 2压缩在小钢瓶中,灭火时在喷出,有降温和隔绝空气的作用
用来扑灭图书、档案、贵重设备、精密仪器等失火。
用来扑灭汽油、柴油、以及固体燃料,如木材、木棉等。
用来扑灭油、气等燃烧引起的火灾。
水基型灭火器 2 NaHCO 3== Na 2CO 3+H 2O+CO 2↑煤炉燃烧
氧炔焰
C H + 5O == 4CO + 2H O
点燃
当心火灾-易燃物质当心爆炸-爆炸性物质
当心火灾-氧化物
禁止燃放鞭炮禁止烟火
禁止吸烟禁止带火种禁止放易燃物
、化石燃料的综合利用沼气
太阳能、风能、水能、氢能、潮汐能、地热能、核能等
3、新能源的开发和利用
新能源:
水蒸发时吸热,温度达不到纸张的着火点请回答相关问题
(1)如图1向C 中加入少量白磷,再加入热水,塞好胶塞,使导管口浸入热水中,白磷不燃烧。
打开K 1,将A 中溶液滴入B 中,C 中有气泡冒出,白磷燃烧。
C 中发生反应的化。
第七单元燃烧及其利用课题1 燃烧和灭火考试要求:认识燃烧、缓慢氧化、爆炸的条件及其防火、灭火、防爆炸的措施一、燃烧1、概念:可燃物与空气中氧气发生的一种发光、放热的剧烈的氧化反应。
2、条件:(1)可燃物(2)氧气(或空气)(3)温度达到着火点(三者缺一不可,否则不能燃烧)如右图所示:A、薄铜片上的白磷燃烧而红磷不燃烧,说明了燃烧需要温度达到着火点;B、薄铜片的白磷燃烧而水中的白磷不燃烧,说明了燃烧需要氧气白磷的着火点低,应贮存在装有水的试剂瓶中3、燃烧与缓慢氧化的比较相同点:都是氧化反应、都放热;不同点:前者发光、反应剧烈,后者不发光、反应缓慢二、灭火的原理和方法(考点一)1、燃烧的条件决定着灭火的原理,只要破坏燃烧的任何一个条件,就可以达到灭火的目的2、灭火的原理:(1)消除可燃物(2)隔绝氧气(或空气)(3)降温到着火点以下。
3、泡沫灭火器:扑灭木材、棉布等燃烧引起的失火。
干粉灭火器:扑灭一般的失火外,还可以扑灭电器、油、气等燃烧引起的失火。
液态二氧化碳灭火器:扑灭图书、档案、贵重设备、精密仪器等处的失火4、泡沫灭火器的反应原理,利用碳酸钠与浓盐酸迅速反应产生大量的二氧化碳来灭火化学反应方程式:Na2CO3+2HCl=2NaCl+H2O+CO2↑二、爆炸(考点二)概念发生条件防范措施燃烧可燃物与氧气发生的一种发光、发热的剧烈的氧化反应可燃物;与空气或氧气接触;温度达到着火点可燃物与其他物品隔离;与空气隔离;降低温度至着火点以下爆炸可燃物在有限的空间内发生急剧燃烧,短时间内积聚大量的热,使气体体积迅速膨胀而引起爆炸剧烈燃烧;有限空间严禁烟火缓慢氧化反应进行得很慢,甚至不易察觉的氧化反应与空气或氧接触②化学变化的爆炸:可燃物在有限空间内急速燃烧,放出的热使气体的体积迅速膨胀③可燃性气体(氢气、一氧化碳、甲烷)或粉尘(面粉、煤粉)与空气或氧气混合,遇到明火可能会发生爆炸;可燃性气体在点燃或加热前都要检验纯度,以防止发生爆炸的危险④油库、面粉加工厂门口贴有“严禁烟火”的标志:空气中常混有可燃性气体或粉尘,接触到明火,就有发生爆炸的危险⑤可燃物与氧气的接触面积越大,燃烧越剧烈常见灭火的方法(考点三)①油锅着火,用锅盖盖灭②电器着火,先应切断电源③煤气泄漏,先应关闭阀门,再轻轻打开门窗,切忌产生火花④酒精在桌面上燃烧,用湿抹布扑盖⑤扑灭森林火灾,将大火蔓延前的一片树木砍掉其它:A、生煤炉火时,需先引燃纸和木材,因为纸和木材的着火点比煤低,容易点燃B、室内起火,如果打开门窗,会增加空气的流通,增加氧气的浓度,反应剧烈,燃烧更旺C、用扇子扇煤炉火,虽然降低了温度,但没有降至着火点以下,反而增加了空气的流通,所以越扇越旺。
第七单元燃烧及其利用课题1 燃烧与灭火考试要求:认识燃烧、缓慢氧化、爆炸的条件及其防火、灭火、防爆炸的措施一、燃烧1、概念:可燃物与空气中氧气发生的一种发光、放热的剧烈的氧化反响。
2、条件:〔1〕可燃物〔2〕氧气〔或空气〕〔3〕温度到达着火点〔三者缺一不可,否那么不能燃烧〕如右图所示:A、薄铜片上的白磷燃烧而红磷不燃烧,说明了燃烧需要温度到达着火点;B、薄铜片的白磷燃烧而水中的白磷不燃烧,说明了燃烧需要氧气白磷的着火点低,应贮存在装有水的试剂瓶中3、燃烧与缓慢氧化的比拟一样点:都是氧化反响、都放热;不同点:前者发光、反响剧烈,后者不发光、反响缓慢二、灭火的原理与方法〔考点一〕1、燃烧的条件决定着灭火的原理,只要破坏燃烧的任何一个条件,就可以到达灭火的目的2、灭火的原理:〔1〕消除可燃物〔2〕隔绝氧气〔或空气〕〔3〕降温到着火点以下。
3、泡沫灭火器:扑灭木材、棉布等燃烧引起的失火。
干粉灭火器:扑灭一般的失火外,还可以扑灭电器、油、气等燃烧引起的失火。
液态二氧化碳灭火器:扑灭图书、档案、贵重设备、精细仪器等处的失火4、泡沫灭火器的反响原理,利用碳酸钠与浓盐酸迅速反响产生大量的二氧化碳来灭火化学反响方程式:Na2CO3+2HCl=2NaCl+H2O+CO2↑二、爆炸〔考点二〕②化学变化的爆炸:可燃物在有限空间内急速燃烧,放出的热使气体的体积迅速膨胀③可燃性气体〔氢气、一氧化碳、甲烷〕或粉尘〔面粉、煤粉〕与空气或氧气混合,遇到明火可能会发生爆炸;可燃性气体在点燃或加热前都要检验纯度,以防止发生爆炸的危险④油库、面粉加工厂门口贴有“严禁烟火〞的标志:空气中常混有可燃性气体或粉尘,接触到明火,就有发生爆炸的危险⑤可燃物与氧气的接触面积越大,燃烧越剧烈常见灭火的方法〔考点三〕①油锅着火,用锅盖盖灭②电器着火,先应切断电源③煤气泄漏,先应关闭阀门,再轻轻翻开门窗,切忌产生火花④酒精在桌面上燃烧,用湿抹布扑盖⑤扑灭森林火灾,将大火蔓延前的一片树木砍掉其它:A、生煤炉火时,需先引燃纸与木材,因为纸与木材的着火点比煤低,容易点燃B、室内起火,如果翻开门窗,会增加空气的流通,增加氧气的浓度,反响剧烈,燃烧更旺C、用扇子扇煤炉火,虽然降低了温度,但没有降至着火点以下,反而增加了空气的流通,所以越扇越旺。
【初中化学】初中化学之燃烧及其利用知识点汇总【汇总】,建议各位热爱化学科目的初中同学们,化学知识的积累和运用不是一蹴而就的,大家一定要要耐心仔细。
一、燃烧和灭火1、燃烧的条件:(缺一不可)(1)可燃气体(2)氧气(或空气)(3)的温度达到燃点2、灭火的原理:(只要消除燃烧条件的任意一个即可)(1)消除可燃物(2)隔离氧气(或空气)(3)将温度降至燃点以下3、影响燃烧现象的因素:可燃物的性质、氧气的浓度、与氧气的接触面积燃料充分燃烧的两个条件:(1)应有足够的空气(2)燃料与空气有足够大的接触面积。
4.爆炸:可燃物在有限的空间内迅速燃烧,气体体积迅速膨胀引起爆炸。
一切可燃性气体、可燃性液体的蒸气、可燃性粉尘与空气(或氧气)的混合物遇火种均有可能发生爆炸。
二、燃料和能源1、三大化石燃料:煤、石油、天然气(混合物、均为不可再生能源)(1)煤炭:“工业食品”(主要是碳);煤燃烧排放的污染物:so2、no2(引起酸雨)、co、烟尘等(2)石油:“工业的血液”(主要含碳和氢);汽车尾气中污染物:co、未燃烧的碳氢化合物、氮的氧化物、含铅化合物和烟尘(3)天然气是一种气体化石燃料(主要成分:甲烷),是一种清洁能源。
2、两种绿色能源:沼气、乙醇(1)沼气的主要成分:甲烷甲烷的化学式:ch4(最简单的有机物,相对分子质量最小的有机物)物理性质:无色无味气体,密度低于空气,极难溶于水。
化学性质:可燃性ch4+2o2点燃co2+2h2o(发出蓝色火焰)(2)乙醇(俗称乙醇,化学式:C2H5OH)化学性质:可燃性c2h5oh+3o2点燃2co2+3h2o工业酒精通常含有有毒的甲醇CH3OH,因此工业酒精不能用于制备葡萄酒!乙醇汽油:优点(1)节约石油资源(2)减少汽车尾气(3)促进农业发展(4)乙醇可以再生3、化学反应中的能量变化(1)放热反应:如所有燃烧(2)吸热反应:如c+co2高温2co4.新能源:氢能、太阳能、核能、风能、地热能、潮汐能氢气是最理想的燃料:(1)优点:资源丰富,放热多,无污染。
教案:初中化学——燃烧及其利用【教学目标】1. 让学生了解燃烧的概念、条件和灭火的原理。
2. 通过实验和探究活动,培养学生的观察能力、动手能力和解决问题的能力。
3. 引导学生认识燃烧在生活和生产中的应用,培养学生的安全意识和环保意识。
【教学重点】1. 燃烧的概念和条件。
2. 灭火的原理。
【教学难点】1. 燃烧条件的理解和应用。
2. 灭火原理的分析和判断。
【教学过程】一、导入(5分钟)1. 教师通过提问方式引导学生回顾已学的物质变化知识,为新课的学习做好铺垫。
2. 学生分享生活中关于燃烧的现象和经验,激发对燃烧知识的学习兴趣。
二、新课讲授(15分钟)1. 教师简要介绍燃烧的概念,引导学生认识燃烧是一种氧化反应。
2. 学生通过实验观察燃烧的现象,总结燃烧的条件。
3. 教师讲解灭火的原理,学生通过实验探究不同的灭火方法。
三、课堂互动(15分钟)1. 教师提出问题,引导学生思考燃烧在生活和生产中的应用。
2. 学生分组讨论,分享各自的观点和经验。
3. 教师总结燃烧的应用,强调安全用火和环保意识。
四、课后作业(5分钟)1. 学生完成课后练习,巩固所学知识。
2. 教师布置探究性作业,让学生结合生活实际,探究燃烧和灭火的问题。
五、教学反思(5分钟)1. 教师总结课堂教学,反思教学过程中的不足之处。
2. 学生反馈学习情况,提出改进建议。
【教学评价】1. 学生对燃烧概念和条件的掌握程度。
2. 学生对灭火原理的理解和应用能力。
3. 学生在课堂互动中的表现,如观察、思考、合作等。
【教学资源】1. 实验器材:酒精灯、蜡烛、火柴、灭火器等。
2. 教学课件:燃烧和灭火的相关图片、视频、动画等。
【教学建议】1. 注重实验教学,让学生亲身体验燃烧和灭火的过程,提高学生的实践能力。
2. 结合生活实例,引导学生认识燃烧的应用,培养学生的安全意识和环保意识。
3. 鼓励学生提问和思考,激发学生的学习兴趣,提高学生的探究能力。