红磷燃烧实验展示PPT课件
- 格式:ppt
- 大小:303.50 KB
- 文档页数:7



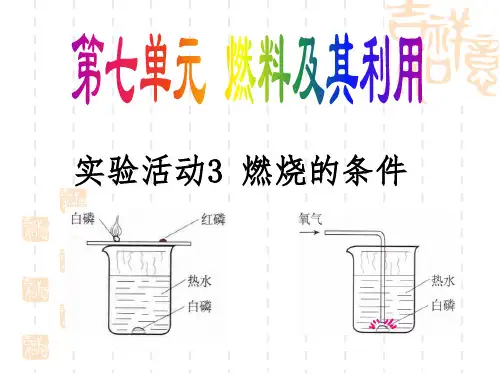
九年级上册红磷实验一、实验名称。
空气中氧气含量的测定(红磷燃烧实验)二、实验原理。
1. 化学反应方程式。
- 红磷在空气中燃烧,与氧气反应生成五氧化二磷固体。
化学方程式为:4P + 5O_2{点燃}{===}2P_2O_5。
2. 原理阐述。
- 红磷燃烧消耗集气瓶中的氧气,使瓶内压强减小。
在大气压的作用下,水被压入集气瓶中,进入集气瓶中水的体积约等于集气瓶内原来氧气的体积。
三、实验装置。
1. 仪器。
- 集气瓶、燃烧匙、导管、止水夹、烧杯、橡胶塞等。
2. 装置图。
- 集气瓶底部铺有少量水(用于吸收五氧化二磷,防止污染空气,同时起到降温作用),燃烧匙内放有红磷,通过带有导管的橡胶塞密封集气瓶,导管的另一端插入盛水的烧杯中,止水夹夹在导管上。
四、实验步骤。
1. 检查装置气密性。
- 连接好装置,将导管一端浸入水中,用手紧握集气瓶外壁,如果导管口有气泡冒出,说明装置气密性良好。
2. 在集气瓶中加入少量水,并将水面上方空间分为5等份。
- 用记号笔标记出水面的位置,以便后续观察进入集气瓶中水的体积。
3. 点燃红磷,迅速伸入集气瓶中,塞紧橡胶塞。
- 红磷燃烧产生大量白烟,放出热量。
4. 待红磷熄灭并冷却后,打开止水夹。
- 观察到烧杯中的水沿导管进入集气瓶,进入集气瓶中水的体积约占集气瓶内空气总体积的1/5。
五、实验现象。
1. 红磷燃烧时。
- 产生大量白烟(五氧化二磷固体小颗粒),放出热量。
2. 冷却后打开止水夹时。
- 烧杯中的水沿导管进入集气瓶,进入集气瓶中的水的体积约占集气瓶内空气总体积的1/5。
六、实验结论。
1. 空气中氧气的体积约占空气总体积的1/5- 通过实验中进入集气瓶中水的体积约为集气瓶内空气总体积的1/5,可以得出该结论。
2. 空气是混合物。
- 因为实验表明空气中除了氧气外还有其他气体成分,氧气被消耗后还有约4/5体积的气体剩余,所以空气是混合物。
七、误差分析。
1. 测量结果小于1/5的原因。
- 红磷量不足。