第11-章-醛和酮
- 格式:doc
- 大小:1.46 MB
- 文档页数:21

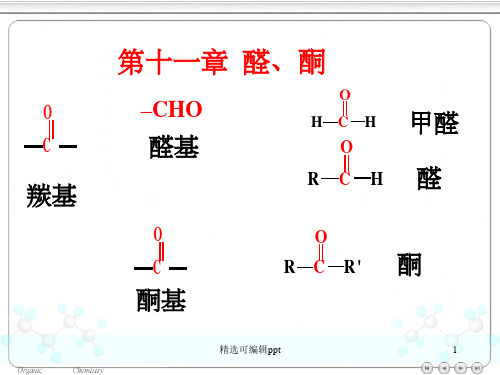




第11章醛与酮§11.1 分类、命名及其物理性质11.1.1 分类和命名1、分类2、普通命名法(1)醛可由相应醇的普通名称出发,仅需将名称中的醇改成醛。
(2)酮在酮字的前面加上所连接的两个烃基的名称。
(与醚命名相似)3、系统命名法a)选主链——含有羰基的最长碳链为主链。
b)编号——从靠近羰基的一端开始编号。
取代基的位次、数目及名称写在醛酮名称前面,并注明酮分子中羰基的位置。
11.1.2 物理性质1、物态甲醛为气体,其他C12及以下脂肪一元醛酮为液体,C12以上的脂肪酮为固体。
2、相对密度脂肪族醛酮相对密度小于1,芳香族醛酮相对密度大于1。
3、沸点与分子量相近的醇、醚、烃相比,沸点:醇>醛、酮>醚>烃原因:a、醇分子间可形成氢键,而醛、酮分子间不能形成氢键;b、醛、酮的偶极矩大于醚、烃的偶极矩。
4、水溶性由于醛酮的羰基氧原子能与水分子中的氢原子形成氢键,所以低级醛酮能溶于水。
其它的醛酮的水溶性随分子量的增大而减小。
高级醛酮微溶或不溶于水,而溶于一般的有机溶剂。
§11.2 化学性质Ⅰ——亲核加成反应11.2.1 羰基的结构1、羰基的结构2、亲电和亲核反应活性➢羰基中的碳氧双键由于电负性O>C,因此π电子云靠近氧的一端:∙碳原子带部分正电荷,具有亲电性,易于和亲核试剂反应。
∙氧原子带部分负电荷,具有亲核性,易于和亲电试剂反应。
但是带负电荷的氧比带正电荷的碳原子稳定。
总之,易于发生亲核加成反应。
3、电子效应和空间效应的影响①羰基活性的影响X=吸电子基,羰基碳正电荷↗,反应速度↗(平衡常数K c↗);X=推电子基,羰基碳正电荷↘,反应速度↘(平衡常数K c↘)。
②亲核试剂因素对于结构相同的醛酮,试剂的亲核性愈强,反应愈快 (平衡常数就愈大)。
如亲核性:HCN>H2O③空间效应的影响因而羰基碳原子如果连有较大基团时,则不利于反应的进行。
4、亲核加成反应活性a)决定于羰基碳上的正电性δ+↗,则反应↗b)决定于空间效应空间位阻↗,则反应↘✓反应活性:①空间效应:HCHO>CH3CHO>ArCHO>CH3COCH3>CH3COR>RCOR>ArCOAr醛的活性大于酮;脂肪族醛、酮大于芳香族醛、酮。
11.2.2 亲核加成反应1、与HCN加成⇨应用范围:醛、甲基脂肪酮、C≤8环酮HCN与醛、酮的加成是分步进行的,首先由CN—(亲核试剂)首先进攻,也就是说HCN与醛、酮的加成是亲核加成。
即:⇨应用:①增长碳链(加1个C);②制α—羟基酸或不饱和酸。
例1:CH3-C-H + HCNOCH3-CH-CNOHOH-H2O/H+CH3-CH-COOHOH乳酸羟基丙酸a-乙醛此法的优点是可以避免使用有毒的氰化氢,而且产率也较高。
2、与金属有机试剂的反应(1)与RMgX的反应⇨应用:制备各种的醇同一种醇可用不同的格氏试剂与不同的羰基化合物作用生成。
可根据目标化合物的结构选择合适的原料。
CH3-CH-CH-CH3CH3OHa b3-甲基-2-丁醇由于乙醛及2-溴丙烷都很容易得到,故方法a较为合理。
(2)与RLi的反应——制备空间位阻大的3°醇有机锂的亲核性和碱性均比格氏试剂强。
例如下列反应格氏试剂不能发生:乙醚-60 C。
H2O体积大3)3C]3C-OH三叔丁基甲醇(CH3)3CLi + (CH3)3C-C-C(CH3)3O优点:产率较高,而且较易分离。
(3)与炔钠的反应OCH C-Na+,液NH3,-33 C。
(2) H2O,H+,65%-75%(1)OHC CH炔醇3、与NaHSO3加成【反应机理】⇨应用范围:醛、甲基脂肪酮、C8以下环酮(其它酮因空间阻碍不能反应)反应生成的α- 羟基磺酸钠如果在酸或碱存在下,加水稀释,产物又可分解成原来的醛或酮。
⇨应用:A、鉴别醛酮例如:①丙酮与苯乙酮?②2-己酮与3-己酮?B、分离、提纯醛、酮化合物。
在酸或碱的浓度较大时,平衡反应朝着加成产物分解为原来的醛、酮的方向进行:4、与醇的反应(1)醛可与一元醇或二元醇生成缩醛或环状缩醛:(2)酮只能与二元醇生成环状缩醛(因为五元、六元环有特殊稳定性):(3)分子内也能形成半缩醛、缩醛:缩醛(酮)对碱、氧化剂、还原剂等稳定。
但在稀酸溶液中,室温下可水解,生成原来的醛(酮)和醇。
形成缩醛或缩酮在合成中的应用:羰基的保护例:由CH3CH=CHCHO CH3CH2CH2CHOCH3CH=CHCHO HOCH2CH2OH干HClCH3CH=CHCHO-CH2O-CH2H2,NiO-CH2O-CH2CH3CH2CH2CH H2O/H+CH3CH2CH2CHO5、与Wittig试剂加成反应生成季膦盐。
再与强碱作用,可除去与磷原子处于伯、仲卤代烃可以和三苯基膦发生SN2α位的碳原子上的氢,生成维狄希试剂。
➢亲核加成:【反应机理】⇨维狄希反应的特点1)可用与合成特定结构的烯烃和指定位置的双键化合物;2)醛酮分子中的 C=C、C≡C对反应无影响,分子中的COOH对反应也无影响;3)魏悌希反应不发生分子重排,产率高。
⇨用途:制备烯烃、与胺类化合物的缩合➢与伯胺缩合成亚胺的机理➢与氨衍生物的缩合⇨亚胺的应用A、鉴别醛酮绝大多数醛酮都可以与氨的衍生物反应生成产物肟、腙、苯腙、缩胺脲等,一般都是棕黄色固体,很容易结晶,并有一定的熔点,故可鉴别醛酮。
B、分离提纯醛酮醛酮与氨的衍生物的反应是可逆的,缩合产物肟、腙、等在稀酸或稀碱作用下,又可水解为原来的醛酮,故可利用该反应分离提纯醛酮。
O的反应7、与H28、与RSH(硫醇)的反应硫醇比相应的醇更具有强的亲核能力。
酮缩乙二硫醇§11.3 化学性质Ⅱ——α-H的反应11.3.1 α-H的活性(酸性)1、影响a-H活性的因素醛、酮分子上与羰基直接相应的C称为α-C,α-C上的H为α-H。
➢Y的吸电子能力;➢a-H 周围的空间环境;➢负碳离子的稳定性。
2、醛、酮a-H的酸性醛酮分子中羰基旁α-C的H由于受羰基的影响使酸性增强。
在一般情况下,烯醇式在平衡体系中的含量是比较少的,但随着a-H活性的增强,烯醇式也可能成为平衡体系中的主要存在形式。
酮式与烯醇式的互变可通过酸/碱催化。
11.3.2 羟醛缩合与卤化反应1、羟醛缩合在稀碱的作用下含α-H的醛酮,发生缩合生成β-羟基醛或酮,称为羟醛缩合反应。
【反应历程】➢酮的羟醛缩合反应比醛困难:CH3-C-CH+ CH2-C-CH3NaOHO OHδ-δ+δ+δ-CH3-C=CH-C-CH3OCH3需及时蒸出CH3-C-CH2-C-CH3CH3OO H➢分子内的羟醛缩合:合成C5~C7环状物的方法OOONa2CO32➢交叉羟醛缩合反应:两种不同的醛、酮之间发生的羟醛缩合反应称为交叉的羟醛缩合反应。
无选择性的交叉羟醛缩合一般意义不大!⇨一些有意义的交叉羟醛缩合反应一种醛或酮有a-H,另一种醛或酮无a-H。
由于酮反应较慢,可利用酮作交叉缩合:⇨应用:利用羟醛缩合反应可以合成碳链增加一倍的α、β-不饱和醛酮2、卤化反应在酸或碱的催化作用下,醛酮的a-H被卤素取代的反应。
(1)酸催化醛、酮在酸催化下进行氯代、溴代、碘代,可以得到一卤代物酸性催化可以控制生成卤素一取代、二取代和三取代【反应机理】酸的催化作用是加速形成烯醇(2)碱催化醛、酮的碱催化卤代与酸催化卤代相比,反应速度较快。
反应很难控制在生成一卤代物阶段上。
最后结果是α-碳原子上的氢全部被卤素取代。
【反应机理】(3)卤仿反应在碱性条件下,与X作用,甲基上的三个α-H都被卤代,由于羧基氧原子和三个卤素原子2的强吸电子作用,使碳-碳键不牢固,在碱的作用下断裂,生成卤仿和相应羧酸。
甲基酮类化合物或能被次卤酸钠氧化成甲基酮的化合物,在碱性条件下与氯、溴、碘作用分别生成氯仿、溴仿、碘仿(统称卤仿)的反应称为卤仿反应。
OH|-CH-结构单元的醇氧化成相应的甲基醛酮,次卤酸钠溶液具有一定的氧化性,它可将含有CH3因此这种醇也能也能发生碘仿反应。
§11.4 化学性质Ⅲ——氧化、还原反应11.4.1 氧化反应 1、弱氧化剂氧化(1)托伦(Tollens)试剂若在洁净的玻璃器中进行,金属银就沉积在壁上形成银镜称为银镜反应。
⇨ 反应范围:只氧化醛,不氧化酮,C=C 、C≡C 也不被氧化。
(2)斐林试剂(Fehling)组成:碱性氢氧化铜溶液(A 液:CuSO 4、B 液:NaOH+酒石酸钠钾)⇨ 反应范围:芳香醛、酮不反应, C=C 、C≡C 也不被氧化。
⇨ 讨论:A 、氧化性:Tollen’s>Fehling’sTollen's 可氧化所有的醛(包括芳甲醛);Fehling's 只氧化脂肪醛B 、用途:(1)鉴别醛酮;CH 3CCH 3CH 3CHOC 6H 5CHO O Tollen'sAgAg xFehling's x砖红(2)合成相应的酸R-CH=CH-CHOR-CH=CH-COOHAg(NH 3)2NO 3H +若用KMnO 4氧化,则断开!C=C 巴豆醛巴豆酸、强氧化剂氧化(1)K 2Cr 2O 7 / H +、KMnO 4 / H +、HNO 3 等氧化剂酮类一般不易被氧化。
在强氧化条件下,被氧化成碎片。
制备上没有意义!(2)自动氧化醛一般都储存在棕色瓶中(3)过氧酸的氧化——Baeyer—Villiger氧化反应酮虽然对很多氧化剂是稳定的,但它可以被过氧化酸顺利地氧化成酯。
➢氧原子插入的位置规律:H > Ph- > R3C- > R2CH- > RCH2- > -CH311.4.2 还原反应1、催化还原⇨催化氢化反应选择性差,不饱和碳键,硝基,氰基等也被还原。
碳碳双键、碳碳三键优先还原2、用金属氢化物还原(选择性还原)(1)硼氢化钠/醇或硼氢化钠/OH—。
⇨特点:不能还原碳碳双键等不饱和官能团,也不能还原羧酸、酯、酰胺、腈等。
(2)氢化铝锂⇨特点:(1)两步反应;(2)不能还原碳碳双键等不饱和官能团,但可以还原羧酸、酯、酰胺、腈等。
、克里门森(Clemmensen)还原法醛酮在锌汞齐和浓盐酸作用下,可被还原为烃,羰基变为亚甲基。
)(酸性条件下将C=O还原成CH2⇨合成上的应用举例Friedel-Crafts反应烷基苯4、吉日聂尔—沃尔夫(kishner—wolff)还原和黄鸣龙改进法醛酮在碱性条件及高温高压下与肼反应,羰基被还原为-CH-2➢黄鸣龙改良法(Huang-Minlon modification))(碱性条件下将C=O还原成CH25、歧化反应——Cannizzaro反应定义:没有a-活泼氢的醛在强碱作用下,发生分子间的氧化还原而生成相应醇和相应酸的反应。
⇨特点:①无α-H 的醛作反应物;②浓碱性条件;③产物一个被氧化, 一个被还原。