初三化学核外电子排布讲解
- 格式:ppt
- 大小:4.71 MB
- 文档页数:7




原子核外电子排布规律①能量最低原理:电子层划分为K<L<M<O<P<Q,对应电子层能量增大;原子核外电子排布按照能量较低者低优先排布原则.②每个电子层最多只能容纳2n2个电子。
③ 最外层最多只能容纳 8个电子(K 层为最外层时不能超过2个)次外层最多只能容纳18个电子(K 层为次外层时不能超过2个倒数第三层最多只能容纳32个电子注意:多条规律必须同时兼顾。
简单例子的结构特点:(1)离子的电子排布:主族元素阳离子跟上一周期稀有气体的电子层排布相同,如钠离子、镁离子、铝离子和氖的核外电子排布是相同的。
阴离子更同一周期稀有气体的电子排布相同:负氧离子,氟离子和氖的核外电子排布是相同的。
(2)等电子粒子(注意主要元素在周期表中的相对位置)①10电子粒子:CH 、N 、NH 、NH 、NH 、O、OH 、H O 、H O 、F 、HF 、Ne 、Na 、Mg 、Al 等。
4-3-23+4-2-23+-++2+3 ②18电子粒子:SiH 、P 、PH 、S 、HS 、H S 、Cl 、HCl 、Ar 、K 、Ca 、PH 等。
4-33-2-2-++2+4 特殊情况:F 、H O 、C H 、CH OH222263 ③核外电子总数及质子总数均相同的阳离子有:Na 、NH 、H O 等;阴离子有:++43+F 、OH 、NH ; HS 、Cl 等。
---2--前18号元素原子结构的特殊性:(1)原子核中无中子的原子:H11(2)最外层有1个电子的元素:H 、 Li 、Na ;最外层有2个电子的元素:Be 、Mg 、He(3)最外层电子总数等于次外层电子数的元素:Be 、Ar(4)最外层电子数等于次外层电子数2倍的元素:C ;是次外层电子数3倍的元素:O ;是次外层电子数4倍的元素:Ne(5)最外层电子数是内层电子数一半的元素:Li 、P(6)电子层数与最外层电子数相等的元素:H 、Be 、Al(7)电子总数为最外层电子数2倍的元素:Be(8)次外层电子数是最外层电子数2倍的元素:Li 、Si元素周期表的规律:(1)最外层电子数大于或等于3而又小于8的元素一定是主族元素,最外层电子数为1或2的元素可能是主族、副族或0族元素,最外层电子数为8的元素是稀有气体(He 例外)(2)在元素周期表中,同周期的ⅡA、ⅢA 族元素的原子序数差别有:①第2、3周期(短周期)元素原子序数都相差1;②第4、5周期相差11;③第6、7周期相差25(3)同主族、邻周期元素的原子序数差①位于过渡元素左侧的主族元素,即ⅠA、ⅡA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素总数;相差的数分别为2,8,8,18,18,32②位于过渡元素左侧的主族元素,即ⅢA~ⅦA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素种数。


《原子核外电子的排布离子》讲义同学们,今天咱们来一起学习北京版九年级上册化学第3章构成物质的微粒中的第二节内容——原子核外电子的排布和离子。
这部分内容可有意思啦,就像探索微观世界的小秘密一样。
一、原子核外电子是分层排布的咱们先来说说原子核外的电子。
想象一下,原子就像一个小小的太阳系,原子核就是那个中心的太阳,而电子呢,就像围绕太阳转的行星。
不过这些电子可不像行星那样随便转,它们是分层排布的。
为什么会分层排布呢?这就和电子的能量有关啦。
能量低的电子离原子核近,就像住在里层的小居民;能量高的电子离原子核远,就像是住在外层的居民。
就好比咱们在学校里,不同年级的同学在不同的楼层上课,低年级的同学在低楼层,高年级的同学在高楼层,这样大家都能有条不紊地学习和生活。
咱们可以用原子结构示意图来表示原子的结构。
比如说,氧原子的结构示意图,中间是原子核,外面有电子层。
原子核里有质子和中子,质子带正电,中子不带电,而电子带负电。
对于氧原子来说,它的质子数是8,电子数也是8。
这8个电子就分布在不同的电子层上。
第一层最多能容纳2个电子,第二层最多能容纳8个电子,氧原子的电子排布就是2和6,先把第一层填满,剩下的电子就排在第二层。
二、最外层电子数与元素性质的关系同学们,这原子的最外层电子数可不得了,它和元素的化学性质有着密切的关系呢。
先来说说稀有气体元素。
像氦、氖、氩这些稀有气体元素,它们的原子最外层电子数达到了相对稳定的结构。
氦最外层有2个电子,其他的稀有气体最外层一般都是8个电子。
这种稳定结构就好比一个小家庭已经很美满了,不需要再和别的家庭有过多的交往,所以稀有气体的化学性质很不活泼,就像一个个低调的小隐士,很少参与化学反应。
再看看金属元素,金属原子的最外层电子数一般比较少,通常是13个。
比如说钠原子,最外层只有1个电子。
这个电子就像一个不安分的小调皮,很容易就跑掉了。
当它跑掉之后,钠原子就变成了钠离子,带了一个单位的正电荷。

最经典--核外电子的排布情况1.核外电子排布:①电子层:电子在原子核外一定的区域内运动,这些区域称为电子层,核外电子是分层排布的。
核外电子的分层排布是因为电子的能量各不相同,能量高的电子在离核远的区域运动,能量低的电子在离核近的区域运动。
②核外电子排布的规律:第一层最多容纳2个电子,第二导最多容纳8个电子,最外层最多容纳8个电子(最外层为第一层时,只能容纳2个电子)。
核外电子总是从最内层开始依次向外排布。
2.原子结构示意图:①原子结构示意图各部分表示的意义。
②元素的性质与原子结构的关系。
元素的性质与元素的原子核外电子排布有密切的关系,特别是元素的化学性质跟它的原子的最外层电子数目关系更加密切。
金属元素: 一般最外层电子数<4 容易失电子,形成阳离子非金属元素:一般最外层电子数≥4 容易得电子,形成阴离子稀有气体元素:最外层电子数为8(He 为2) 不易得失电子,一般不参加化学反应 最外层电子数为8(若第一层为最外层时,电子数为2)的结构叫相对稳定结构因此元素的化学性质主要和由原子的最外层电子数有关。
离子及离子的形成1.离子的概念:带电的原子(或原子团)叫做离子。
带正电的叫阳离子,带负电的叫阴离子。
2.分类及形成:阳离子(原子失去电子而形成)带正电 阴离子(原子得到电子而形成)带负电注意:(1)根据原子核外最外层电子排布的特点可知:金属元素的原子易失去电子形成阳离子;非金属元素的原子易得到电子形成阴离子。
(2)原子变为离子时,质子数、元素种类没有改变;电子数、最外层电子数发生了改变。
3.离子的表示方法:在元素符号右上角标明电性和电荷数,数字在前,符号在后。
若数字为1时,应省略不写。
例如:钠离子:Na +、Cl -、Mg 2+、O 2-。
4.离子符号表示的意义:①数字的意义:3Mg 2+—表示每个镁离子带2个单位正电荷表示3个镁离子②符号的意义:3Mg 2+表示3个镁离子5.原子与离子的比较。

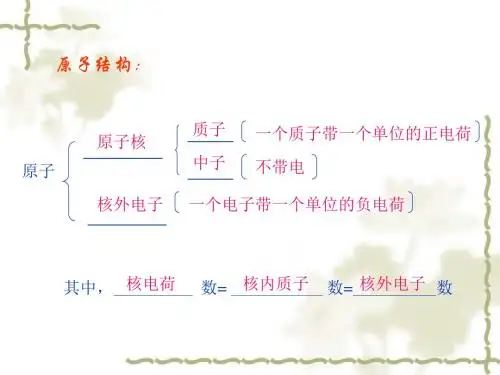
第一节核外电子排布的初步知识一、原子核外电子排布1、原子的结构原子原子核核外电子+—质子:带正电中子:不带电核电荷数(即质子数)= 核外电子数原子质量主要集中在原子核上原子相对质量︽质子数+ 中子数原子核内质子数决定元素种类2、核外电子具有能量。
在多电子原子里,电子能量并不相同:能量低的电子——离核近的区域运动能量高的电子——离核远的区域运动用电子层表示电子能量不同和离核远近不同3、原子核外电子的分层排布可用原子结构示意图表示原子核及核内有8个质子弧线表示电子层表示该层上的电子数+82 64、原子核外电子分层排布规律(1)核外电子总是从离核最近、能量最低的电子层逐步趋向离核远、能量高的电子层排布(2)各电子层最大容纳量:第一层2个、第二层8 个------第n层为2n2个(3)最外层不得超过8 个。
5、离子结构示意图:核电荷数≠ 核外电子数核内质子数>核外电子数——阳离子核内质子数<核外电子数——阴离子核外电子总数为10个的有:原子:Ne、离子:O2-、F-、Na+、Mg2+、Al3+、NH4+分子:CH4、NH3、H20、HF二、元素的分类1、稀有气体元素:原子最外层都有8 个电子,He为2 个这样的结构也叫稳定结构(惰性气体元素)注意:离子一定达到稳定结构。
而且与某种稀有气体元素原子的核外电子排布相同。
即最外层电子数为8的原子一定是稀有气体原子;最外层电子数为8的微粒可能是离子或稀有气体原子。
2、金属元素:最外层电子数一般少于4 个。
(越少越容易失去电子,化学性质越活泼)金属元素原子易失去最外层电子次外层变成最外层最外层达到稳定结构3、非金属元素:除个别元素以外,最外层电子数一般多于4 个。
(越多越容易得电子,化学性质越活泼)非金属元素原子易得电子最外层达到稳定结构总结:金属、非金属元素原子都未达到稳定结构,但都有达到稳定结构的趋势,只不过达到稳定结构的方式不同,有的通过失电子,有的通过得电子。

第四节核外电子排布的初步知识一、核外电子的排布:(一)、电子层;原子核外的电子,能量大小不同。
能量低的电子通常在离核近的区域内运动,能量较高的在离核较远的区域内运动,科学家形象地将这些区域称为电子层。
(二)、核外电子的分层排布:核外电子是在不同的电子层内运动的。
人们把这种现象叫做核外电子的分层排布。
现在发现的元素原子核外电子最少的有一层,最多的有七层。
(三)、1——18号元素和稀有气体元素核外电子排布的规律:1、各电子层最多容纳电子数目是2n2(n是电子层数)个;2、最外层电子数目不超过8个(第一层为最外层时不超过2个);3、次外层电子数目不超过18个,倒数第三层电子数目不超过32个;4、能量最低原则:原子核外的电子总是尽先排布在能量最低的电子层里,然后再由里往外排,依次排布在能量逐步升高的电子层里。
二、原子结构示意图:1、原子结构示意图:知道了原子的核电荷数和核外电子的排布以后,我们用小圆圈及圈内数字表示原子核及核内质子数,弧线表示电子层,弧线上的数字表示该层上的电子数,这样画出来表示原子结构的图示叫原子结构示意图 .如下图所示:+3 2 1 +4 2 2锂(Li) 铍(Be)经科学家研究证明,核电荷数从1到18的元素的原子结构示意图如下:学习者要按下面句式记住1到20元素的原子序数、名称,能按原子核外电子排布规律画出原子结构示意图:氢氦锂铍硼,碳氮氧氟氖,钠镁铝硅磷,硫氯氩钾钙2、原子结构的特点与化学性质:(1)、只有一个电层,这层上达到2个电子和最外层有8个电子的原子化学性质比较稳定,具有这种结构的叫做稳定结构。
稀有气体元素的原子结构是稳定结构,一般不与其它物质发生化学反应。
稀有气体元素原子的电子层排布如下:(2)、金属原子的最外层电子的数目一般少于4个,在化学反应里容易失去最外层电子而使次外层变成最外层,达到8个电子的稳定结构。
(3)、非金属原子的最外层电子数目一般多于4个,在化学反应中容易获得电子使最外层达到8个电子的稳定结构。

核外电子的排布离子一、知识要点知识要点一: 核外电子的排布阅读:在多电子的原子中,电子的能量不相同,能量低的电子通常在离核近的区域运动,能量高的电子通常在离核远的区域运动。
为了便于说明问题,通常用电子层形象化地表明运动着的电子离核的远近。
实际上,原子核外根本无“层”,我们仅仅用“层”来代表离核远近的区域。
所以多电子原子中电子在原子核外不同区域运动可简单而形象地称为分层运动,又叫核外电子的分层排布。
这样,电子就可以看作是在能量不同的电子层上运动。
1.核外电子是分层排布的:电子层:电子层:一二三四五六七能量:离核远近:2.核外电子是分层排布的一般规律:每层最多容纳的电子数为2n2(n为电子层数);遵循能力最低原理:电子总是先排能量低的电子层,然后再排能量高的电子层;最外层电子不超过8个电子,次外层不超过18个电子。
3.原子结构示意图:①画法:画圆圈,标核电,弧线呈扇形,数字一条线。
②涵义:③按顺序写出1-18号元素的符号:【随堂练习】1、(4分)化学是研究物质的结构、性质以及变化规律的科学,研究元素知识是学好化学的基础。
下表包含部分元素的相关信息,完成以下填空:(1)1869年,科学家发现了元素周期律和元素周期表。
(2)请画出17号元素原子结构示意图,该元素在化学反应中比较容易(填“得到”或“失去”)电子变成离子。
知识要点二:元素的性质与原子结构的关系:阅读:稀有气体元素原子的最外层都有8个电子(氦是2个),稀有气体元素化学性质比较稳定,一般不跟其他物质发生化学反应。
性质是由结构决定的。
因此,通常我们把这种最外层有8个电子(最外层是第一层时有2个电子)的结构,称为稳定结构。
注意:这里所说的稳定是相对稳定,而不是绝对的稳定。
金属元素原子最外层电子数一般少于4个,在化学反应中比较容易失去最外层电子,而使次外层变成最外层,通常达到8个电子的稳定结构,而且最外层电子数越少,越容易失去电子,化学性质越活泼。
非金属元素原子最外层电子数一般多于或等于4个,在化学反应中比较容易获得电子,而使最外层达到8个电子的稳定结构,而且最外层电子数越多,越易得到电子,化学性质越活泼。
核外电子的排布离子一、知识要点知识要点一: 核外电子的排布阅读:在多电子的原子中,电子的能量不相同,能量低的电子通常在离核近的区域运动,能量高的电子通常在离核远的区域运动。
为了便于说明问题,通常用电子层形象化地表明运动着的电子离核的远近。
实际上,原子核外根本无“层”,我们仅仅用“层”来代表离核远近的区域。
所以多电子原子中电子在原子核外不同区域运动可简单而形象地称为分层运动,又叫核外电子的分层排布。
这样,电子就可以看作是在能量不同的电子层上运动。
1.核外电子是分层排布的:原因:电子层:电子层:一二三四五六七能量:离核远近:2.核外电子是分层排布的一般规律:每层最多容纳的电子数为2n2(n为电子层数);遵循能力最低原理:电子总是先排能量低的电子层,然后再排能量高的电子层;最外层电子不超过8个电子,次外层不超过18个电子。
3.原子结构示意图:①画法:画圆圈,标核电,弧线呈扇形,数字一条线。
②涵义:③按顺序写出1-18号元素的符号:氢H 氦He 锂Li 铍Be 硼B 碳C 氮N 氧O氟F 氖Ne钠Na 镁Mg 铝Al 硅Si 磷P 硫S 氯Cl氩Ar【随堂练习】1、(4分)化学是研究物质的结构、性质以及变化规律的科学,研究元素知识是学好化学的基础。
下表包含部分元素的相关信息,完成以下填空:(1)1869年,科学家发现了元素周期律和元素周期表。
(2)请画出17号元素原子结构示意图,该元素在化学反应中比较容易(填“得到”或“失去”)电子变成离子。
知识要点二:元素的性质与原子结构的关系:阅读:稀有气体元素原子的最外层都有8个电子(氦是2个),稀有气体元素化学性质比较稳定,一般不跟其他物质发生化学反应。
性质是由结构决定的。
因此,通常我们把这种最外层有8个电子(最外层是第一层时有2个电子)的结构,称为稳定结构。
注意:这里所说的稳定是相对稳定,而不是绝对的稳定。
金属元素原子最外层电子数一般少于4个,在化学反应中比较容易失去最外层电子,而使次外层变成最外层,通常达到8个电子的稳定结构,而且最外层电子数越少,越容易失去电子,化学性质越活泼。
《核外电子排布》讲义一、引言在探索物质世界的奥秘中,原子的结构是一个至关重要的领域。
而核外电子的排布则是理解原子性质和化学行为的关键。
让我们一起走进核外电子排布的奇妙世界。
二、什么是核外电子排布原子由原子核和核外电子组成,原子核带正电荷,核外电子带负电荷。
核外电子在原子核外的一定区域内运动,这些区域被称为电子层。
核外电子的排布遵循一定的规律,决定了原子的化学性质和物理性质。
三、核外电子排布的规律1、能量最低原理电子总是优先占据能量较低的轨道,然后再依次进入能量较高的轨道。
这就像人们在坐座位时,总是先选择靠近门口、比较方便的位置,然后再考虑更远、更不方便的位置。
2、泡利不相容原理在同一个原子中,不可能有两个电子的四个量子数完全相同。
简单来说,就是在同一个轨道中,最多只能容纳两个电子,且这两个电子的自旋方向必须相反。
3、洪特规则电子在等价轨道(相同能量的轨道)上排布时,总是尽可能分占不同的轨道,且自旋方向相同。
这是因为这样的排布方式能够使原子的能量更低,更加稳定。
四、电子层与电子亚层1、电子层电子层通常用数字表示,从离原子核最近的一层开始,依次为第一层(K 层)、第二层(L 层)、第三层(M 层)等。
电子层的能量依次升高。
2、电子亚层在同一电子层中,电子还可以进一步分为不同的亚层,分别用s、p、d、f 表示。
s 亚层只有一个轨道,p 亚层有三个轨道,d 亚层有五个轨道,f 亚层有七个轨道。
五、核外电子排布的表示方法1、电子排布式用数字和字母来表示电子在原子核外各电子层和亚层的排布情况。
例如,钠原子的电子排布式为 1s² 2s² 2p⁶ 3s¹。
2、轨道表示式用小方框表示轨道,用箭头表示电子的自旋方向。
这种表示方法能够更加直观地展示电子的排布情况。
六、核外电子排布与元素周期表元素周期表是化学中非常重要的工具,而核外电子排布与元素周期表有着密切的关系。
1、周期元素周期表中的周期与电子层有关。
核外电子排布的初步知识学科:化学教学内容:核外电子排布的初步知识【基础知识精讲】一.核外电子分层排布的初步知识1.在含有多个电子的原子里,电子的能量并不相同,故电子是分层排布的.电子层数一二三四五六七离核距离近→远电子能量低→高填充顺序先→后2.原子结构示意图.如图,镁原子的结构示意图含义①+12 表示原子核及核内有12个质子(即原子核带有12个单位正电荷),②弧线表示电子层③弧线上的数字表示该电子层上的电子数3.元素种类的划分元素类别最外层电子数得失电子趋势性质结论金属元素<4失去最外层电子较易发生化学反应元素的化学性质与原子的最外层电子数有关非金属元素≥4(氢为1)易得电子或形成共用电子对以达到8电子稳定结构稀有气体元素=8(He为2个)难得失电子难发生化学反应二.离子:带电的原子或原子团叫离子.1.阳离子:失去电子的原子,带正电荷,如Na+.Mg2+.Al3+.NH+4等(质子数>电子数)2.阴离子:得到电子的原子,带负电荷,如O2-.F-.Cl-.S2-.SO2-4等(质子数<电子数)3.离子的形成和符号(1)金属元素的原子容易失去最外层电子,失去m个电子就带m个单位正电荷,表示为Rm+.如铝原子Al→铝离子Al3+.(13=2+8+3)原子结构示意图阳离子结构示意图(13>2+8)(2)非金属元素的原子容易得到电子,达到8电子稳定结构,得到n个电子,就带n个单位负电荷,表示为Rn-.如氧原子O→氧离子O2-.(8=2+6) (8<2+8=阴离子结构示意图离子化合物三.化合物按形成方式的不同划分为<共价化合物1.离子化合物:NaCl(离子化合物)2.共价化合物氯化氢分子(HCl)(共价化合物)3.实验验证:Na+Cl2NaCl H2+Cl2HCl【重点难点解析】一.1~18号元素核外电子排布知识及应用例题:按核电荷数的增加,依一定规律将1~18号元素顺次排列成下表, 运用所学的核外电子排布的初步知识,据表填空.最外层电子数电子层数ⅠⅡⅢⅣⅤⅥⅦ O一二三H HeLi Be B C N O F NeNa Mg Al Si P S Cl Ar(1)在化学反应中,第Ⅰ纵行的元素比较容易电子;第Ⅵ纵行的元素比较容易电子,(除H外)都通常达到8个电子的稳定结构.可见元素的化学性质主要决定于原子的数(2)从原子结构方面看:同一横行的元素具有相同的数;同一纵行的元素具有相同的数.(3)在表中和Ne原子核外电子排布相同的两种阴离子的离子结构示意图分别为______和,3种阳离子的离子符号是. . .分析按核电荷数递增顺序,画出1~18号元素的原子结构示意图,详见课本P59图3-16所示的示意图.通过比较这些元素的原子结构示意图即可解答有关问题.解答(1)失去;得到;最外层电子数(2)电子层;最外层电子二.具有相同质子数的粒子不一定是同种元素元素是具有相同质子数的一类原子的总称,但不能认为具有相同质子数的粒子一定是同种元素,因为粒子可以是分子.质子.离子.现举例说明具有相同质子数的粒子的几种可能情况:1.同一元素的原子和离子.如F和F-质子数都是9;2.分子和原子,如Ne.H2O的质子数都是10;3.不同的分子,如H2O.HF.NH3.CH4的质子数都是10; 4.原子和原子团,如Na和NH+4的质子数都是11;5.不同的离子,如F-和OH-的质子数都是9.三.具有相同电子层排布的微粒不一定是同种元素的原子例:与氖原子电子层排布相同的离子有O2-.F-.Na+.Mg2+.Al3+;与氩原子电子层排布相同的离子有S2-.Cl-.四.构成物质的基本粒子——分子.原子.离子有的物质是由分子构成的,如H2O.NH3.HCl.O2.H2等.有的物质是由原子构成的,如Fe.Cu.He.Ar等.有的物质是由离子构成的,如NaCl.MgF2.K2SO4等.在化学反应里,分子一定发生改变,原子一定不发生改变,离子不一定发生改变.五.离子化合物与共价化合物的比较离子化合物共价化合物概念由阴.阳离子相互作用而构成的化合物以共用电子对形成分子的化合物组成元素通常是活泼金属与活泼非金属元素通常是不同种的非金属元素形成原子得失电子,形成阴.阳离子原子间形成共用电子对构成粒子由离子构成由分子构成举例NaCl.CaF2.ZnSO4HCl.H2O.CO2【典型热点考题】例1下列六种粒子结构示意图分别为:(1) A.B.C.D.E共表示种元素(2)表示原子的粒子是(填序号)(3)表示阳离子粒子是(4)表示阴离子粒子是分析元素是具有相同核电荷数的一类原子的总称,在题目所示的六种粒子中,A与B,E与F的核电荷数相同,故共代表四种元素.在原子中质子数=电子数;阳离子质子数>电子数;阴离子质子数<电子数解答(1)四(2)ACF(3)DE()B例2质子数不超过18的A.B.C3种粒子,它们的核电荷数依次增大.A粒子失去3个电子后呈电中性;B粒子带2个单位正电荷,其核外电子排布和氖原子相同;C粒子得到两个电子后最外层可达到8电子稳定结构,则A.B.C三种粒子是( )A.Mg2+.Al3+.O2-B.N3-.Mg2+.S2-C.N3-.Mg2+.SD.Al3+.Ne.S2-分析根据题意,可知, B粒子是具有12个质子,核外有10个电子的粒子,即是Mg2+离子.由三种粒子核电荷数依次增大可知,A粒子的质子数小于12,C粒子的质子数大于12,A粒子应该是具有10个电子,核内有7个质子的N3-离子,C粒子应该是具有16个质子和16个电子的S原子.解答应选C例3构成物质的粒子有①原子②离子③分子.用符号和名称分别填写下列空白:(1)水是由.构成.(2)铁是由.构成的.(3)氯化钾是由.构成的.分析水是共价化合物,由水分子构成,铁是金属单质直接由铁原子构成,氯化钾是离子化合物,由离子构成,另外按题目要求在每小题前一空填写符号,后一个空填名称.解答 (1)H2O,水分子;(2)Fe,铁原子;(3)K+.Cl-.钾离子和氯离子【同步达纲练习】一.选择题(6_10分=60分)1.核外电子分层排布的主要原因是( )A.电子的能量不同B.电子的大小不同C.电子的数量不同D.电子的质量不同2.元素的化学性质主要取决于原子结构中的( )A.电子层数B.最外层电子数C.核外电子数D.中子数3.某微粒核外有18个电子,核内有17个质子和18个中子,这微粒是( )A.氩原子B.氯原子C.氯离子D.硫离子4.下列各组微粒的质子数和电子数均相等的是( )A.Na和Na+ B.F-和OH-C.Cl和Cl-D.Na+和Mg2+5.S和S2-具有相同的( )A.核电荷数B.核外电子数C.化学性质D.电性6.下列说法中正确的是( )A.在多个电子的原子里,能量低的电子离核近,能量高的电子离核远B.原子最外层电子数小于4的一定是金属元素C.凡是质子数相同的粒子一定属于同种元素D.最外层为8电子结构的粒子一定是稀有气体元素.二.填表( 10分)粒子名称粒子符号质子数电子数中子数相对原子质量碳原子66Al3+1027硫原子1632111123三.填空题(2_10=20分)8.离子化合物(如 )一般由元素与元素组成.形成离子化合物时,原子失去电子,变成离子; 原子得到电子,变为离子.带相反电荷的离子相互作用形成,它的构成粒子为.9.共价化合物(如)一般由元素与元素组成.共价化合物形成时,通过原子间结合,形成,其构成粒子为.四.推断题(1_10=10分)10.有核电荷数均小于20的A.B.C.D四种元素,A能形成氧化物AO,其中A元素的质量分数为60%,且A元素原子核内质子数等于中子数, B元素原子内无中子,C原子和D-都比B原子多17个电子,试回答:(1)写出各元素的名称及元素符号:ABCD(2)画出A.D-的粒子结构示意图,AD- .(3)写出四种元素间能组成物质的化学式.其中属于离子化合物的是(写名称).属于共价化合物的是(写名称)【素质优化训练】1.某粒子的结构示意图为:(1)该粒子有个电子层,最外层有电子;(2)若该粒子带2个单位的负电荷,则a等于;(3)若该粒子带3个单位的正电荷,则a等于;(4)在(2)和(3)中所叙述的粒子构成化合物的化学式为,该化合物属于(共价,离子) 化合物.2.不同的分子中,可能含有相同数目的电子.请写出五种化学性质不同,但每个分子均含有10个电子的物质的化学式. .. ..3.已知R原子最外层电子数为4,甲学生说A原子一定是金属元素的原子,乙学生说A原子一定是非金属元素的原子,丙学生说甲和乙说的都不对.请分析三位学生谁说的对?为什么?【知识探究学习】交流与讨论:解释下列原因:(1)为什么氦气.氖气是单原子分子,氢气.氯气为双原子分子.(2)为什么氯元素与钠元素化合时形成离子化合物,而氯元素与氢元素化合时形成的是共价化合物.参考答案:【同步达纲练习】一.1.A2.B3.C4.B5.A6.A二.7.C 6.12;铝离子 13.14;S2- 18.16;钠原子Na12;8.NaCl,金属,非金属,金属元素,阳;非金属元素,阴,离子化合物,阴.阳离子9.HCl,非金属.非金属,共用电子对,共价化合物,分子10.(1)镁Mg 氢H 氩Ar 氯Cl;(2)略;(3)MgCl2.HCl.氯化镁.氯化氢【素质优化训练】1.(1)2,8;(2)8;(3)13;(4)Al2O3,离子2.CH4.NH3.H2O.HF.Ne3.丙说的对,因为最外层有4个电子的原子,可能是金属元素的原子,也可能是非金属元素的原子.【知识探究学习】解答:(1)氦气.氖气的原子已达到稳定结构,而氢气.氯气的原子的最外都需一个电子而达到稳定结构,两个原子各拿一个电子形成共用电子对,从而使每个原子都形成稳定结构.(2)金属元素的原子一般容易失去电子,非金属元素的原子一般容易得到电子,氯原子与钠原子化合时,钠原子失电子,氯原子得电子,形成阴阳离子,相互作用形成离子化合物.氯原子与氢原子化合时,各拿出一个电子形成一个共用电子对,在共用电子对的作用下形成了共价化合物.。
第 1 页 共 1 页 2020年中考化学一轮复习:核外电子的排布
1、原子结构图:
①圆圈内的数字:表示原子的质子数
②+:表示原子核的电性
③弧线:表示电子层
④弧线上的数字:表示该电子层上的电子数
1、 核外电子排布的规律:
①第一层最多容纳2个电子;
②第二层最多容纳8个电子;
③最外层最多容纳8个电子(若第一层为最外层时,最多容纳2个电子)
3、元素周期表与原子结构的关系:
①同一周期的元素,原子的电子层数相同,电子层数=周期数
②同一族的元素,原子的最外层电子数相同,最外层电子数=主族数
4、元素最外层电子数与元素性质的关系(考点二)
金属元素:最外层电子数<4 易失电子
非金属元素:最外层电子数≥4 易得电子
稀有气体元素:最外层电子数为8(He 为2) 不易得失电子
最外层电子数为8(若第一层为最外层时,电子数为2)的结构叫相对稳定结构
因此元素的化学性质由原子的最外层电子数决定。
当两种原子的最外层电子数相同,则这两种元素的化学性质相似。
(注意:氦原子与镁原子虽然最外层电子数相同,但是氦原子最外层已达相对稳定结构,镁原子的最外层未达到相对稳定结构,所氦元素与镁元素的化学性质不相似)
质子数。