化学元素核外电子排布表
- 格式:doc
- 大小:236.50 KB
- 文档页数:3
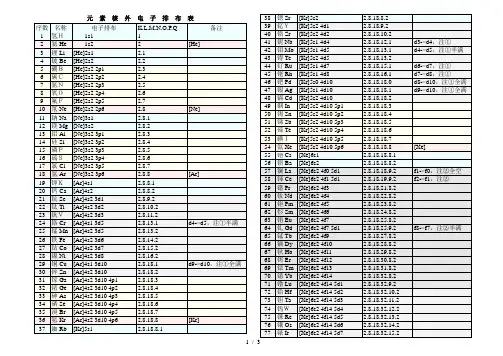
元素核外电子排布表1 / 378 铂Pt [Xe]6s1 4f14 5d9 2.8.18.32.17.1 d8->d9,注①79 金Au [Xe]6s1 4f14 5d10 2.8.18.32.18.1 d9->d10,注①全满80 汞Hg [Xe]6s2 4f14 5d10 2.8.18.32.18.281 铊Tl [Xe]6s2 4f14 5d10 6p1 2.8.18.32.18.382 铅Pb [Xe]6s2 4f14 5d10 6p2 2.8.18.32.18.483 铋Bi [Xe]6s2 4f14 5d10 6p3 2.8.18.32.18.584 钋Po [Xe]6s2 4f14 5d10 6p4 2.8.18.32.18.6 红色为放射性元素85 砹At [Xe]6s2 4f14 5d10 6p5 2.8.18.32.18.786 氡Rn [Xe]6s2 4f14 5d10 6p6 2.8.18.32.18.8 [Rn]87 钫Fr [Rn]7s1 2.8.18.32.18.8.188 镭Ra [Rn]7s2 2.8.18.32.18.8.289 锕Ac [Rn]7s2 5f0 6d1 2.8.18.32.18.9.2 f1->f0,注②全空90 钍Th [Rn]7s2 5f0 6d2 2.8.18.32.18.10.2 f2->f0,注②全空91 镤Pa [Rn]7s2 5f2 6d1 2.8.18.32.20.9.2 f3->f2,注②92 铀U[Rn]7s2 5f3 6d1 2.8.18.32.21.9.2 f4->f3,注②93 镎Np [Rn]7s2 5f4 6d1 2.8.18.32.22.9.2 f5->f4,注②94 钚Pu [Rn]7s2 5f6 2.8.18.32.24.8.295 镅Am [Rn]7s2 5f7 2.8.18.32.25.8.2 加粗为人造元素96 锔Cm [Rn]7s2 5f7 6d1 2.8.18.32.25.9.2 f8->f7,注②半满97 锫Bk [Rn]7s2 5f9 2.8.18.32.27.8.298 锎Cf [Rn]7s2 5f10 2.8.18.32.28.8.299 锿Es [Rn]7s2 5f11 2.8.18.32.29.8.2100 镄Fm [Rn]7s2 5f12 2.8.18.32.30.8.2101 钔Md [Rn]7s2 5f13 2.8.18.32.31.8.2 兰色为估计排布式102 锘No [Rn]7s2 5f14 2.8.18.32.32.8.2103 铹Lr [Rn]7s2 5f14 6d1 2.8.18.32.32.9.2104 Rf [Rn]7s2 5f14 6d2 2.8.18.32.32.10.2105 Ha [Rn]7s2 5f14 6d3 2.8.18.32.32.11.2106 [Rn]7s2 5f14 6d4 2.8.18.32.32.12.2107 [Rn]7s2 5f14 6d5 2.8.18.32.32.13.2108 [Rn]7s2 5f14 6d6 2.8.18.32.32.14.2109 [Rn]7s2 5f14 6d7 2.8.18.32.32.15.2110 [Rn]7s1 5f14 6d9 2.8.18.32.32.17.1 d8->d9,注①111 [Rn]7s1 5f14 6d10 2.8.18.32.32.18.1 d9->d10,注①全满112 [Rn]7s2 5f14 6d10 2.8.18.32.32.18.2113 [Rn]7s2 5f14 6d10 7p1 2.8.18.32.32.18.3114 [Rn]7s2 5f14 6d10 7p2 2.8.18.32.32.18.4115 [Rn]7s2 5f14 6d10 7p3 2.8.18.32.32.18.5116 [Rn]7s2 5f14 6d10 7p4 2.8.18.32.32.18.6117 [Rn]7s2 5f14 6d10 7p5 2.8.18.32.32.18.7 灰色为未发现元素118 [Rn]7s2 5f14 6d10 7p6 2.8.18.32.32.18.8注:①d亚层在s亚层外,常多填d亚层(使之趋于全满/半满),少填s亚层②d亚层在f亚层外,常多填d亚层,少填f亚层(使之趋于全空/半满)2 / 33 / 3。

原子核外电子排布与元素周期律一、原子结构(Z 个)原子核注意:(N 个) 质量数(A)=质子数(Z)+中子数(N)1.X 原子序数= = =核外电子(Z 个)2.原子核外电子的排布规律:①电子总是尽先排布在能量 的电子层里;②各电子层最多容纳的电子数是 ;③最外层电子数不超过 个(K 层为最外层不超过 个),次外层不超过 个,倒数第三层电子数不超过 个。
电子层: 一(能量最低) 二 三 四 五 六 七 对应表示符号: 3.元素、核素、同位素元素: 。
核素: 。
同位素: 。
(对于原子来说) 二、元素周期表 1.编排原则:①按 递增的顺序从左到右排列 ②将 相同..的各元素从左到右排成一横行..。
(周期序数=原子的电子层数) ③把 相同..的元素按电子层数递增的顺序从上到下排成一纵行..。
=原子最外层电子数 2.结构特点:核外电子层数 元素种类第一周期 种元素短周期 第二周期 种元素周期 第三周期 种元素元 (7个横行) 第四周期 种元素 素 (7个周期) 第五周期 种元素 周 长周期 第六周期 种元素 期 第七周期 未填满(已有 种元素) 表 主族:ⅠA ~ⅦA 共7个主族族 副族:ⅢB ~ⅦB 、ⅠB ~ⅡB ,共7个副族 (18个纵行) 第Ⅷ族: 纵行,位于 之间 (16个族) 零族: ① 主族(A ):由 和 元素共同组成的族(除第18纵列)列序与主族序数的关系② 副族(B ):完全由 元素组成的族(第8、9、10纵列除外)③ Ⅷ族:包括 三个纵列。
④ 0族:第 纵列,该族元素又称为 元素。
三、元素周期律1.元素周期律: 。
元素性质的周期性变化实质是... 。
族碱金属元素: ( 是金属性最强的元素,位于周期表 ) 第ⅦA 族卤族元素: ( 是非金属性最强的元素,位于周期表 ) ★判断元素金属性和非金属性强弱的方法:(1)金属性强(弱)——① ;② ;③ 。
(2)非金属性强(弱)——① ;② ;③ 。

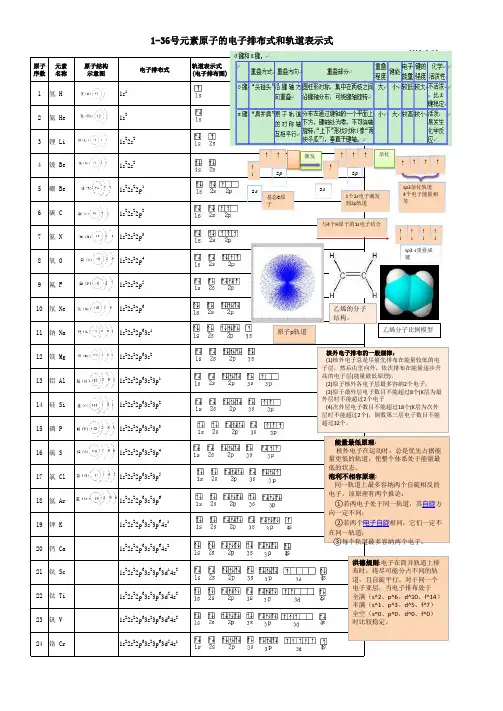
化学前36号元素电子排布式和简式化学前36号元素电子排布式和简式是一种通过绘制电子排布式图或简式来表示元素在原子中的电子排布情况的方法。
排布式图可以准确地描述原子内电子在不同能量等级上的排布情况,而简式可以提供一个有限的、容易理解的定性描述。
化学前36号元素电子排布式及简式如下:氢(H):排布式:1s1,简式:1氦(He):排布式:1s2,简式:2锂(Li):排布式:1s22s1,简式:2.1硼(B):排布式:1s22s22p1,简式:2.3碳(C):排布式:1s22s22p2,简式:2.4氮(N):排布式:1s22s22p3,简式:2.5氧(O):排布式:1s22s22p4,简式:2.6氟(F):排布式:1s22s22p5,简式:2.7氖(Ne):排布式:1s22s22p6,简式:2.8钠(Na):排布式:1s22s22p63s1,简式:2.8.1镁(Mg):排布式:1s22s22p63s2,简式:2.8.2铝(Al):排布式:1s22s22p63s23p1,简式:2.8.3磷(P):排布式:1s22s22p63s23p3,简式:2.8.5硫(S):排布式:1s22s22p63s23p4,简式:2.8.6氯(Cl):排布式:1s22s22p63s23p5,简式:2.8.7 氩(Ar):排布式:1s22s22p63s23p6,简式:2.8.8 钾(K):排布式:1s22s22p63s23p64s1,简式:2.8.8.1钙(Ca):排布式:1s22s22p63s23p64s2,简式:2.8.8.2钡(Ba):排布式:1s22s22p63s23p64s23d1,简式:2.8.8.2.1铁(Fe):排布式:1s22s22p63s23p64s23d6,简式:2.8.8.2.6锌(Zn):排布式:1s22s22p63s23p64s23d10,简式:2.8.8.2.10铜(Cu):排布式:1s22s22p63s23p64s13d10,简式:2.8.8.3.10氯(Br):排布式:1s22s22p63s23p65s1,简式:2.8.8.4氪(Kr):排布式:1s22s22p63s23p65s24d5,简式:2.8.8.4.52.8.9.2钯(Pd):排布式:1s22s22p63s23p64d10,简式:2.8.10铑(Rh):排布式:1s22s22p63s23p64d86s1,简式:2.8.10.1铱(Ir):排布式:1s22s22p63s23p64d106s2,简式:2.8.10.2铂(Pt):排布式:1s22s22p63s23p64d106s26f1,简式:2.8.10.2.6金(Au):排布式:1s22s22p63s23p64d105f14,简式:2.8.10.2.5锡(Sn):排布式:1s22s22p63s23p64d105f46s2,简式:2.8.10.2.5.6锑(Sb):排布式:1s22s22p63s23p64d105f26d1,简式:2.8.10.2.5.2碲(Te):排布式:1s22s22p63s23p64d105f26d2,简式:2.8.10.2.5.2碘(I):排布式:1s22s22p63s23p64d105f46d17s1,简式:2.8.10.2.5.6.7砹(At):排布式:1s22s22p63s23p64d105f76d17s2,简式:2.8.10.2.5.7.7氙(Xe):排布式:1s22s22p63s23p64d105f76d17s2,简式:2.8.10.2.5.7.7 氖(Rn):排布式:1s22s22p63s23p64d105f86d18s2,简式:2.8.10.2.5.8.8 钍(Tl):排布式:1s22s22p63s23p64d105f146d2,简式:2.8.10.2.5.14.2铯(Cs):排布式:1s22s22p63s23p65s24d105f146d17s1,简式:2.8.10.3.14.6.7铵(Fr):排布式:1s22s22p63s23p64f145d106s27p1,简式:2.8.11.1.5.6.7 钇(Y):排布式:1s22s22p63s23p64d104f14,简式:2.8.12铒(Er):排布式:1s22s22p63s23p64d104f145d1,简式:2.8.12.1铥(Dy):排布式:1s22s22p63s23p64d104f145d16s2,简式:2.8.12.1.5.6 镤(Pu):排布式:1s22s22p63s23p64d104f145d106s4,简式:2.8.12.1.5.10.4以上就是化学前36号元素的电子排布式和简式。


21到30号元素核外电子排布式核外电子排布式是指核外电子排布式的特征,它是指元素原子以外的电子的排布情况。
由于每种元素的核外电子排布式,原子的各种物理和化学特性也有很大的不同。
下面我们将讨论21号到30号元素的核外电子排布式。
21号元素是锰,它有4个核外电子,2个在2s轨道,2个在2p轨道。
22号元素是钛,有5个核外电子,3个在2s轨道,2个在2p轨道。
23号元素是钒,有6个核外电子,4个在2s轨道,2个在2p轨道。
24号元素是铬,有6个核外电子,4个在3s轨道,2个在3p轨道。
25号元素是锰,有7个核外电子,4个在3s轨道,3个在3p轨道。
26号元素是钛,有8个核外电子,4个在3s轨道,4个在3d轨道。
27号元素是铝,它有10个核外电子,4个在3s轨道,6个在3p轨道。
28号元素是锶,它有9个核外电子,5个在4s轨道,4个在3d轨道。
29号元素是镁,它有12个核外电子,6个在3s轨道,6个在3p轨道。
30号元素是锂,它有7个核外电子,4个在2s轨道,3个在2p轨道。
上述仅仅是21号到30号元素原子核外电子排布式的简单说明,让我们意识到它们的重要性,并希望理解核外电子排布式的元素的不同特性,有助于帮助我们更好地提高我们化学知识的水平。
核外电子排布式决定原子不同的性能,这些性能会影响我们元素之间的相互作用。
由于每种元素的核外电子排布式不同,它们可以与他们周围的元素结合在一起,形成更大的分子,形成多种化合物。
核外电子的态必须与原子的核进行协调,以保持其安稳性,并确保原子之间可以相互作用。
核外电子排布式也作用于蛋白质、糖和脂质,这些有机分子具有结构复杂,极具活性的特点。
它们有电子密度分布和电荷密度分布,这就定义了分子内部电荷分布和形状,并可能影响分子间作用,以及外部电场对物质是否被吸收或被特定化合物吸附的方式。

1-36号元素电子排布式化学元素是组成物质的基本单位。
元素的属性不仅受到原子核中质子和中子的影响,电子的排布方式也在很大程度上决定了元素的性质。
为了更好的理解元素的性质以及化学反应过程,学习元素的电子排布式是非常必要的。
本篇文章将介绍1-36号元素的电子排布式。
1. 氢元素(H,原子序数1)氢元素只含有一个电子,因此其电子排布式为1。
2. 氦元素(He,原子序数2)氦元素包含2个电子,因此其电子排布式为1s2。
3. 锂元素(Li,原子序数3)锂元素包含3个电子,其电子排布式为1s2 2s1。
4. 铍元素(Be,原子序数4)铍元素包含4个电子,其电子排布式为1s2 2s2。
5. 碳元素(C,原子序数6)碳元素包含6个电子,其电子排布式为1s2 2s2 2p2。
6. 氮元素(N,原子序数7)氮元素包含7个电子,其电子排布式为1s2 2s2 2p3。
7. 氧元素(O,原子序数8)氧元素包含8个电子,其电子排布式为1s2 2s2 2p4。
8. 氟元素(F,原子序数9)氟元素包含9个电子,其电子排布式为1s2 2s2 2p5。
9. 氖元素(Ne,原子序数10)氖元素包含10个电子,其电子排布式为1s2 2s2 2p6。
10. 钠元素(Na,原子序数11)钠元素包含11个电子,其电子排布式为1s2 2s2 2p6 3s1。
11. 镁元素(Mg,原子序数12)镁元素包含12个电子,其电子排布式为1s2 2s2 2p6 3s2。
12. 铝元素(Al,原子序数13)铝元素包含13个电子,其电子排布式为1s2 2s2 2p6 3s2 3p1。
13. 硅元素(Si,原子序数14)硅元素包含14个电子,其电子排布式为1s2 2s2 2p6 3s2 3p2。
14. 磷元素(P,原子序数15)磷元素包含15个电子,其电子排布式为1s2 2s2 2p6 3s2 3p3。
15. 硫元素(S,原子序数16)硫元素包含16个电子,其电子排布式为1s2 2s2 2p6 3s2 3p4。

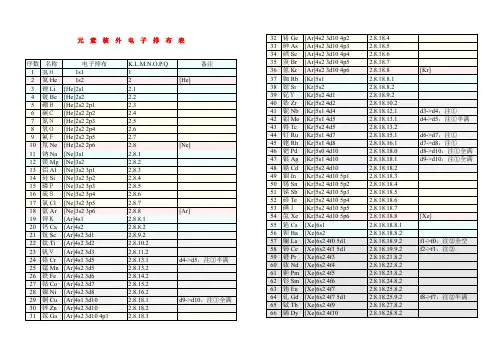
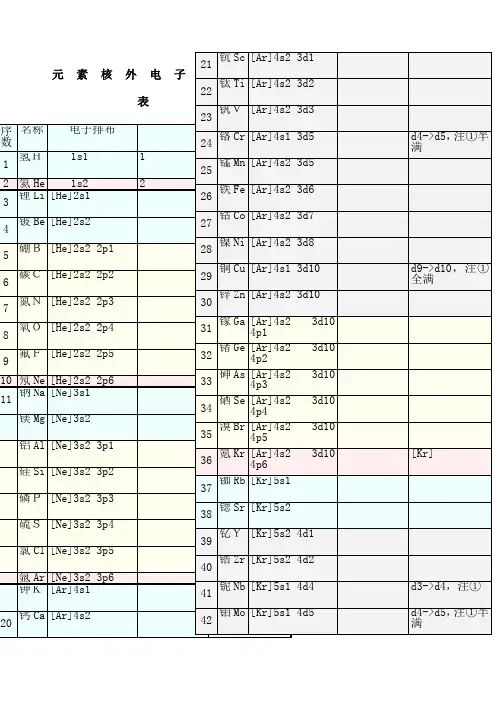
1到36号元素核外电子排布式:1、H氢:1s12、He氦:1s23、Li锂:1s2 2s14、Be铍:1s2 2s25、B硼:1s2 2s2 2p17、N氮:1s2 2s2 2p38、O氧:1s2 2s2 2p49、F氟:1s2 2s2 2p510、Ne氖:1s2 2s2 2p611、Na钠:1s2 2s2 2p6 3s112、Mg镁:1s2 2s2 2p6 3s213、Al铝:1s2 2s2 2p6 3s2 3p114、Si硅:1s2 2s2 2p6 3s2 3p215、P磷:1s2 2s2 2p6 3s2 3p316、S硫:1s2 2s2 2p6 3s2 3p417、Cl氯:1s2 2s2 2p6 3s2 3p518、Ar氩:1s2 2s2 2p6 3s2 3p619、K钾:1s2 2s2 2p6 3s2 3p6 4s120、Ca钙:1s2 2s2 2p6 3s2 3p6 4s221、Sc钪:1s2 2s2 2p6 3s2 3p6 3d1 4s222、Ti钛:1s2 2s2 2p6 3s2 3p6 3d2 4s223、V 钒:1s2 2s2 2p6 3s2 3p6 3d3 4s224、Cr铬:1s2 2s2 2p6 3s2 3p6 3d5 4s125、Mn锰:1s2 2s2 2p6 3s2 3p6 3d5 4s226、Fe铁:1s2 2s2 2p6 3s2 3p6 3d6 4s227、Co钴:1s2 2s2 2p6 3s2 3p6 3d7 4s228、Ni镍:1s2 2s2 2p6 3s2 3p6 3d8 4s229、Cu铜:1s2 2s2 2p6 3s2 3p6 3d10 4s130、Zn锌:1s2 2s2 2p6 3s2 3p6 3d10 4s231、Ga镓:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p132、Ge锗:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p233、As砷:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p334、Se硒:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p425、Br溴:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p536、Kr氪:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6电子排布的规则1、构筑原理整个体系的能量越低越好。
28号元素核外电子排布
28号元素,又称钙元素,是一种重要的同位素元素,主要存在
于地球上的许多物质中。
它的核外电子排布在物理和化学特性上发挥着重要的作用。
28号元素的核外电子排布是典型的2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f14 6s2 6p6 6d10 7s2,它的核外电子排布满足八邻原理,每个核外电子都像八只蜘蛛一样,共有四个八邻。
由于每一层的核外电子都各自承担一定的耗散作用,从而使该元素的物理和化学特性更加稳定。
核外电子排布对于28号元素的化学性质也有很大的影响。
28号元素的化学性质主要取决于其外层电子的排布。
在这种排列方式下,28号元素有较强的吸附力,因此它易与其它元素形成化合物,从而
发挥重要的物理和化学功能。
例如,它可以与碳、氧、氮、氟等元素形成混合物,可用于制造大量的化学品,如某些胶类、玻璃、涂料、抗菌剂等。
此外,28号元素的核外电子排布也影响着它的物理性质。
因为
其外层的电子容易受到外界的影响而发生变化,从而影响其化学性质、热容量、弹性和耐蚀性等物理特性,从而影响它的运用。
28号元素的核外电子排布不仅影响其化学性质,也影响其电性质。
由于它的外层电子容易受外界影响而发生变化,因而它有一定的电导性,可以被用来做电子元件的原材料,从而实现各种电子产品的功能。
28号元素的核外电子排布极其复杂,是影响28号元素物理和化学性质的关键。
它的特性要符合八邻原理,每一层电子都要承担一定的耗散作用,这样才能使28号元素的物理和化学性质比较稳定,有利于它的广泛运用。
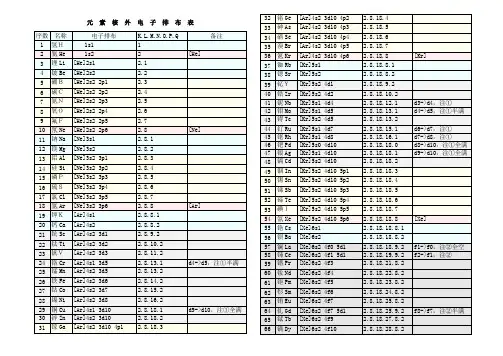
核外电子排布式 Document number【980KGB-6898YT-769T8CB-246UT-[1]H氢1s1[2]He氦1s2[3]Li锂1s2 2s1[4]Be铍1s2 2s2[5]B硼1s2 2s2 2p1[6]C碳1s2 2s2 2p2[7]N氮1s2 2s2 2p3[8]O氧1s2 2s2 2p4[9]F氟1s2 2s2 2p5[10]Ne氖1s2 2s2 2p6[11]Na钠1s2 2s2 2p6 3s1[12]Mg镁1s2 2s2 2p6 3s2[13]Al铝1s2 2s2 2p6 3s2 3p1[14]Si硅1s2 2s2 2p6 3s2 3p2[15]P磷1s2 2s2 2p6 3s2 3p3[16]S硫1s2 2s2 2p6 3s2 3p4[17]Cl氯1s2 2s2 2p6 3s2 3p5[18]Ar氩1s2 2s2 2p6 3s2 3p6[19]K钾1s2 2s2 2p6 3s2 3p6 4s1 [20]Ca钙1s2 2s2 2p6 3s2 3p6 4s2 [21]Sc钪1s2 2s2 2p6 3s2 3p6 3d1 4s2 [22]Ti钛1s2 2s2 2p6 3s2 3p6 3d2 4s2 [23]V 钒1s2 2s2 2p6 3s2 3p6 3d3 4s2 *[24]Cr铬1s2 2s2 2p6 3s2 3p6 3d5 4s1 [25]Mn锰1s2 2s2 2p6 3s2 3p6 3d5 4s2 [26]Fe铁1s2 2s2 2p6 3s2 3p6 3d6 4s2 [27]Co钴1s2 2s2 2p6 3s2 3p6 3d7 4s2 [28]Ni镍1s2 2s2 2p6 3s2 3p6 3d8 4s2*[29]Cu铜1s2 2s2 2p6 3s2 3p6 3d10 4s1 [30]Zn锌1s2 2s2 2p6 3s2 3p6 3d10 4s2 [31]Ga镓1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p1 [32]Ge锗1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p2 [33]As砷1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3 [34]Se硒1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p4 [35]Br溴1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5 [36]Kr氪1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6例3.不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如下图所示。