化学元素核外电子排布表doc
- 格式:pdf
- 大小:3.09 MB
- 文档页数:3

1-36号元素基态原子核外电子排布式元素的基态电子排布是指元素原子核外电子在基态时的分布。
基态是指电子在最低能级时的排布方式。
原子核外电子的排布方式决定了元素的性质和化学反应。
在排布原子核外电子时,需要遵循一些规则:1.泡利不相容原理:每个电子的量子态要不同,即不可能有两个电子具有完全相同的四个量子数。
2.需要按能级填充:电子会先填充能级较低的量子态。
3.每个能级最多填充一定数量的电子:对于s能级,最多填充2个电子;对于p能级,最多填充6个电子;对于d能级,最多填充10个电子;对于f能级,最多填充14个电子。
根据这些规则,我们来看一下1-36号元素基态原子核外电子的排布。
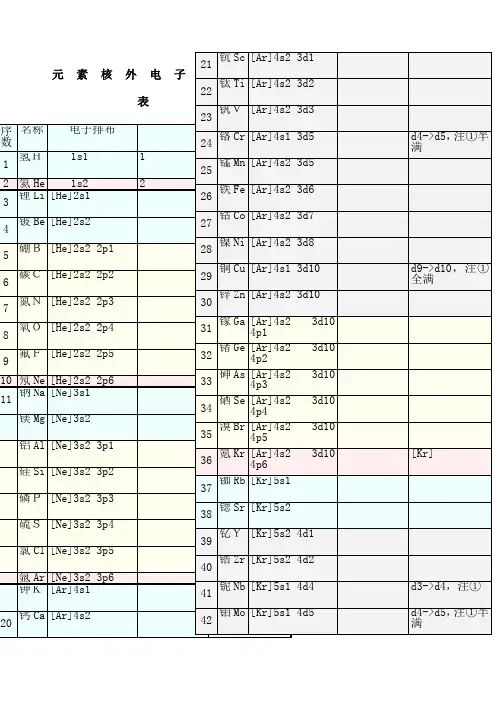
1.氢(H):1s^12.氦(He):1s^23.锂(Li):1s^22s^14.铍(Be):1s^22s^25.硼(B):1s^22s^22p^16.碳(C):1s^22s^22p^27.氮(N):1s^22s^22p^38.氧(O):1s^22s^22p^49.氟(F):1s^22s^22p^510.氖(Ne):1s^22s^22p^611.钠(Na):1s^22s^22p^63s^112.镁(Mg):1s^22s^22p^63s^213.铝(Al):1s^22s^22p^63s^23p^114.硅(Si):1s^22s^22p^63s^23p^215.磷(P):1s^22s^22p^63s^23p^316.硫(S):1s^22s^22p^63s^23p^417.氯(Cl):1s^22s^22p^63s^23p^518.钾(K):1s^22s^22p^63s^23p^64s^119.钙(Ca):1s^22s^22p^63s^23p^64s^220.钪(Sc):1s^22s^22p^63s^23p^64s^23d^121.钛(Ti):1s^22s^22p^63s^23p^64s^23d^222.钒(V):1s^22s^22p^63s^23p^64s^23d^323.铬(Cr):1s^22s^22p^63s^23p^64s^13d^524.锰(Mn):1s^22s^22p^63s^23p^64s^23d^525.铁(Fe):1s^22s^22p^63s^23p^64s^23d^626.钴(Co):1s^22s^22p^63s^23p^64s^23d^727.镍(Ni):1s^22s^22p^63s^23p^64s^23d^828.铜(Cu):1s^22s^22p^63s^23p^64s^13d^1029.锌(Zn):1s^22s^22p^63s^23p^64s^23d^1030.镓(Ga):1s^22s^22p^63s^23p^64s^23d^104p^131.锗(Ge):1s^22s^22p^63s^23p^64s^23d^104p^232.砷(As):1s^22s^22p^63s^23p^64s^23d^104p^333.锑(Sb):1s^22s^22p^63s^23p^64s^23d^104p^434.钸(Te):1s^22s^22p^63s^23p^64s^23d^104p^535.碘(I):1s^22s^22p^63s^23p^64s^23d^104p^65s^24d^105p^536.高锝(Xe):1s^22s^22p^63s^23p^64s^23d^104p^65s^24d^105p^66s^24f^145d^5以上是1-36号元素基态原子核外电子的排布方式。

目录1,氢H的核外电子排布 (1)2,氦He的核外电子排布 (2)3,锂Li的核外电子排布 (3)4,铍Be的核外电子排布 (4)5,硼B的核外电子排布 (5)6,碳C的核外电子排布 (6)7,氮N的核外电子排布 (7)8,氧O的核外电子排布 (8)9,氟F的核外电子排布 (9)10,氖Ne的核外电子排布 (10)11,钠Na的核外电子排布 (11)12,镁Mg的核外电子排布 (12)13,铝AL的核外电子排布 (13)14,硅Si的核外电子排布 (14)15,磷P的核外电子排布 (15)16,硫S的核外电子排布 (16)17,氯Cl的核外电子排布 (17)18,氩Ar的核外电子排布 (18)1,氢H的核外电子排布1.1,氢H的电子构型(电子组态)1s11.2,氢H的电子排布1s12,氦He的核外电子排布2.1,氦He的电子构型(电子组态)1s22.2,氦He的电子排布1s23,锂Li的核外电子排布3.1,锂Li的电子构型(电子组态)1s22s1[He]2s13.2,锂Li的电子排布1s22s13.3,锂Li的核外电子排布图形展示4,铍Be的核外电子排布4.1,铍Be的电子构型(电子组态)1s22s2[He]2s24.2,铍Be的电子排布1s22s24.3,铍Be的核外电子排布图形展示5,硼B的核外电子排布5.1,硼B的电子构型(电子组态)1s22s22p1[He]2s22p15.2,硼B的电子排布1s22s22p15.3,硼B的核外电子排布图形展示6,碳C的核外电子排布6.1,碳C的电子构型(电子组态)1s22s22p2[He]2s22p26.2,碳C的电子排布1s22s22p2[He]2s22p26.3,碳C的核外电子排布图形展示7,氮N的核外电子排布7.1,氮N的电子构型(电子组态)1s22s22p3[He]2s22p37.2,氮N的电子排布1s22s22p37.3,氮N的核外电子排布图形展示8,氧O的核外电子排布8.1,氧O的电子构型(电子组态)1s22s22p4[He]2s22p48.2,氧O的电子排布1s22s22p48.3,氧O的核外电子排布图形展示9,氟F的核外电子排布9.1,氟F的电子构型(电子组态)1s22s22p5[He]2s22p59.2,氟F的电子排布1s22s22p59.3,氟F的核外电子排布图形展示10,氖Ne的核外电子排布10.1,氖Ne的电子构型(电子组态)1s22s22p6[He]2s22p610.2,氖Ne的电子排布1s22s22p610.3,氖Ne的核外电子排布图形展示11,钠Na的核外电子排布11.1,钠Na的电子构型(电子组态)1s22s22p63s1[Ne]3s111.2,钠Na的电子排布1s22s22p63s111.3,钠Na的核外电子排布图形展示12,镁Mg的核外电子排布12.1,镁Mg的电子构型(电子组态)1s22s22p63s2[Ne]3s21s22s22p63s2[Ne]3s212.3,镁Mg的核外电子排布图形展示13,铝AL的核外电子排布13.1,铝AL的电子构型(电子组态)1s22s22p63s23p1[Ne]3s23p11s22s22p63s23p1[Ne]3s23p113.3,铝AL的核外电子排布图形展示14,硅Si的核外电子排布14.1,硅Si的电子构型(电子组态)1s22s22p63s23p2[Ne]3s23p21s22s22p63s23p2[Ne]3s23p214.3,硅Si的核外电子排布图形展示15,磷P的核外电子排布15.1,磷P的电子构型(电子组态)1s22s22p63s23p3[Ne]3s23p31s22s22p63s23p3[Ne]3s23p315.3,磷P的核外电子排布图形展示16,硫S的核外电子排布16.1,硫S的电子构型(电子组态)1s22s22p63s23p4[Ne]3s23p41s22s22p63s22p4[Ne]3s22p416.3,硫S的核外电子排布图形展示17,氯Cl的核外电子排布17.1,氯Cl的电子构型(电子组态)1s22s22p63s23p5[Ne]3s23p51s22s22p63s23p5[Ne]3s23p517.3,氯Cl的核外电子排布图形展示18,氩Ar的核外电子排布18.1,氩Ar的电子构型(电子组态)1s22s22p63s23p6[Ne]3s23p61s22s22p63s23p6[Ne]3s23p618.3,氩Ar的核外电子排布图形展示。
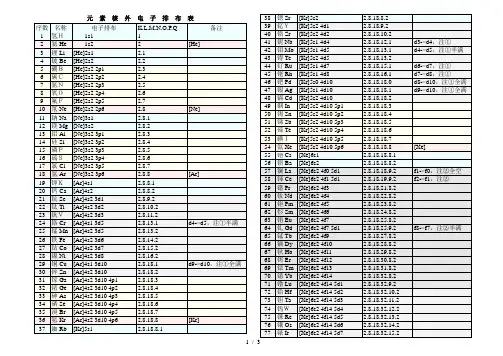
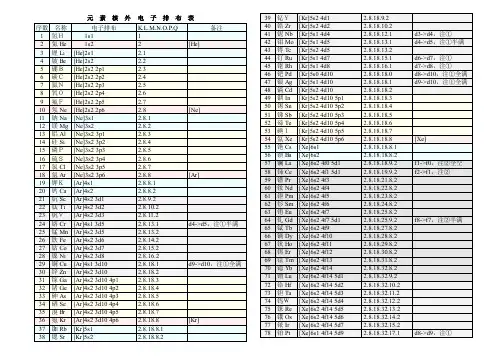
元素核外电子排布表1 / 378 铂Pt [Xe]6s1 4f14 5d9 2.8.18.32.17.1 d8->d9,注①79 金Au [Xe]6s1 4f14 5d10 2.8.18.32.18.1 d9->d10,注①全满80 汞Hg [Xe]6s2 4f14 5d10 2.8.18.32.18.281 铊Tl [Xe]6s2 4f14 5d10 6p1 2.8.18.32.18.382 铅Pb [Xe]6s2 4f14 5d10 6p2 2.8.18.32.18.483 铋Bi [Xe]6s2 4f14 5d10 6p3 2.8.18.32.18.584 钋Po [Xe]6s2 4f14 5d10 6p4 2.8.18.32.18.6 红色为放射性元素85 砹At [Xe]6s2 4f14 5d10 6p5 2.8.18.32.18.786 氡Rn [Xe]6s2 4f14 5d10 6p6 2.8.18.32.18.8 [Rn]87 钫Fr [Rn]7s1 2.8.18.32.18.8.188 镭Ra [Rn]7s2 2.8.18.32.18.8.289 锕Ac [Rn]7s2 5f0 6d1 2.8.18.32.18.9.2 f1->f0,注②全空90 钍Th [Rn]7s2 5f0 6d2 2.8.18.32.18.10.2 f2->f0,注②全空91 镤Pa [Rn]7s2 5f2 6d1 2.8.18.32.20.9.2 f3->f2,注②92 铀U[Rn]7s2 5f3 6d1 2.8.18.32.21.9.2 f4->f3,注②93 镎Np [Rn]7s2 5f4 6d1 2.8.18.32.22.9.2 f5->f4,注②94 钚Pu [Rn]7s2 5f6 2.8.18.32.24.8.295 镅Am [Rn]7s2 5f7 2.8.18.32.25.8.2 加粗为人造元素96 锔Cm [Rn]7s2 5f7 6d1 2.8.18.32.25.9.2 f8->f7,注②半满97 锫Bk [Rn]7s2 5f9 2.8.18.32.27.8.298 锎Cf [Rn]7s2 5f10 2.8.18.32.28.8.299 锿Es [Rn]7s2 5f11 2.8.18.32.29.8.2100 镄Fm [Rn]7s2 5f12 2.8.18.32.30.8.2101 钔Md [Rn]7s2 5f13 2.8.18.32.31.8.2 兰色为估计排布式102 锘No [Rn]7s2 5f14 2.8.18.32.32.8.2103 铹Lr [Rn]7s2 5f14 6d1 2.8.18.32.32.9.2104 Rf [Rn]7s2 5f14 6d2 2.8.18.32.32.10.2105 Ha [Rn]7s2 5f14 6d3 2.8.18.32.32.11.2106 [Rn]7s2 5f14 6d4 2.8.18.32.32.12.2107 [Rn]7s2 5f14 6d5 2.8.18.32.32.13.2108 [Rn]7s2 5f14 6d6 2.8.18.32.32.14.2109 [Rn]7s2 5f14 6d7 2.8.18.32.32.15.2110 [Rn]7s1 5f14 6d9 2.8.18.32.32.17.1 d8->d9,注①111 [Rn]7s1 5f14 6d10 2.8.18.32.32.18.1 d9->d10,注①全满112 [Rn]7s2 5f14 6d10 2.8.18.32.32.18.2113 [Rn]7s2 5f14 6d10 7p1 2.8.18.32.32.18.3114 [Rn]7s2 5f14 6d10 7p2 2.8.18.32.32.18.4115 [Rn]7s2 5f14 6d10 7p3 2.8.18.32.32.18.5116 [Rn]7s2 5f14 6d10 7p4 2.8.18.32.32.18.6117 [Rn]7s2 5f14 6d10 7p5 2.8.18.32.32.18.7 灰色为未发现元素118 [Rn]7s2 5f14 6d10 7p6 2.8.18.32.32.18.8注:①d亚层在s亚层外,常多填d亚层(使之趋于全满/半满),少填s亚层②d亚层在f亚层外,常多填d亚层,少填f亚层(使之趋于全空/半满)2 / 33 / 3。


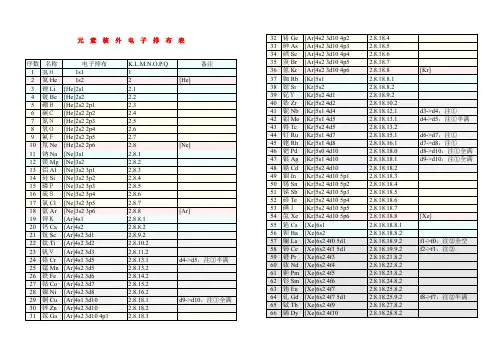
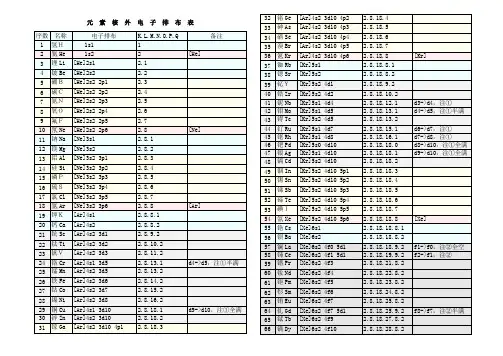


[1]H氢1s1[2]He氦1s2[3]Li锂1s2 2s1[4]Be铍1s2 2s2[5]B硼1s2 2s2 2p1[6]C碳1s2 2s2 2p2[7]N氮1s2 2s2 2p3[8]O氧1s2 2s2 2p4[9]F氟1s2 2s2 2p5[10]Ne氖1s2 2s2 2p6[11]Na钠1s2 2s2 2p6 3s1[12]Mg镁1s2 2s2 2p6 3s2[13]Al铝1s2 2s2 2p6 3s2 3p1[14]Si硅1s2 2s2 2p6 3s2 3p2[15]P磷1s2 2s2 2p6 3s2 3p3[16]S硫1s2 2s2 2p6 3s2 3p4[17]Cl氯1s2 2s2 2p6 3s2 3p5[18]Ar氩1s2 2s2 2p6 3s2 3p6[19]K钾1s2 2s2 2p6 3s2 3p6 4s1 [20]Ca钙1s2 2s2 2p6 3s2 3p6 4s2 [21]Sc钪1s2 2s2 2p6 3s2 3p6 3d1 4s2 [22]Ti钛1s2 2s2 2p6 3s2 3p6 3d2 4s21s2 2s2 2p6 3s2 3p6 3d3 4s2*[24]Cr铬1s2 2s2 2p6 3s2 3p6 3d5 4s1 [25]Mn锰1s2 2s2 2p6 3s2 3p6 3d5 4s2 [26]Fe铁1s2 2s2 2p6 3s2 3p6 3d6 4s2 [27]Co钴1s2 2s2 2p6 3s2 3p6 3d7 4s2 [28]Ni镍1s2 2s2 2p6 3s2 3p6 3d8 4s2*[29]Cu铜1s2 2s2 2p6 3s2 3p6 3d10 4s1 [30]Zn锌1s2 2s2 2p6 3s2 3p6 3d10 4s2 [31]Ga镓1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p1 [32]Ge锗1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p2 [33]As砷1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p31s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 4[35]Br 溴1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 5[36]Kr 氪1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 例3.不同元素的气态原子失去最外层一个电子所需要的能量(设其为E )如下图所示。
示。
(1)试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
同主族内不同元素的E值变化的特点是____。
各
(2)同周期同,随原子序数增大,E值增大。
但个别元素的E值出现反常现象。
试预测下列关系中正确的是_______(填写编号,多选扣分)。
①E(砷)> E(硒);
②E(砷)<E(硒);
③E(溴)>E(硒);
④E(溴)<E(硒)
(3)估计1mol气态Ca原子失去最外层一个电子所需能量E值的范围:______<E<_______。
(4)10号元素E值较大的原因是_______________。
答案:(1)同主族的元素,随着原子序数的增大,E值变小;周期性
(2)①④(3)419<E<738
(4)10号是氖,该元素原子的最外层电子排布已达8电子稳定结构,不易失去电
)也是
键类型
一.电子跃迁
在通常情况下,原子核外电子的排布总是使整个原子处于能量(“最低”、“最高”)的状态,电子从能量较高的轨道跃迁到较低轨道时,将(“释放”、“吸收”)能量。
光是电子释放能量的重要形式之一。
我们日常生活中看到的、、、、等都与原子核外电子跃迁释放能量有关。
6.下列图象中所发生的现象与电子的跃迁无关的是
A B C D
1.焰色反应是物理变化还是化学变化,能否用电子跃迁的相关知识进行解释
1.物理变化;在通常情况下,原子核外电子的排布总是使整个原子处于能量最低的状态,电子从能量较高
的轨道跃迁到较低轨道时,将释放能量。
光是电子释放能量的重要形式之一。