人教版高中化学必修2:第三章有机化合物_归纳与整理(3)
- 格式:pptx
- 大小:3.04 MB
- 文档页数:20

第三章 有机化合物知识点绝大多数含碳的化合物称为有机化合物,简称有机物。
像CO 、CO 2、碳酸、碳酸盐、金属碳化物等少数化合物,它们属于无机化合物。
一、烃1、烃的定义:仅含碳和氢两种元素的有机物称为碳氢化合物,也称为烃。
2、烃的分类:饱和烃→烷烃(如:甲烷)脂肪烃(链状)烃 不饱和烃→烯烃(如:乙烯)芳香烃(含有苯环)(如:苯)3、烷烃的概念:碳原子间都以碳碳单键结合成链状,剩余价键均与氢原子结合,使每个碳原子的化合价都达到“饱和”的饱和链烃,或称烷烃。
呈锯齿状。
4、烷烃物理性质:状态:一般情况下,1-4个碳原子烷烃为气态,5-16个碳原子为液态,16个碳原子以上为固态。
溶解性:烷烃都难溶于水,易溶于有机溶剂。
熔沸点:随着碳原子数的递增,熔沸点逐渐逐渐升高;相同碳原子数时,支链越多,熔沸点越低。
密度:随着碳原子数的递增,密度逐渐增大,但都比水的密度小。
5、烷烃的化学性质①一般比较稳定,在通常情况下跟酸、碱和高锰酸钾等都不反应。
②氧化反应:在点燃条件下,烷烃能燃烧;③取代反应(烷烃特征反应):在光照条件下能跟卤素发生取代反应6、烷烃的命名:(1)普通命名法:把烷烃泛称为“某烷”,某是指烷烃中碳原子的数目。
1-10用甲,乙,丙,丁,戊,已,庚,辛,壬,癸;11起汉文数字表示。
区别同分异构体,用“正”,“异”,“新”。
正丁烷,异丁烷;正戊烷,异戊烷,新戊烷。
(2)系统命名法:①命名步骤:(1)找主链-最长的碳链(确定母体名称);(2)编号-靠近支链(小、多)的一端;(3)写名称-先简后繁,相同基请合并.②名称组成:取代基位置-取代基名称母体名称③阿拉伯数字表示取代基位置,汉字数字表示相同取代基的个数71.氧化反应 I .燃烧C 2H 4+3O 2−−→−点燃2CO 2+2H 2O (火焰明亮,伴有黑烟) II .能被酸性KMnO 4溶液氧化为CO 2,使酸性KMnO 4溶液褪色。
2.加成反应CH 2=CH 2+Br 2−→−CH 2Br -CH 2Br (能使溴水或溴的四氯化碳溶液褪色) 在一定条件下,乙烯还可以与H 2、Cl 2、HCl 、H 2O 等发生加成反应CH 2=CH 2+H 2CH 3CH 3CH 2=CH 2+HCl CH 3CH 2Cl (氯乙烷:一氯乙烷的简称) CH 2=CH 2+H 2OCH 3CH 2OH (工业制乙醇)3.加聚反应 nCH 2=CH 2(聚乙烯)注意:①乙烯能使酸性KMnO 4溶液、溴水或溴的四氯化碳溶液褪色。
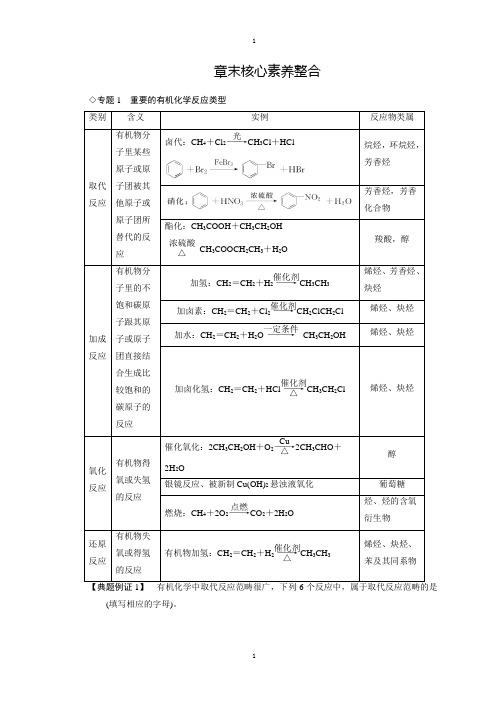
章末核心素养整合◇专题1重要的有机化学反应类型酯化:CH3COOH+CH3CH2OH浓硫酸△CH3COOCH2CH3+H2O________(填写相应的字母)。
C .2CH 3CH 2OH ――→浓硫酸140 ℃CH 3CH 2OCH 2CH 3+H 2OE .CH 3COOH +CH 3OH浓硫酸△CH 3COOCH 3+H 2O注意 式中R 为正十七烷基CH 3(CH 2)15CH 2—。
解析 取代反应即有机物分子中的原子或原子团被其他原子或原子团所代替的反应,常包括卤代、硝化、磺化、酯化、皂化、水解等。
由题给反应看,A 为硝化反应;C 为两个醇分子间脱水可看成1个CH 3CH 2OH 中的H 原子被另1个CH 3CH 2OH 中的CH 3CH 2-所代替;E 为酯化反应;F 为水解反应,它们都属于取代反应。
而B 属于消去反应,D 属于加成反应,不属于取代反应。
答案 A 、C 、E 、F【典题例证2】 今有五种有机物: ①CH 2OH(CHOH)4CHO ,②CH 3(CH 2)3OH ,其中既能发生加成反应、加聚反应、酯化反应,又能发生氧化反应的是( ) A .③⑤ B .①②⑤ C .②④D .③④解析 能发生加成反应的是①③④⑤,能发生加聚反应的是③④⑤,②③⑤可发生酯化反应,五种有机物都可发生氧化反应,能同时发生上述四种反应的只有③⑤。
答案 A【典题例证3】根据下面的反应路线及所给信息填空。
①的反应类型为____________。
③的反应类型为____________。
解析根据甲烷与氯气在光照条件下可发生取代反应,判断出①为取代反应。
由乙烯与溴单质的加成反应知,环己烯与溴的四氯化碳溶液发生的反应③为加成反应。
答案①取代反应③加成反应◇专题2有机物推断题的解题思路和方法首先剖析题意,分离出已知条件和推断内容,弄清被推断物质和其他有机物的关系,其次是抓住解题关键,找准解题突破口,然后联系信息和有关知识,应用规律进行逻辑推理或计算分析,排除干扰,精心筛选,最后做出正确的推断。

人教版化学必修二第三章有机物知识点第三章有机化合物绝大多数含碳的化合物被称为有机化合物,简称有机物。
像CO、CO2碳酸、碳酸盐等少数化合物,由于它们的组成和性质与无机化合物相似,因此一直被归类为无机化合物。
一、烃1、烃的定义:仅含碳和氢两种元素的有机物称为碳氢化合物,也称为烃。
2、烃的分类:饱和烃→烷烃(例如甲烷)脂肪烃(链状)不饱和烃→烯烃(例如乙烯)芳香烃(含有苯环)(例如苯)3、甲烷、乙烯和苯的性质比较:有机物通式代表物结构简式烷烃 CnH2n+2 甲烷(CH4CH4烯烃 CnH2n 乙烯(C2H4CH2CH2苯及其同系物——苯(C6H6或(官能团)结构特点空间结构物理性质C-C单键,链状,饱和烃正四面体无色无味的气体,比空气轻,难溶于水用途优良燃料,化工原料C=C双键,链状,不饱和烃六原子共平面无色稍有气味的气体,比空气略轻,难溶于水石化工业原料,植物生长调节剂,催熟剂一种介于单键和双键之间的独特的键,环状平面正六边形无色有特殊气味的液体,比水轻,难溶于水溶剂,化工原料烷烃:甲烷主要化学性质1.氧化反应(燃烧)CH42O2CO22H2O(淡蓝色火焰,无黑烟)2.取代反应(注意光是反应发生的主要原因,产物有5种)CH4Cl2CH3Cl+HClCH3Cl +Cl2CH2Cl2 HClCH 2Cl2Cl2 CHCl3 HClCHCl 3Cl2 XXX4HCl在光照条件下,甲烷还可以与溴蒸气发生取代反应。
甲烷不能使酸性KMnO4溶液、溴水或溴的四氯化碳溶液褪色。
烯烃:乙烯主要化学性质1.氧化反应ⅰ)燃烧C2H43O22CO22H2O(火焰明亮,有黑烟)ⅱ)被酸性KMnO4溶液氧化,能使酸性KMnO 4溶液褪色。
2.加成反应CH2CH2Br2CH2Br-CH2Br(能使溴水或溴的四氯化碳溶液褪色)在一定条件下,乙烯还可以与H2Cl2XXX、H2O等发生加成反应。
第三章有机化合物绝大多数含碳的化合物被称为有机化合物,简称有机物。

第三章有机化合物知识点归纳一、有机物的结构与性质1、官能团的定义:决定有机化合物化学特性的原子、原子团或化学键。
"原子:一X (氟、氯、漠、碘原子)官能团V原子团(基):一0H、—CHO (醛基)、—COOH (殄基)、一NO2等、化学键:>C=C < —c=c—2、常见的各类有机物的官能团,结构特点及主要化学性质(1)烷炷A)____________________________________ 官能团:无;通式:;代表物:CH4B)___________________________ 结构特点:键角为_______________ ,空间结构为oC)化学性质:①取代反响(与卤素单质、在光照条件下):CH4 + C12 _____________ CH3CI + C12 _____________②氧化反响:燃烧:_________________________________③热分解CH4同温》C + 2H2隔绝空气(2)烯炷:A)________________________ 官能团:_______________________________ ;通式(链状单烯炷):_________________ (n>2);代表物:CH2二CH2B)_________________________________ 结构特点:键角约为______________ o空间结构为_________________________________ 。
C)化学性质:①加成反响(与X2、H2、HX、H2。
等)(写出方程)②加聚反响(写出方程)CH2=CH2:_______________________________CH2CHCH3 ___________________________________________________③氧化反响:燃烧氧化;被高镒酸钾氧化(3)苯及苯的同系物:A)___________________ 通式:(H>6);代表U)"CH3B)________________________________ 结构特点:苯分子中键角为____ ,空间结构为C)苯的化学性质:①取代反响(与液漠、浓HNO3等)(写出方程)②加成反响(与H2)③ __________________________________________________________________ 氧化反响:燃烧: _______________________________________________________________ 火焰明亮并伴有浓烟D)甲苯的化学性质:①取代反响(与液漠、浓HNO3等)(写出与液漠反响的方程)②加成反响(与H2)③氧化反响:a:燃烧氧化B使高镐酸钾褪色,生成苯甲酸(4)乙醇:A)官能团: ____________B)结构特点:羟基取代乙烷分子的氢原子而得到的产物,是炷的衍生物C)化学性质:①羟基氢原子被活泼金属置换的反响CH3CH2OH 与Na:______________________________________________________HOCH2CH2OH 与Na:______________________________________________________②氧化反响:a:发生燃烧氧化b:被高镒酸钾氧化为__________________c:催化氧化(断____________ 键和 __________________________________________ )CH3CH2OH的催化氧化:______________________________________________________ CH3CHOHCH3的催化氧化:___________________________________________________③取代反响:酯化反响CH3COOH 与CH3CH2OH 酯化:_______________________________________________ CH3COOH 与CH3CHOH CH3 酉旨化:(5)乙酸A) _________________ 官能团:;B)化学性质:①具有无机酸的通性CH3COOH的电离方程:_____________________________________________________ CH3COOH能与弱酸盐:如碳酸钠、碳酸氢钠反响;与碱:氢氧化钠反响;与金属钠等氢前金属反响。

第三章 有机化合物(复习提纲)绝大多数含碳的化合物称为有机化合物,简称有机物。
像CO 、CO 2、碳酸、碳酸盐等少数化合物,由于它们的组成和性质跟无机化合物相似,因而一向把它们作为无机化合物。
一、烃1、烃的定义:仅含碳和氢两种元素的有机物称为碳氢化合物,也称为烃。
2、烃的分类:饱和烃→烷烃(如:甲烷)脂肪烃(链状)烃 不饱和烃→烯烃(如:乙烯)芳香烃(含有苯环)(如:苯)3[ A.过渡元素的化合物 C.第三主族元素的化合物2.下列物质属于有机物的是( )34CO 343.下列物质中,属于有机物但不属于烃的是( )A.CO 2B.CH 3COOHC.Na 2CO 3D.CH 44.下列物质不属于饱和链烃的是( )A.CH 4B.C 3H 8C.C 4H 8D.C 5H 125.以下关于甲烷的说法中错误的是( )6.下列气体的主要成分不是甲烷的是( )7.衡量石油化工发展水平的标志是( )9.在光照条件下,甲烷与氯气反应得到的产物是()①CH3Cl ②CH2Cl2③CHCl3④CCl4①② C. ①和②的混合物 D. ①②③④的混合物10.聚乙烯是由乙烯(CH2=CH2)通过聚合反应形成的。
下列说法中错误的是()A.乙烯是不饱和烃B.聚乙烯分子中含有双键C.聚乙烯中碳的质量分数是85.7%D.聚乙烯制品在自然环境中很难降解11.等物质的量的甲烷和氯气混合后,在漫射光的照射下充分反应,生成物中的物质的量最大的是()2Cl2C. CH3Cl D. CCl412.甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,最好依次通过盛有()试剂的洗气瓶A.澄清石灰水,浓H2SO44溶液、浓H2SO4C.溴水,浓H2SO42SO4,酸性KMnO4溶液13.1 mol CH4完全和Cl2发生取代反应,并生成等物质的量的四种氯代物,则需要Cl2的物质的量为()A. 4molB. 3mol mol mol14.下列关于苯的性质的叙述中,不正确的是()A. 苯是无色带有特殊气味的液体B. 常温下苯是一种不溶于水且密度比水小的液体C. 苯在一定条件下能与溴发生取代反应D. 苯不具有典型的双键所具有的加成反应的性能,故不可能发生加成反应15.制取一氯乙烷最好的方法是( )22反应烯与HCl反应2、Cl2反应16.利用下列反应不能制得括号中的纯净物质的是()A.乙烯和氯气加成(1,2-二氯乙烷)水加成(乙醇)C.等物质的量的氯气与乙烷在光照条件下反应(氯乙烷)D.氯气与苯用氯化铁作催化剂反应(氯苯)概念同系物同分异构体同素异形体同位素定义结构相似,在分子组成上相差一个或若干个CH2原子团的物质分子式相同而结构式不同的化合物的互称由同种元素组成的不同单质的互称质子数相同而中子数不同的同一元素的不同原子的互称分子式不同相同元素符号表示相同,分子式可不同——结构相似不同不同——研究对象化合物化合物单质原子2651224263CH2CH2CH3和CH3CH(CH3)2F. 35Cl和37Cl E.属于同分异构体的是();属于同素异形体的是();属于同系物的是();属于同位素的是();属于同种物质的是()。

第三章 有机化合物复习一:同分异物性化性不同相同类别构体同系物同素异形体同位素比较项目原子质子数中子数单质元素种类单质内部结构有机物结构通式分子式化合物分子式结构4、“四同”比较相同相似相似相似或不同不同不同相似但递变不同二、有机反应类型1、取代反应(卤代、硝化、酯化、水解)有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。
2、加成反应(加聚反应)有机物分子中不饱和键(双键或三键)两端的原子与其他原子或原子团结合生成新的化合物的反应。
3、氧化反应(燃烧、催化氧化、使酸性高锰酸钾溶液褪色)甲烷的化学性质 1. 氧化反应(燃烧):甲烷 使酸性高锰酸钾溶液褪色 2.取代反应:3.分解反应:乙烯的化学性质OH CO O CH 222422+−−→−+点燃CH 4 + Cl 2 CH 3Cl + HCl 光照1、氧化反应(1)可燃性火焰明亮有黑烟(2) 能 使酸性高锰酸钾溶液褪色。
2、加成反应3、加聚反应苯的化学性质1、氧化反应(1)可燃性:火焰 明亮 有 浓烟 。
(2)苯 不能 使酸性KMnO4溶液褪色。
2、取代反应 (1)溴代反应 (2)硝化反应 3、加成反应H 2H 2H 2 H 2H 2△+ Br 2Br Br nH 2C=CH 2[H 2C —CH 2]n一定条件三、烃类烃链烃饱和链烃不饱和链烃烯烃炔烃(烷烃)芳香烃通式:键的特点:特征反应:代表物:通式:键的特点:特征反应:代表物:C n H 2n+2(n ≥1)碳碳单键,饱和取代反应C n H 2n (n ≥2)碳碳双键,不饱和加成反应碳碳三键,不饱和加成CH 4H 2C=CH 2特殊的键,不饱和代表物:成键的特点:苯(C 6H 6)键的特点:特征反应:空间结构能否使分子式苯乙烯甲烷KMnO 4(H+)褪色能否使溴水褪色加成反应取代反应碳碳键型状态介于单键和双键之间的独特的键单键双键正四面体平面型平面型能不能能不能能能不能能不能(但能萃取)不能能不能气体气体液体CH 4C 2H 4C 6H 6四、烃的衍生物 乙醇1、 乙醇的分子结构2、 结构式:2、乙醇的化学性质结构简式:CH 3CH 2OH 或(1)与活泼金属反应(2)氧化反应 ①燃烧② 催化氧化③可以使酸性KMnO4溶液褪色 (3)酯化反应 ⑷、乙醇的脱水反应乙醇分子内的羟基与相邻碳原子上的氢原子结合成了水分子,结果是生成不饱和的碳碳双键。
化学必修2第三章有机知识点总结1.有机物的溶解性(1)难溶于水的有:各类烃、卤代烃、硝基化合物、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。
(2)易溶于水的存有:低级的[通常指N(C)≤4]醇、(醚)、醛、(酮)、羧酸及盐、氨基酸及盐、单糖、二糖。
(它们都能够与水构成氢键)。
(3)具有特殊溶解性的:① 乙醇就是一种较好的溶剂,既能够熔化许多无机物,又能够熔化许多有机物,所以常用乙醇去熔化植物色素或其中的药用成分,也常用乙醇做为反应的溶剂,并使出席反应的有机物和无机物均能够熔化,减小碰触面积,提升反应速率。
比如,在油脂的皂化反应中,重新加入乙醇既能够熔化NaOH,又能够熔化油脂,使它们在均二者(同一溶剂的溶液)中充份碰触,大力推进反应速率,提升反应限度。
②苯酚:室温下,在水中的溶解度是9.3g(属可溶),易溶于乙醇等有机溶剂,当温度高于65℃时,能与水混溶,冷却后分层,上层为苯酚的水溶液,下层为水的苯酚溶液,振荡后形成乳浊液。
苯酚易溶于碱溶液和纯碱溶液,这是因为生成了易溶性的钠盐。
③ 乙酸乙酯在饱和状态碳酸钠溶液中更加容易溶,同时饱和状态碳酸钠溶液还能够通过反应稀释握收到的乙酸,熔化稀释握收到的乙醇,易于刺鼻乙酸乙酯的香味。
④ 有的淀粉、蛋白质可溶于水形成胶体。
蛋白质在浓轻金属盐(包括铵盐)溶液中溶解度减小,会析出(即盐析,皂化反应中也有此操作)。
但在稀轻金属盐(包括铵盐)溶液中,蛋白质的溶解度反而增大。
⑤线型和部分支链型高聚物可以溶某些有机溶剂,而体型则容易溶有机溶剂。
⑥ 氢氧化铜悬浊液可溶于多羟基化合物的溶液中,如甘油、葡萄糖溶液等,形成绛蓝色溶液。
2.有机物的密度(1)小于水的密度,且与水(溶液)分层的有:各类烃、一氯代烃、酯(包括油脂)(2)大于水的密度,且与水(溶液)分层的存有:多氯代烃、溴代烃(溴苯等)、碘代烃、硝基苯4.既能与强酸,又能与强碱反应的物质(1)2Al + 6H+ == 2 Al3+ + 3H2↑ 2Al + 2OH- + 2H2O == 2 AlO2- + 3H2↑(2)Al2O3 + 6H+ == 2 Al3+ + 3H2O Al2O3 + 2OH- == 2 AlO2- + H2O(3)Al(OH)3 + 3H+ == Al3+ + 3H2O Al(OH)3 + OH- == AlO2- + 2H2O(4)弱酸的酸式盐,如NaHCO3、NaHS等等NaHCO3 + HCl == NaCl + CO2↑ + H2O NaHCO3 + NaOH == Na2CO3 + H2ONaHS + HCl == NaCl + H2S↑ NaHS + NaOH == Na2S + H2O(5)弱酸弱碱盐,如CH3COONH4、(NH4)2S等等2CH3COONH4 + H2SO4 == (NH4)2SO4 + 2CH3COOHCH3COONH4 + NaOH == CH3COONa + NH3↑+ H2O(NH4)2S + H2SO4 == (NH4)2SO4 + H2S↑(NH4)2S +2NaOH == Na2S + 2NH3↑+ 2H2O(6)氨基酸,如甘氨酸等H2NCH2COOH + HCl → HOOCCH2NH3ClH2NCH2COOH + NaOH → H2NCH2COONa + H2O(7)蛋白质蛋白质分子中的肽链的链端或支链上仍有呈酸性的―COOH和呈碱性的―NH2,故蛋白质仍能与碱和酸反应。
2009年东莞中学高一化学复习材料第三章《有机化合物》知识总结一、常用一些物质的物理性质的总结(1)四氯化碳,硝基苯,溴苯等物质,密度比水大,无色不溶于水。
(2)烷烃,酯,油脂,苯等物质,密度比水小,无色不溶于水。
(3)乙醇,乙酸等物质和水互溶,有机物之间互溶(4)烃类沸点规律:总碳原子越多,沸点越高;同碳原子,支链越多,沸点越低。
练习:1、能用于鉴别水,苯、乙醇、四氯化碳的一种试剂()A、溴水B、酸性KMnO4溶液C、金属钠D、碳酸钠溶液2、只用水不能鉴别的一组物质是()A.乙醇和乙酸B.乙酸乙酯和乙醇C.苯和四氯化碳D.溴水和溴苯3、下列五种烃①2—甲基丁烷②2,2—二甲基丙烷③戊烷④丙烷⑤丁烷,按它们的沸点由高到低的顺序排列正确的是A.①②③④⑤B.②③④⑤①C. ④⑤②①③D.③①②⑤④KEY: 1、B 2、A 3 D二、主要官能团的化学性质的总结1、C=C 主要的性质:(1)加成(卤素,卤化氢,水等)(2)使酸性KMnO4褪色,同时有二氧化碳气体生成。
2、-OH的主要性质:(1)与活泼金属钠,钾,钙,镁等反应,反应类型置换或取代(2)乙醇在Cu或Ag催化剂下催化氧化生成乙醛;使酸性KMnO4褪色,使重铬酸钾从橙色变为绿色,并且生成乙酸。
(3)酯化反应(或叫取代反应)3、-COOH的主要性质:(1)酸的通性:使酸碱指示剂,与活泼金属,与碱,与某些盐反应(2)酯化反应(或叫取代反应)4、-COOR 酯基:水解反应:在酸性条件生成酸和醇;在碱性条件,与氢氧化钠反应,生成羧酸盐和醇例如:CH3COOCH2CH3 + H2O CH3COOH+ CH3CH2OHCH3COOCH2CH3 + NaOH == CH3COONa+ CH3CH2OH5、-CHO的主要性质:与新制备的氢氧化铜或银氨溶液反应练习:1、下列变化,是通过取代反应来实现的是()A.CH3CH2OH ─→CH3CHO B.CH2=CH2 ─→ CH3-CH2BrC─→ NO2D.CH3COOH ─→ CH3COOC2H52..的是A.莽草酸的分子式为C7H4O5B.莽草酸的分子之间可能发生酯化反应C.莽草酸中含有苯环D.莽草酸能使溴水褪色3.某有机物的结构为下图所示,这种有机物不可能具有的性质是()①可以燃烧;②能使酸性KMnO4溶液褪色;—OHOHHO C—O—CH2CH=CH2CH2OH—COOH③能跟NaOH溶液反应;④能发生酯化反应;⑤能发生加聚反应;⑥能发生水解反应A.①④B.只有⑥C.只有⑤D.④⑥4、苹果酸(HOOC—CH—CH2COOH常用于汽水、糖果的添加剂,OH写出苹果酸分别与下列物质反应的化学方程式①Na②Na2CO3③CH3CH2OH(H2SO4,△)KEY; 1 C D 2 BD 3 B4 ①2HOOC—CH—CHCOOH + 6Na ─→ 2NaOOC—CH—CH2COONa + 3H22OH ONa②HOOC—CH—CH2COOH + Na2CO3─→2NaOOC—CH—CH2COONa + H2O+CO2OH OHHOOC—CH—CH2COOH + CH3CH2OH CH3CH2O OOC—CH—CH2COOCH2CH3 + 2H2O OH OH三、去杂质1、已知乙烯能被酸性高锰酸钾溶液氧化成CO2。