某二组分凝聚系统相图如右图汇总
- 格式:ppt
- 大小:161.00 KB
- 文档页数:5
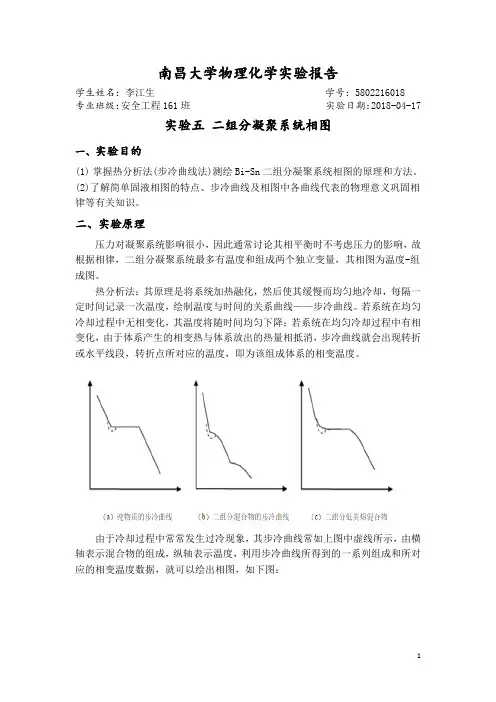
南昌大学物理化学实验报告学生姓名:李江生学号:5802216018专业班级:安全工程161班实验日期:2018-04-17实验五二组分凝聚系统相图一、实验目的(1)掌握热分析法(步冷曲线法)测绘Bi-Sn二组分凝聚系统相图的原理和方法。
(2)了解简单固液相图的特点、步冷曲线及相图中各曲线代表的物理意义巩固相律等有关知识。
二、实验原理压力对凝聚系统影响很小,因此通常讨论其相平衡时不考虑压力的影响,故根据相律,二组分凝聚系统最多有温度和组成两个独立变量,其相图为温度-组成图。
热分析法:其原理是将系统加热融化,然后使其缓慢而均匀地冷却,每隔一定时间记录一次温度,绘制温度与时间的关系曲线——步冷曲线。
若系统在均匀冷却过程中无相变化,其温度将随时间均匀下降;若系统在均匀冷却过程中有相变化,由于体系产生的相变热与体系放出的热量相抵消,步冷曲线就会出现转折或水平线段,转折点所对应的温度,即为该组成体系的相变温度。
由于冷却过程中常常发生过冷现象,其步冷曲线常如上图中虚线所示,由横轴表示混合物的组成,纵轴表示温度,利用步冷曲线所得到的一系列组成和所对应的相变温度数据,就可以绘出相图,如下图:简单低共熔混合物二组分系统步冷曲线及相图三、仪器与药品步冷曲线测定装置1套(可控升降温电炉1台,数字控温仪1台,控温探头I,测温探头Ⅱ),不锈钢试样管5只,坩埚钳1把,劳保手套1副,Sn、Bi及其合金。
四、实验步骤1、将数字控温仪温度Ⅰ设定为320℃,按“工作/置数”按钮,切换到工作状态。
传感器Ⅰ插入加热炉Ⅰ样品管口内;传感器Ⅱ插入加热炉Ⅱ样品管口内;加热到320℃;2、将“冷风量调节”旋钮逆时针旋到底,加热使温度降为250℃左右后;3、适当调节“冷风量调节”旋钮,使温度降温绘制步冷曲线,降温速率控制为6-8℃/min,以便找到曲线拐点;4、打开金属相图软件,设置绘步冷曲线图坐标;5、实验结束后,关闭仪器电源,将实验桌面整理干净。

第六章相平衡练习题、是非题,下列各题的叙述是否正确,对的画V错的画X1、纯物质两相达平衡时,两相的吉布斯函数值一定相等。
()2、理想液态混合物与其蒸气达成气、液两相平衡时,气相总压力p与液相组成X B呈线性关系。
()3、已知Cu-Ni可以形成完全互溶固熔体,其相图如右图,理论上,通过精炼可以得到两个纯组分。
()4、二组分的理想液态混合物的蒸气总压力介于二纯组分的蒸气压之间。
()5、在一定温度下,稀溶液中挥发性溶质与其蒸气达到平衡时气相中的分压与该组分在液相中的组成成正比。
()6 恒沸混合物的恒沸温度与恒沸组成不随压力而改变。
()7、在一个给定的体系中,特种数可以分析问题的角度不同而不同,但独立组分数是一个确定的数。
()8、自由度就是可以独立变化的变量。
()9、单组分体系的相图中两相平衡线都可以用克拉贝龙方程定量描述。
()10、在相图中总可以利用杠杆规则计算两相平衡时两相的相对量。
()二、选择题1、在p下,用水蒸气蒸馏法提纯某不溶于水的有机物时,系统的沸点:()(1)必低于373.2 K;(2)必高于373.2 K;(3)取决于水与有机物的相对数量;(4)取决于有机物相对分子质量的大小。
2、已知A(l)、B(l)可以组成其t-x(y)图具有最大恒沸点的液态完全互溶的系统,则将某一组成的系统精馏可以得到:()。
(1)两个纯组分;(2)两个恒沸混合物;(3)一个纯组分和一个恒沸混合物。
3、已知A和B可构成固溶体,在组分A中,若加入组分B可使固溶体的熔点提高,则组B在此固溶体中的含量必__________ 分B在组分液相中的含量。
(1)大于;(2)小于;(3)等于;(4)不能确定。
4、硫酸与水可形成H2SO4H2OG), H2SO42H2OG), H2SO44H2OG)三种水合物,问在101325 Pa的压力下,能与硫酸水溶液及冰平衡共存的硫酸水合物最多可有多少种?()(1)3种;(2) 2种;(3) 1种;(4)不可能有硫酸水合物与之平衡共存5、对恒沸混合物的描写,下列各种叙述中哪一种是不正确的?(1)与化合物一样,具有确定的组成;(2)恒沸混合物的组成随压力的改变而改变;(3)平衡时,气相和液相的组成相同;(4)其沸点随外压的改变而改变。

第六章 相平衡指出下列平衡系统中的组分数C ,相数P 及自由度数F 。
(1) I 2(s)与其蒸气成平衡;(2) MgCO 3(s)与其分解产物MgO(s)和CO 2(g)成平衡;(3) NH 4Cl(s)放入一抽空的容器中,与其分解产物NH 3(g)和HCl (g) 成平衡; (4) 取任意量的NH 3(g)和H 2S (g)与NH 4HS(g)成平衡;(5) 过量的NH 4HCO 3(s)与其分解产物NH 3(g),H 2O(g)和CO 2(g) 成平衡; (6) I 2作为溶质在两不互溶液体H 2O 和CCl 4中达到分配平衡(凝聚系统)。
解:(1)C =1,P =2,21F C P =-+=;(2)C =2,P =3,21F C P =-+=; (3)C =1,P =2,21F C P =-+=; (4)C =2,P =2,22F C P =-+=; (5)C =1,P =2,21F C P =-+=; (6)C =3,P =2,12F C P =-+=。
常见的Na 2CO 3(s)水合物有Na 2CO 3•H 2O (s),Na 2CO 3•7H 2O(s)和 Na 2CO 3•10H 2O (s) (1)下,与Na 2CO 3水溶液及冰平衡共存的水合物最多能有几种 (2)20℃时,与水蒸气平衡共存的水合物最多能可能有几种 解: S =5,R =3,R '=0,C =SR R '=2,F =C P +1=3P ,F mix =0,P max =3;(1)已有两相(水溶液、冰),只能有一种水合物与其共存; (2)已有一相(水蒸气),有二种水合物与其共存。
A-B 二组分液态部分互溶系统的液-固平衡相图如附图所示,试指出各个项区的平衡关系,各条线所代表的意义,以及三相线所代表的平衡关系。
解:单相区:1:A 和B 的混合溶液l ;二相区:2:l 1+ l 2;3:l 2+ B(s);4:l 1+ A(s); 5:l 1+ B(s);6:A(s)+B(s) 各条线代表的意义:LJ :A 的凝固点降低曲线; JM :B 的凝固点降低曲线;A BL MNOUVIJK123456NV :B 的凝固点降低曲线; MUN :液液相互溶解度曲线。


![532003[物理化学] 天津大学考试题库及答案](https://uimg.taocdn.com/6bf764b0e2bd960590c677bd.webp)
1 / 4物理化学复习题一、选择题1、 101.325 kPa 下,100℃的液态水气化为同温度的水蒸气,系统的 熵变∆S sys ( )0。
A. >B. <C. =D. ≤2、ζ 电势表示溶胶粒子带电量的多少,它可通过( )实验来进行测定。
A. 丁铎尔B. 沉降C. 电泳D. 电渗3、在电答案过程中,随着电流密度增大,则( )。
A. 阳极电极电势降低,阴极电极电势升高;B. 阳极电极电势升高,阴极电极电势降低;C. 电答案池分答案电压降低;D. 电答案池能量效率升高。
4、已知某电导池的电导池系数为22.81 m -1,当其中盛有一定浓度的KCl 溶液时,测得电阻为326.0 Ω,则该KCl 溶液的电导率κ 为( )S·m -1。
A. 0.02799B. 0.06997C. 0.02388D. 8.37325、物质临界点处()cm /T p V ∂∂等于( )。
A. -1 B. 0 C. 1 D. 26、A 、B 两液体的混合物在T -x 图上出现最低点,则该混合物对拉乌尔定律产生( )。
A. 一般正偏差B. 一般负偏差C. 最大正偏差D. 最大负偏差 7、25℃时,若要使电池 Pt│H 2(g, p 1)│H +(a )│H 2(g, p 2)│Pt 的电动势E 为正值,则必须使( )。
A. 12p p =B. 12p p >C. 12p p <D. 12p p 、可任意取值8、向液体中加入表面活性物质后( )。
A. d 0d cγ<,产生正吸附 B. d 0d c γ>,产生负吸附 C. d 0d c γ>,产生正吸附 D. d 0d cγ<,产生负吸附 9、电泳现象说明( )。
A. 分散介质带电B. 胶体粒子带电C. 胶体粒子带正电荷D. 胶体粒子处于等电状态10、20℃时水的饱和蒸气压为2.338 kPa ,则此温度下液态水变成水蒸气的条件是气相中水的分压( )。



第六章相平衡6.1指出下列平衡系统中的组分数C,相数P及自由度F。
(1)I2(s)与其蒸气成平衡;(2)CaCO3(s)与其分解产物CaO(s)和CO2(g)成平衡;(3)NH4HS(s)放入一抽空的容器中,并与其分解产物NH3(g)和H2S(g)成平衡;(4)取任意量的NH3(g)和H2S(g)与NH4HS(s)成平衡。
(5)I2作为溶质在两不互溶液体H2O和CCl4中达到分配平衡(凝聚系统)。
解:(1)C = 1, P = 2, F = C–P + 2 = 1 – 2 + 2 = 1.(2)C = 3 – 1 = 2, P = 3, F = C–P + 2 = 2 – 3 + 2 = 1.(3)C = 3 – 1 – 1 = 1, P = 2, F = C–P + 2 = 1 – 2 + 2 = 1.(4)C = 3 – 1 = 2, P = 2, F = C–P + 2 = 2 – 2 + 2 = 2.(5)C = 3, P = 2, F = C–P + 1 = 3 – 2 + 1 = 2.6.2已知液体甲苯(A)和液体苯(B)在90 C时的饱和蒸气压分别为=和。
两者可形成理想液态混合物。
今有系统组成为的甲苯-苯混合物5 mol,在90 C下成气-液两相平衡,若气相组成为求:(1)平衡时液相组成及系统的压力p。
(2)平衡时气、液两相的物质的量解:(1)对于理想液态混合物,每个组分服从Raoult定律,因此(2)系统代表点,根据杠杆原理6.3单组分系统的相图示意如右图。
试用相律分析途中各点、线、面的相平衡关系及自由度。
解:单相区已标于图上。
二相线(F = 1):三相点(F = 0):图中虚线表示介稳态。
6.4已知甲苯、苯在90 ︒C下纯液体的饱和蒸气压分别为54.22 kPa和136.12 kPa。
两者可形成理想液态混合物。
取200.0 g甲苯和200.0 g苯置于带活塞的导热容器中,始态为一定压力下90 ︒C的液态混合物。


第六章相平衡练习题一、是非题,下列各题的叙述是否正确,对的画√错的画×1、纯物质两相达平衡时,两相的吉布斯函数值一定相等。
()2、理想液态混合物与其蒸气达成气、液两相平衡时,气相总压力p与液相组成x呈线性关系。
()B3、已知Cu-Ni 可以形成完全互溶固熔体,其相图如右图,理论上,通过精炼可以得到两个纯组分。
()4、二组分的理想液态混合物的蒸气总压力介于二纯组分的蒸气压之间。
( )5、在一定温度下,稀溶液中挥发性溶质与其蒸气达到平衡时气相中的分压与该组分在液相中的组成成正比。
()6、恒沸混合物的恒沸温度与恒沸组成不随压力而改变。
( )7、在一个给定的体系中,特种数可以分析问题的角度不同而不同,但独立组分数是一个确定的数。
()8、自由度就是可以独立变化的变量。
()9、单组分体系的相图中两相平衡线都可以用克拉贝龙方程定量描述。
()10、在相图中总可以利用杠杆规则计算两相平衡时两相的相对量。
( )二、选择题1、在p下,用水蒸气蒸馏法提纯某不溶于水的有机物时,系统的沸点:()。
(1)必低于 K;(2)必高于 K;(3)取决于水与有机物的相对数量;(4)取决于有机物相对分子质量的大小。
2、已知A(l)、B(l)可以组成其t-x(y)图具有最大恒沸点的液态完全互溶的系统,则将某一组成的系统精馏可以得到:( )。
(1)两个纯组分;(2)两个恒沸混合物;(3)一个纯组分和一个恒沸混合物。
3、已知A和B 可构成固溶体,在组分A 中,若加入组分B 可使固溶体的熔点提高,则组B 在此固溶体中的含量必________组分B 在组分液相中的含量。
(1)大于;(2)小于;(3)等于;(4)不能确定。
4、硫酸与水可形成H2SO4H2O(s),H2SO42H2O(s),H2SO44H2O(s)三种水合物,问在101325 Pa的压力下,能与硫酸水溶液及冰平衡共存的硫酸水合物最多可有多少种( )(1) 3种; (2) 2种; (3) 1种; (4) 不可能有硫酸水合物与之平衡共存5、对恒沸混合物的描写,下列各种叙述中哪一种是不正确的(1) 与化合物一样,具有确定的组成;(2) 恒沸混合物的组成随压力的改变而改变;(3) 平衡时,气相和液相的组成相同;(4) 其沸点随外压的改变而改变。
第六章 相平衡6-1 指出下列平衡系统中的组分数C ,相数P 及自由度数F : (1)I 2(s )与其蒸气成平衡;(2)CaCO 3(s )与其分解产物CaO (s )和CO 2(g )成平衡;(3)NH 4HS(s)放入一抽空的容器中,并与其分解产物NH 3(g)和H 2S(g)成平衡; (4)取任意量的NH 3(g)和H 2S(g)与NH 4HS(s)成平衡;(5) I 2作为溶质在两不相互溶液体H 2O 和CCl 4中达到分配平衡(凝聚系统)。
解:(1) S-R-R '=1-0-0=1;P=2;F=C-P+2=1 (2) S-R-R '=3-1-0=2;P=3;F=C-P+2=1 (3) S-R-R '=3-1-1=1;P=2;F=C-P+2=1 (4) S-R-R '=3-1-0=2;P=2;F=C-P+2=2 (5) S-R-R '=3-0-0=3;P=2;F=C-P+1=2 6-2常见的)(32s CO Na 水合物有)(10)(7),(232232232s O H CO Na s O H CO Na s O H CO Na ⋅⋅⋅和(1)下,与32CO Na 水溶液及冰平衡共存的水合物最多有几种? (2)20℃时,与水蒸气平衡共存的水合物最多可能有几种? 解 系统的物种数S=5,即H 2O 、)(32s CO Na 、)(10)(7),(232232232s O H CO Na s O H CO Na s O H CO Na ⋅⋅⋅和。
独立的化学反应式有三个:)()()(232232s O H CO Na l O H s CO Na ⋅=+)(7)(6)(2322232s O H CO Na l O H s O H CO Na ⋅=+⋅ )(10)(3)(72322232s O H CO Na l O H s O H CO Na ⋅=+⋅则R=3没有浓度限制条件 0'=R所以,组分数 C=S-R-'R =5-3-0=2在指定的温度或压力的条件下,其自由度数 F=C-P+1=3-P 平衡条件下F=0时相数最多,因此上述系统最多只能有3相共存。