二组分凝聚系统相图
- 格式:ppt
- 大小:2.24 MB
- 文档页数:52

二组分凝聚系统相图一、实验目的1.熟悉热分析法测绘Sn-Pb二组分凝聚系统相图的原理;2.掌握热电偶测温的基本原理。
二、实验原理热分析法是绘制凝聚系统相图的基本方法之一。
其原理是根据系统在加热或冷却过程中发生相变所对应的温度来确定系统的状态图。
当一个熔融系统均匀冷却时,如无相变化,它的温度将连续均与地下降,在温度-时间图上将得到一条平滑的曲线;如在冷却过程中发生了相变,则令温度下降减缓甚至因新相析出所放出的热量抵消了散失的热量而令温度不变,于是冷却曲线上就会出现转折点或水平线段,而产生水平或转折的温度就是发生相变的温度。
本实验所测定的是具有最低共熔点的固态部分互溶的Sn-Pb系统,实验室测定一系统冷却曲线。
如图1(a)中的曲线A为Pb的冷却曲线,熔融的Pb 在高于327℃时,系统中只有液态的Pb,根据相律F=C-P+1可知,单组分系统的自由度为1,故温度可以改变且均匀下降。
当逐渐冷却至温度为327℃时,Pb开始凝固,此时系统为两相共存,其自由度为零,即冷却曲线上出现水平线段。
当Pb全部凝固后,系统自由度变为1,系统的温度又均匀下降。
图1(a)中曲线E所示的是组成为61.9%Sn的冷却曲线。
它和纯金属的冷却曲线很相像,当液体冷却到一定温度时,从液体中同时析出两个固相,三相共存,因此自由度为零,故也出现水平段。
此温度是低共熔温度。
对含Sn量在19.5%-97.4%之间的其他样品,冷却曲线比较复杂。
本实验中测试的是组分为30%Sn和80%Sn的系统。
以30%Sn系统为例,开始均匀冷却,当冷却到图中C点处温度时,开始析出α固溶体,此时自由度为1,温度仍可变化,但由于固相析出而放出相变热,使冷却速度减慢,冷却曲线斜率变小,出现转折点C,随着含有Pb量高的固溶体α的析出,液相中Pb 含量逐渐减少,只有降低温度才能继续析出固体,当温度降到D点处而且液相组成也变成低共熔组成时,另一固溶体β也达到饱和,系统变成三相,自由度为零,冷却曲线上出现水平段,直至液相消失。

二组分凝聚系统相图化工学院化学工程与工艺一班祁梦园3016207019实验日期2017.9.19一、实验目的(1)掌握热分析法测绘Sn-Pb二组分凝聚系统相图的原理和方法(2)了解简单固液相图的特点,巩固相律等有关知识二、实验原理热分析法是绘制凝聚系统相图的基本方法之一。
其原理是根据系统在加热或冷却过程中发生相变时所对应的温度来确定系统的状态图。
当一个熔融系统均匀冷却时,如无相变化,它的温度将连续均匀的下降,在温度-时间图上将得到一条平滑的曲线。
如在冷却过程中发生了相变了,则令温度下降减缓甚至固新相析出,所放出的热量抵消了散失的热量而令温度不变,于是曲线上就会出现转折点或水平线段,而产生水平或转折的温度就是发生相变的温度。
相变温度一般可以通过测量熔融系统冷却时系统温度随时间变化关系的曲线来找出。
三、仪器和药品仪器:KWL-09可控升降温电炉、SWKY-1型数字控温仪、坩锅钳一把、劳保手套一副、特制合金样品管5只(分别装纯Pb、纯Sn、含Sn30%、61.9%、80%的Sn-Pb混合物各100g,为防金属高温氧化其表面覆盖有一层石墨粉,样品随Pb含量增多依次标号为1~5)药品:Pb(A.R.)、Sn(A.R.)、石墨粉四、实验步骤1、用加热器电源将KWL-09可控升降温电炉与SWKY-1型数字控温仪连接,接通电源。
2、将待测样品管放入可控升降温电炉加热炉孔1内,控温探头I插入加热炉孔旁的插孔2内。
3、设定加热温度:打开数字控温仪开关,按“工作/置数”使控温仪处于置数状态,依次按温度设置键调节加热电炉为比理论转折温度高20~30℃,按时间调节键将时间间隔设置为10s。
4、按“工作/置数”使控温仪置于工作状态。
同时观察两个温度显示,当电炉温度到达设定温度,样品温度显示达到设定温度左右时,迅速将待测样品连同探头II从加热孔夹出,放入冷却炉孔中。
5、数据记录:每隔10s记录一次温度显示屏上的温度。
该样品测试完毕,将样品夹回样品管架中。

相图习题第五章多相平衡⼀、填空题1、⼀定温度下,蔗糖⽔溶液与纯⽔达到渗透平衡时的⾃由度数等于__________。
2、纯物质在⼀定温度下两相共存时的⾃由度数等于__________。
3、设下列化学反应同时共存时并达到平衡(900-1200K ):()()()g CO s CaO s CaCO 23+=()()()()g O H g CO g H g CO 222+=+()()()g H s CaCO s CaO g CO g O H 232)()(+=++则该系统的⾃由度数为______。
4、含KNO 3和NaCl 的⽔溶液与纯⽔达到渗透平衡时,其组分数为____,相数为___,⾃由度数为____。
5、完全互溶的双液系中,在x B =0.6处,平衡蒸⽓压有最⾼值,那么组成为x B =0.4的溶液在⽓液平衡时,x B (g )、x B (l )、x B (总)的⼤⼩顺序为______。
将x B =0.4的溶液进⾏精馏时,塔顶将得到______。
6、已知100o C 时⽔的饱和蒸⽓压为101.325KPa,⽤公式_________可求出25oC 时⽔的饱和蒸⽓压。
⼆、选择题1、如右图所⽰,当⽔处在三相点平衡时,若系统发⽣绝热膨胀,⽔的相态将如何变化?( )A.⽓相、固相消失,全部变成液态;B.⽓相、液相消失,全部变成固态;C.液相消失,固相、⽓相共存;D.固相消失,液相、⽓相共存2、已知纯A 和纯B 的饱和蒸⽓压p A *A.不断增⼤B.不断减⼩C.先增⼤后减⼩D.先减⼩后增⼤3、部分互溶双液系,⼀定温度下若出现两相平衡,则( )A.体系的组成⼀定B.两相的组成与体系的总组成有关。
且两相的量之⽐为常数C.两相的组成与体系的总组成⽆关。
且两相质量分数之⽐为常数D.两相的组成不定4、右图中PQ线上( )A.f*=0B.f*=1C.A和B不互溶D.A和B完全互溶5、在有低共熔点存在的体系,若步冷曲线上出现平台,此时,体系存在的相数( )A.1B.2C.3D.2或36、定压下,在最低共熔点,双组分系统存在( )A.⼀相B.⼆相C.三相D.四相7、已知苯的lgp~1/T的图中,其直线斜率为-1.767×103,则苯的摩尔蒸发热为( )A.33.83J·mol-1B.33.83kJ·mol-1C.14.69 J·mol-1D.14.69kJ·mol-18、下图为⽓液平衡相图,图中M点( )A.代表温度为T1时⽓相的组成B.代表温度为T1时液相的组成C.是温度为T1时⽓相中物质B的物质的量D.是温度为T1时液相中物质B的物质的量9、如下图所⽰,在相合熔点,形成的化合物的步冷曲线上出现( )A.拐点B.平台C.⽆拐点和平台D.⼀个拐点两个平台10、右图中,⽓液两相组成相同的点为( )A.A、B点B.C点C.A、B、C点D.⽓相线和液相线上各点11、若步冷曲线出现平台,此时体系的条件⾃由度数为( )A.0B.1C.2D.312、在101325Pa压⼒下,冰与被空⽓饱和了的⽔成平衡的温度叫( )A.凝固点B.冰点C.三相点D.露点13、右图中,⾃由度都为零的全部的点为 ( )A.J、E1、C、E2、KB.M、E1、N、O、E2、PC.MN线、OP线(端点除外)上各点及J、C、KD.MN线、OP线(包含端点)上各点及J、C、K14、对右图描述正确的是( )A.MN线上各点,系统存在三相平衡B.M、N点,体系存在两相平衡C. E1、E2点体系存在两相平衡D.J、C、K点体系存在两相平衡15、在⽔的p-T相图中,H2O(l)的蒸⽓压曲线代表的是( )A.Φ=1,f=2B.Φ=2,f=1C.Φ=3;f=0D.Φ=2,f=216、克拉佩龙⽅程表明( )A.两相平衡时的平衡压⼒随温度⽽变化的变化率B.任意状态下压⼒随温度的变化率C.它适⽤于任何物质的两相平衡D.以上说法都不对三、简答题1、为什么具有40%Cd的Bi-Cd体系,其步冷曲线的形状与纯Bi及纯Cd的相同?2、下列两种体系各有⼏种组分及⼏个⾃由度?A.NaH 2PO 4溶于⽔中成为与⽔⽓平衡的不饱和溶液B.AlCl 3溶于⽔中并发⽣⽔解沉淀出Al(OH)3固体3、270K 的过冷⽔较冰稳定还是不稳定?何者的化学势⾼?⾼多少?4、说明⽔的三相点与它的冰点的区别。
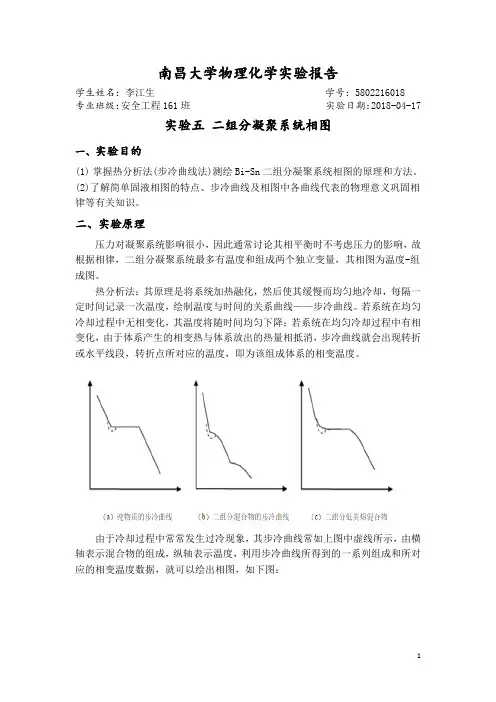
南昌大学物理化学实验报告学生姓名:李江生学号:5802216018专业班级:安全工程161班实验日期:2018-04-17实验五二组分凝聚系统相图一、实验目的(1)掌握热分析法(步冷曲线法)测绘Bi-Sn二组分凝聚系统相图的原理和方法。
(2)了解简单固液相图的特点、步冷曲线及相图中各曲线代表的物理意义巩固相律等有关知识。
二、实验原理压力对凝聚系统影响很小,因此通常讨论其相平衡时不考虑压力的影响,故根据相律,二组分凝聚系统最多有温度和组成两个独立变量,其相图为温度-组成图。
热分析法:其原理是将系统加热融化,然后使其缓慢而均匀地冷却,每隔一定时间记录一次温度,绘制温度与时间的关系曲线——步冷曲线。
若系统在均匀冷却过程中无相变化,其温度将随时间均匀下降;若系统在均匀冷却过程中有相变化,由于体系产生的相变热与体系放出的热量相抵消,步冷曲线就会出现转折或水平线段,转折点所对应的温度,即为该组成体系的相变温度。
由于冷却过程中常常发生过冷现象,其步冷曲线常如上图中虚线所示,由横轴表示混合物的组成,纵轴表示温度,利用步冷曲线所得到的一系列组成和所对应的相变温度数据,就可以绘出相图,如下图:简单低共熔混合物二组分系统步冷曲线及相图三、仪器与药品步冷曲线测定装置1套(可控升降温电炉1台,数字控温仪1台,控温探头I,测温探头Ⅱ),不锈钢试样管5只,坩埚钳1把,劳保手套1副,Sn、Bi及其合金。
四、实验步骤1、将数字控温仪温度Ⅰ设定为320℃,按“工作/置数”按钮,切换到工作状态。
传感器Ⅰ插入加热炉Ⅰ样品管口内;传感器Ⅱ插入加热炉Ⅱ样品管口内;加热到320℃;2、将“冷风量调节”旋钮逆时针旋到底,加热使温度降为250℃左右后;3、适当调节“冷风量调节”旋钮,使温度降温绘制步冷曲线,降温速率控制为6-8℃/min,以便找到曲线拐点;4、打开金属相图软件,设置绘步冷曲线图坐标;5、实验结束后,关闭仪器电源,将实验桌面整理干净。


第六章 相平衡指出下列平衡系统中的组分数C ,相数P 及自由度数F 。
(1) I 2(s)与其蒸气成平衡;(2) MgCO 3(s)与其分解产物MgO(s)和CO 2(g)成平衡;(3) NH 4Cl(s)放入一抽空的容器中,与其分解产物NH 3(g)和HCl (g) 成平衡; (4) 取任意量的NH 3(g)和H 2S (g)与NH 4HS(g)成平衡;(5) 过量的NH 4HCO 3(s)与其分解产物NH 3(g),H 2O(g)和CO 2(g) 成平衡; (6) I 2作为溶质在两不互溶液体H 2O 和CCl 4中达到分配平衡(凝聚系统)。
解:(1)C =1,P =2,21F C P =-+=;(2)C =2,P =3,21F C P =-+=; (3)C =1,P =2,21F C P =-+=; (4)C =2,P =2,22F C P =-+=; (5)C =1,P =2,21F C P =-+=; (6)C =3,P =2,12F C P =-+=。
常见的Na 2CO 3(s)水合物有Na 2CO 3•H 2O (s),Na 2CO 3•7H 2O(s)和 Na 2CO 3•10H 2O (s) (1)下,与Na 2CO 3水溶液及冰平衡共存的水合物最多能有几种 (2)20℃时,与水蒸气平衡共存的水合物最多能可能有几种 解: S =5,R =3,R '=0,C =SR R '=2,F =C P +1=3P ,F mix =0,P max =3;(1)已有两相(水溶液、冰),只能有一种水合物与其共存; (2)已有一相(水蒸气),有二种水合物与其共存。
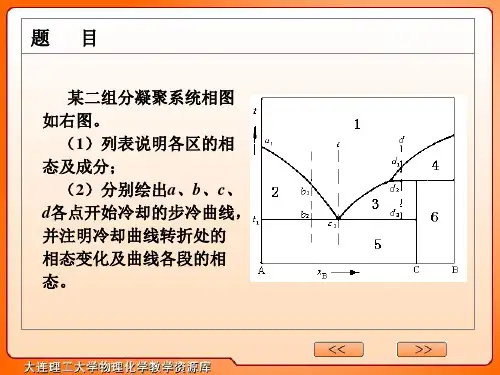
A-B 二组分液态部分互溶系统的液-固平衡相图如附图所示,试指出各个项区的平衡关系,各条线所代表的意义,以及三相线所代表的平衡关系。
解:单相区:1:A 和B 的混合溶液l ;二相区:2:l 1+ l 2;3:l 2+ B(s);4:l 1+ A(s); 5:l 1+ B(s);6:A(s)+B(s) 各条线代表的意义:LJ :A 的凝固点降低曲线; JM :B 的凝固点降低曲线;A BL MNOUVIJK123456NV :B 的凝固点降低曲线; MUN :液液相互溶解度曲线。



物理化学第六章相平衡习题一、选择题1. 若A和B能形成二组分理想溶液,且T B*>T A*,则A和B在达平衡的气、液相中的物质的量分数()。
(A)y A>x A,y B<x B;(B)y A<x A,y B>x B;(C)y A>x A,y B>x B;(D)y A<x A,y B<x B。
2. 液态完全互溶的两组分A、B组成的气液平衡系统中,在外压一定下,于该气液平衡系统中加入组分B(l)后,系统的沸点下降,则该组分在平衡气相中的组成y B()它在液相中的组成x B。
(A)大于(B)小于(C)等于(D)无法确定3. 在温度T下,CaCO3(s),CaO(s)及CO2的平衡系统压力为p,已知它们之间存在CaCO3(s)==CaO(s)+CO2(g)反应,若往该平衡系统中加入CO2(g), 当重新达到平衡时,系统的压力()。
(A)变大;(B)变小;(C)不变;(D)可能变大也可能变小。
4. A(低沸点)与B(高沸点)两种纯液体组成的液态完全互溶的气液平衡系统。
在一定温度下,将B(l) 加入平衡系统中时,测得系统的压力增大,说明此系统()。
(A)一定具有最大正偏差;(B)一定具有最大负偏差;(C)有可能是最大正偏差也有可能是最大负偏差;(D)数据不够,无法确定。
5. 组分A(s)与组成B(s)组成的凝聚系统相图中,若己知形成以下四种化合物:A2B(稳定),AB(稳定),AB2(不稳定),AB3(稳定)则该相图中有()最低共熔点和()条三相线。
(A) 3,3 (B)4,4 (C) 3,4;(D) 4,5。
6. 将克拉佩龙方程应用于H2O(s)和H2O(l)两相平衡,随着压力的增长,H2O的凝固点将()(A)升高(B)降低(C)不变(D)无法判断7. 将过量的NaHCO3(s)放入一真空密闭容器中,在50℃下,NaHCO3按下式进行分解:2NaHCO3(s)==Na2CO3(s)+CO2(g)+H2O(s),系统达平衡后,则其组分数C=();F=()。

相图一、是非题下述各题中的说法是否正确?正确的在题后括号内画“√”,错的画“⨯”。
1.相是指系统处于平衡时,系统中物理性质及化学性质都均匀的部分。
( )2.依据相律,纯液体在一定温度下,蒸气压应该是定值。
( )3.依据相律,恒沸温合物的沸点不随外压的改变而改变。
( )二、选择题选择正确答案的编号,填在各题题后的括号内。
1NH4HS(s)和任意量的NH3(g)及H2 S(g)达平衡时有:( )。
(A)C=2,φ=2,f =2;(B) C=1,φ=2,f =1;(C) C=1,φ=3,f =2;(D) C=1,φ=2,f =3。
2已知硫可以有单斜硫,正交硫,液态硫和气态硫四种存在状态。
硫的这四种状态____稳定共存。
(A) 能够;(B) 不能够;(C) 不一定。
3硫酸与水可形成H2SO4⋅H2O(s),H2SO4⋅2H2O(s),H2SO4⋅4H2O(s)三种水合物,问在101 325Pa的压力下,能与硫酸水溶液及冰平衡共存的硫酸水合物最多可有多少种?( )(A) 3种;(B) 2种;(C) 1种;(D) 不可能有硫酸水合物与之平衡共存。
4将固体NH4HCO3(s) 放入真空容器中,恒温到400 K,NH4HCO3按下式分解并达到平衡:NH4HCO3(s) === NH3(g) + H2O(g) + CO2(g) 系统的组分数C和自由度数f为:( )(A) C=2,f =2;(B) C=2,f =2;(C) C=2,f =0;(D) C=3,f =2。
5某系统存在C(s)、H2O(g)、CO(g)、CO2(g)、H2(g)五种物质,相互建立了下述三个平衡:H2O(g)+C(s) H2(g) + CO(g)CO2(g)+H2(g) H2O + CO(g)CO2(g) + C(s) 2CO(g)则该系统的独立组分数C为:( )。
(A) 3;(B) 2;(C) 1;(D) 4。
三、计算题习题1A,B二组分在液态完全互溶,已知液体B在80︒C下蒸气压力为101.325 kPa,汽化焓为30.76 kJ·mol-1。
第六章相平衡6.1指出下列平衡系统中的组分数C,相数P及自由度F。
(1)I2(s)与其蒸气成平衡;(2)CaCO3(s)与其分解产物CaO(s)和CO2(g)成平衡;(3)NH4HS(s)放入一抽空的容器中,并与其分解产物NH3(g)和H2S(g)成平衡;(4)取任意量的NH3(g)和H2S(g)与NH4HS(s)成平衡。
(5)I2作为溶质在两不互溶液体H2O和CCl4中达到分配平衡(凝聚系统)。
解:(1)C = 1, P = 2, F = C–P + 2 = 1 – 2 + 2 = 1.(2)C = 3 – 1 = 2, P = 3, F = C–P + 2 = 2 – 3 + 2 = 1.(3)C = 3 – 1 – 1 = 1, P = 2, F = C–P + 2 = 1 – 2 + 2 = 1.(4)C = 3 – 1 = 2, P = 2, F = C–P + 2 = 2 – 2 + 2 = 2.(5)C = 3, P = 2, F = C–P + 1 = 3 – 2 + 1 = 2.6.2已知液体甲苯(A)和液体苯(B)在90 C时的饱和蒸气压分别为=和。
两者可形成理想液态混合物。
今有系统组成为的甲苯-苯混合物5 mol,在90 C下成气-液两相平衡,若气相组成为求:(1)平衡时液相组成及系统的压力p。
(2)平衡时气、液两相的物质的量解:(1)对于理想液态混合物,每个组分服从Raoult定律,因此(2)系统代表点,根据杠杆原理6.3单组分系统的相图示意如右图。
试用相律分析途中各点、线、面的相平衡关系及自由度。
解:单相区已标于图上。
二相线(F = 1):三相点(F = 0):图中虚线表示介稳态。
6.4已知甲苯、苯在90 ︒C下纯液体的饱和蒸气压分别为54.22 kPa和136.12 kPa。
两者可形成理想液态混合物。
取200.0 g甲苯和200.0 g苯置于带活塞的导热容器中,始态为一定压力下90 ︒C的液态混合物。