丙酮酸含量测定
- 格式:doc
- 大小:24.00 KB
- 文档页数:2



货号:QS2204 规格:50管/48样丙酮酸(pyruvic acid PA)含量测定试剂盒说明书可见分光光度法正式测定前务必取2-3个预期差异较大的样本做预测定测定意义:丙酮酸通过乙酰CoA连接葡萄糖、脂肪酸和氨基酸三大代谢,起着重要的枢纽作用。
测定原理:丙酮酸与2,4-二硝基苯肼作用,生成丙酮酸-2,4-二硝基苯腙,在碱性溶液中呈色。
自备实验用品及仪器:可见分光光度计、台式离心机、可调式移液器、1 mL玻璃比色皿、研钵、冰、蒸馏水。
试剂的组成和配制:提取液:液体50mL×1瓶,4℃保存;试剂一:液体5mL×1瓶,4℃避光保存;试剂二:液体25mL×1瓶,4℃保存。
丙酮酸提取:1、细菌或培养细胞:先收集细菌或细胞到离心管内,离心后弃上清;按照细菌或细胞数量(104个):提取液体积(mL)为500~1000:1的比例(建议500万细菌或细胞加入1mL提取液),超声波破碎(冰浴,功率20%或200W,超声3s,间隔10s,重复30次),静置30min, 8000g,25℃离心10min,取上清待测。
2、组织:按照组织质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL提取液),进行冰浴匀浆,静置30min,8000g,25℃离心10min,取上清待测。
3、血清(浆)样品:按照血清(浆)体积(mL):提取液体积(mL)为1:5~10的比例(建议取0.1mL血清(浆)加入1mL提取液),进行冰浴匀浆,静置30min, 8000g,25℃离心10min,取上清待测。
测定步骤:1、分光光度计预热30min以上,调节波长至520nm,蒸馏水调零。
2、取300μL样本+100μL试剂一于1.5mL EP管中,混匀,静置2min,加入500μL试剂二,混匀,于520nm波长处测定管吸光值A。
丙酮酸含量计算:1、标准条件下测定回归方程为y = 0.0466x + 0.0675; x为丙酮酸含量(µg/mL),y为吸光值。


LDH法的原理及应用1. 原理LDH(Lactate dehydrogenase)法是一种用于测定体液中乳酸含量的常用方法。
乳酸是生物体在无氧代谢过程中产生的一种代谢产物,其浓度的升高常常与某些病理状态相关,因此测定乳酸浓度可以帮助医生评估病人的代谢情况和疾病严重程度。
LDH法的原理基于乳酸在存在乳酸脱氢酶(LDH)的催化下与还原型辅酶Ⅱ(NADH)发生氧化还原反应,生成丙酮酸和NAD+。
该反应可通过测定NAD+的减少量或NADH的增加量来间接测定乳酸的浓度。
具体步骤如下:1.取一定体积的待测液样加入反应溶液中,其中包括乳酸脱氢酶、NADH和缓冲剂。
2.反应开始后,乳酸脱氢酶催化乳酸与NADH反应,生成丙酮酸和NAD^+。
3.NADH的减少量可以通过光密度的变化来测定。
乳酸浓度与NADH减少量成正比。
4.通过比对标准曲线,可以确定待测液样中乳酸的浓度。
2. 应用LDH法广泛应用于临床医学、药物研究和生物学等领域。
下面列举了该方法在不同领域的应用:2.1 临床医学LDH法在临床医学中用于测定血液、尿液和其他体液中乳酸的浓度。
这对于评估病人的代谢情况、疾病状态和疾病严重程度非常重要。
LDH法在以下疾病的诊断和监测中有广泛应用:•心肌梗塞:乳酸浓度的升高与心肌梗塞相关。
•肝脏疾病:乳酸浓度的增加可能与肝功能受损有关。
•肾脏疾病:乳酸浓度的变化可以反映肾脏功能的改变。
2.2 药物研究LDH法可用于药物研究中对药物对细胞代谢的影响进行评估。
通过测定细胞中乳酸的浓度变化,可以了解药物对细胞氧化代谢的影响。
该方法可以帮助研究人员了解药物的治疗效果和毒副作用,进而指导药物的研发和应用。
2.3 生物学研究LDH法在生物学研究中也有一定的应用。
乳酸浓度的变化可以反映细胞的能量代谢状态。
通过测定乳酸浓度的变化,可以了解细胞在不同生理和病理条件下的代谢状态。
在细胞培养和细胞凋亡研究中,LDH法可用于评估细胞的损伤程度和细胞死亡情况。

影响酶促反应的因素——温度,ph,激活剂及抑制剂,生化实验报告(共8篇) 影响酶促反应速度的因素生化实验实验二影响酶促反应速度的因素【目的】观察温度、PH、激活剂、抑制剂对酶促反应速度的影响。
【原理】唾液淀粉酶催化淀粉水解,生成一系列水解产物,即糊精、麦芽糖和葡萄糖等。
淀粉及其水解产物遇碘会呈现不同的颜色。
在不同温度,不同PH值下,唾液淀粉酶活性不同,催化淀粉水解程度不一,生成的产物也就不同。
此外,激活剂、抑制剂也能影响淀粉酶活性,影响淀粉的水解。
因此可根据在不同反应条件下,溶液加碘呈现的不同颜色来判断淀粉的水解程度,从而验证了温度、pH、激活剂、抑制剂对酶促反应速度的影响。
淀粉I2 【操作】1. 温度对酶促反应速度的影响取3支试管,编号,按下表操作:2. PH对酶促反应速度的影响取3支试管,编号,按下表操作:3.激活剂与抑制剂对酶促反应速度的影响取4支试管,编号,按下表操作:【结果及分析】观察各管颜色变化,说明温度、pH、激活剂、抑制剂对酶促反应的影响。
【实验注意事项】篇二:生化实验思考题参考答案生化实验讲义思考题参考答案实验一淀粉的提取和水解1、实验材料的选择依据是什么?答:生化实验的材料选择原则是含量高、来源丰富、制备工艺简单、成本低。
从科研工作的角度选材,还应当注意具体的情况,如植物的季节性、地理位置和生长环境等,动物材料要注意其年龄、性别、营养状况、遗传素质和生理状态等,微生物材料要注意菌种的代数和培养基成分的差异等。
2、材料的破碎方法有哪些?答:(1) 机械的方法:包括研磨法、组织捣碎法;(2) 物理法:包括冻融法、超声波处理法、压榨法、冷然交替法等;(3) 化学与生物化学方法:包括溶胀法、酶解法、有机溶剂处理法等。
实验二总糖与还原糖的测定1、碱性铜试剂法测定还原糖是直接滴定还是间接滴定?两种滴定方法各有何优缺点?答: 我们采用的是碱性铜试剂法中的间接法测定还原糖的含量。
间接法的优点是操作简便、反应条件温和,缺点是在生成单质碘和转移反应产物的过程中容易引入误差;直接法的优点是反应原理直观易懂,缺点是操作较复杂,条件剧烈,不易控制。

ALT,AST测定⽅法3.8.2.1⼩⿏肝、肾、⼼组织ALT含量测定1实验原理⾕丙转氨酶作⽤于由丙氨酸及α-酮戊⼆酸组成的基质,在⼀定的反应条件下,产⽣⼀定量的丙酮酸。
在酶反应到规定时间时,加⼊2,4-⼆硝基苯肼,在当量浓度的酸性条件下,终⽌了酶反应。
2,4-⼆硝基苯肼分别与反应产⽣的丙酮酸及剩余的基质α-酮戊⼆酸形成各⾃对应的2,4-⼆硝基苯腙。
在碱性条件下,虽然⼆种苯腙分别显出红棕⾊,但由于丙酮酸⽣成的颜⾊较深,以同等克分⼦计算,在480-530nm波长范围内其浓度约为α-酮戊⼆酸⽣成的颜⾊的3倍,利⽤这⼀差别可以反映出丙酮酸的⽣成量。
本实验设⾕草转氨酶活⼒为:样品液与ALT 基质液在37℃下反应60min时每⽣成1µmol丙酮酸所需的酶量为1个活⼒单位(U)。
2试剂配制(1)0.1mol/L磷酸缓冲液(pH7.4)称取NaH2PO4.2H2O 2.96495g,Na2HPO4.12H2O 29.0142g,溶解于蒸馏⽔中,定容到1000mL。
(2)20µmol/L丙酮酸钠标准溶液称取22mg丙酮酸钠,溶解于0.1mol/L磷酸缓冲液(pH7.4)100mL中。
现配现⽤。
(3)ALT基质液称取α-酮戊⼆酸29.2mg,DL-丙氨酸1.78mg(L-丙氨酸0.85mg)溶解于30mL 0.1mol/L磷酸缓冲液(pH7.4)中,溶解后校正pH⾄7.4,再⽤pH7.4的磷酸缓冲液定容⾄100mL,置冰箱中保存备⽤(可保存⼀周)。
可加⼊氯仿数滴防腐。
(4)0.02% 2,4—⼆硝基苯肼溶液称取20mg2,4—⼆硝基苯肼先溶解于10 mL纯盐酸中,电炉加热助溶,待2,4—⼆硝基苯肼全部溶解后,⽤蒸馏⽔稀释⾄100mL,过滤后盛于棕⾊中,置冰箱中保存备⽤。
(5)1mol/L NaOH溶液:称取4g NaOH溶解于蒸馏⽔后,定容到100mL。
(6)0.4 mol/L NaOH溶液称取16 g NaOH溶解于蒸馏⽔后,定容到1000mL。

丙酮酸差量法测定大蒜中大蒜辣素含量方法的建立朱君芳;许建;高杰【摘要】通过测定经酶促反应后大蒜鳞茎中的丙酮酸含量,以灭酶组大蒜鳞茎中丙酮酸含量为本底,应用丙酮酸差量法计算得出大蒜鳞茎中大蒜辣素含量,并对测定条件进行优化.结果表明:大蒜本底灭酶条件为100℃水浴加热30 min,酶促反应温度为30℃,酶促反应时间为10 min,在520 nm下测定吸光度值,丙酮酸含量浓度在10 ~ 50 μg/mL内与吸光度呈良好的线性关系,大蒜辣素测定精密度相对标准偏差为0.88%,重现性相对标准偏差为1.05%.该方法操作简单、稳定、重复性好,对于测定大蒜中大蒜辣素切实可行.【期刊名称】《食品与发酵工业》【年(卷),期】2015(041)011【总页数】4页(P148-151)【关键词】大蒜;丙酮酸;差量法;大蒜辣素含量【作者】朱君芳;许建;高杰【作者单位】新疆农业大学林学与园艺学院,新疆乌鲁木齐830052;新疆农业大学林学与园艺学院,新疆乌鲁木齐830052;新疆农业大学林学与园艺学院,新疆乌鲁木齐830052【正文语种】中文大蒜(Allium sativum L.)是百合科(Liliaceae)葱属(Allium)草本植物,是一种葱蒜类蔬菜,以鳞茎、嫩叶和花茎为食用器官,是一种重要的调味蔬菜[1]。
原产于欧洲南部、西亚和中亚,西汉时期传入我国[2]。
目前大蒜在我国已广泛栽培,主要产地有河南、山东、河北、甘肃、江苏及新疆等地[3-4]。
大蒜有消炎、杀菌、降低胆固醇、抗癌、以及增强免疫力等多种功效。
大蒜的药用价值主要来源于大蒜辣素(allicin)。
大蒜辣素极易挥发,是一种具有特殊气味的无色油状物质[5-9]。
大蒜辣素以前体物质蒜氨酸存在于大蒜中,在完整的细胞中,蒜氨酸存在于细胞质中,而蒜氨酸酶存在于液泡中,细胞破碎后二者接触,继而蒜氨酸发生转化,生成大蒜辣素[10-11]。
大蒜辣素药用价值大,可加工为保健品和药品等,应用前景较广阔。
![[磷酸烯醇丙酮酸羧酶]丙酮酸:丙酮酸](https://uimg.taocdn.com/6c00760ca9114431b90d6c85ec3a87c240288a72.webp)
[磷酸烯醇丙酮酸羧酶]丙酮酸:丙酮酸篇一: 丙酮酸:丙酮酸-基本资料,丙酮酸-物理性质CH3COCOOH,原称焦性葡萄酸,是参于整个生物体基本代谢的中间产物之一。
是一种α-酮酸,其燃点为82°C,在生物化学代谢途径中扮演重要角色。
丙酮酸的羧酸盐阴离子被称之为丙酮酸盐。
丙酮酸可通过乙酰CoA和三羧酸循环实现体内糖、脂肪和氨基酸间的互相转化,因此,丙酮酸在三大营养物质的代谢联系中起着重要的枢纽作用。
丙酮酸_丙酮酸-基本资料丙酮酸结构式中文名称:丙酮酸中文同义词:2-氧代丙酸;乙酰甲酸;丙酮酸;A-酮基丙酸;乙醯甲酸;丙酮酸PYRUVICACID;乙酰基甲酸;丙酮酸,98%英文名称:Pyruvicacid英文同义词:2-oxo-propanoicaci;CH3COCOOH;Propanoicacid,2-oxo-;Propanoicac id,2-oxo-;pyruvic;FEMA2970;2-KETOPROPANOICACID;2-KETOPRO PIONICACID丙酮酸_丙酮酸-物理性质丙酮酸结构式浅黄色至黄色的透明液体。
有醋酸气味。
有酸味。
天然品存在于薄荷及蔗糖发酵液中。
相对分子质量88.06。
相对密度1.2271。
熔点13.8℃。
沸点165℃、106.5℃、85.3℃、70.8℃、57.9℃、45.8℃、21.4℃。
闪点82℃。
折射率1.4280。
与水、乙醇、乙醚等混溶。
丙酮酸_丙酮酸-化学性质柠檬酸-丙酮酸循环在空气中颜色变暗。
加热时缓慢聚合,富有反应性,容易与氮化物、醛、卤化物、磷化物等反应,参与生物体的糖代谢、胶质、氨基酸、蛋白质等的生化合成、代谢、醇的发酵等。
当用力时,在肌肉中被还原为乳酸,休息时再次氧化并部分转变为糖原。
大鼠经口LD502100mg/kg。
丙酮酸是人体的1种成分,在人体内主要参与糖、脂肪等的代谢,也是碳水化合物代谢的中间产物之一。
[1]丙酮酸_丙酮酸-概述丙酮酸丙酮酸在糖酵解等过程中有重要作用:它可以在细胞溶质葡萄糖进行糖酵解的过程中,由磷酸烯醇式丙酮酸产生。
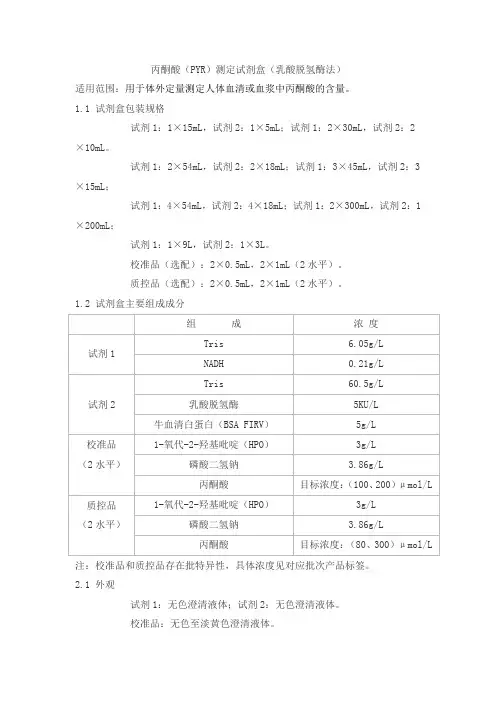
丙酮酸(PYR)测定试剂盒(乳酸脱氢酶法)适用范围:用于体外定量测定人体血清或血浆中丙酮酸的含量。
1.1 试剂盒包装规格试剂1:1×15mL,试剂2:1×5mL;试剂1:2×30mL,试剂2:2×10mL。
试剂1:2×54mL,试剂2:2×18mL;试剂1:3×45mL,试剂2:3×15mL;试剂1:4×54mL,试剂2:4×18mL;试剂1:2×300mL,试剂2:1×200mL;试剂1:1×9L,试剂2:1×3L。
校准品(选配):2×0.5mL,2×1mL(2水平)。
质控品(选配):2×0.5mL,2×1mL(2水平)。
1.2 试剂盒主要组成成分注:校准品和质控品存在批特异性,具体浓度见对应批次产品标签。
2.1 外观试剂1:无色澄清液体;试剂2:无色澄清液体。
校准品:无色至淡黄色澄清液体。
质控品:无色至淡黄色澄清液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 试剂空白吸光度在37℃、340nm波长、1cm光径条件下,试剂空白吸光度应不小于0.5。
2.4 分析灵敏度测定浓度在200µmol/L附近的样本时,吸光度变化值(ΔA)应不小于0.02。
2.5 线性在(30,1200)µmol/L线性范围内,线性相关系数r不小于0.990。
在(150,1200)µmol/L范围内的线性相对偏差不大于±10%;测定结果(30,150]µmol/L时线性绝对偏差不大于±15µmol/L。
2.6 重复性重复测试高低浓度的样本,所得结果的变异系数(CV%)应不大于8%。
2.7 批间差不同批号试剂测试同一份样本,测定结果的批间相对极差应不大于10%。
2.8 准确度与已上市产品进行比对试验,在(30,1200)µmol/L范围内,与比对系统的相关系数r不小于0.975;在(100,1200)µmol/L区间内与比对系统的相对偏差应不大于±15%,(30,100] µmol/L区间内与比对系统的绝对偏差应不大于±15µmol/L。

丙酮酸钠质量标准丙酮酸钠是一种常用的化工原材料,广泛应用于化学合成、药物制造、染料工业等领域。
为了确保丙酮酸钠的质量符合相关标准,制定丙酮酸钠的质量标准非常重要。
本文将介绍丙酮酸钠的质量标准及其相关要求。
一、产品品质要求 1. 外观丙酮酸钠的外观应为白色结晶粉末,无明显杂质。
2.纯度丙酮酸钠的纯度应不低于99%,通过化学分析等方法进行检测。
3.水分丙酮酸钠的含水量应控制在5%以下,通过烘干后称重或其他相应方法进行测定。
4.酸度丙酮酸钠的酸度应符合标准要求,通过酸碱滴定、pH值检测等方法进行检测。
二、检测方法 1. 纯度检测方法采用高效液相色谱法(HPLC)或气相色谱法(GC)等先进仪器对丙酮酸钠样品进行检测,通过峰面积或峰高比进行定量分析。
2.水分检测方法将丙酮酸钠样品置于105℃的恒温干燥器中,烘干至恒重后进行称重,通过样品质量的变化计算得到水分含量。
3.酸度检测方法采用酸碱滴定法或pH检测仪器对丙酮酸钠样品中的酸度进行测定。
三、包装与储存要求 1. 包装丙酮酸钠应采用密封的塑料或复合纸袋包装,包装袋应标明产品名称、纯度、净重等信息。
2.储存丙酮酸钠应存放在通风干燥的库房中,避免与酸性物质接触,远离明火,避免阳光直射。
储存期间,应定期检查包装是否完好,避免潮湿和日晒。
四、质量控制 1. 质量跟踪在生产过程中,应建立质量跟踪记录,对原材料、生产环境等关键因素进行监控,确保丙酮酸钠的质量稳定可靠。
2.质量检验生产出的每批丙酮酸钠产品应进行质量检验,检测项目包括纯度、水分、酸度等,确保产品符合标准要求。
3.异常品控制如果发现产品不符合质量标准,应立即停止生产,并对生产过程进行调查,找出问题原因并采取相应的纠正措施,确保后续产品质量稳定。
总结:丙酮酸钠的质量标准对确保产品的品质稳定起着重要作用。
通过严格遵守质量标准的要求,建立科学的检测方法和质量控制体系,可以保证丙酮酸钠的质量稳定,满足广泛的应用需求。
测定丙酮酸含量的基本原理
测定丙酮酸含量的基本原理是利用化学反应或仪器分析的方法来确定样品中丙酮酸的浓度。
一种常用的方法是通过酸碱中和反应进行测定。
首先,将含有丙酮酸的样品溶解在适当的溶剂中,得到丙酮酸溶液。
然后,将丙酮酸溶液滴定至中性终点。
在滴定过程中,加入酸碱指示剂,如酚酞或溴丙酚绿等,使溶液产生颜色变化。
当溶液中的丙酮酸被完全中和时,颜色发生明显变化,表示反应终点达到。
根据滴定液的体积和已知的滴定液浓度,可以计算出丙酮酸的浓度。
另一种常用的方法是利用光谱分析仪器测定丙酮酸的含量。
这种方法称为分光光度法。
首先,将样品制备成适当的溶液,并将其放置在光谱分析仪器中。
然后,根据丙酮酸分子的特定吸收波长,在特定波长下测量样品的吸光度。
根据比色法或比浊法,可以将吸光度与丙酮酸的浓度相关联。
通过构建标准曲线,可以准确测定未知样品中丙酮酸的含量。
除了以上提到的方法,还有其他一些测定丙酮酸含量的基本原理,如电化学分析方法、色谱分析方法等,这些方法的原理和操作过程可以根据实际需要选择合适的方法进行测定。
发酵科技通讯第38卷丙酮酸是一种重要的小分子有机酸,它既具有羧酸和酮的性质,又具有α-酮酸的性质。
丙酮酸是最简单的α-酮酸,属于羰基酸,也是生物体内产生的三碳酮酸,它是糖酵解途径的最终产物,在细胞质中还原成乳酸供能,或进入线粒体内氧化生成乙酰辅酶A,进入三羧酸循环被氧化成二氧化碳和水,完成葡萄糖的有氧氧化供能过程。
因此,丙酮酸是糖代谢中具有关键作用的中间产物。
丙酮酸可通过乙酰辅酶A和三羧酸循环实现体内糖、脂肪和氨基酸间的互相转化,因此,丙酮酸在三大营养物质的代谢联系中起着重要的枢纽作用。
世界上许多专家学者经过几十年的研究发现:丙酮酸盐具有加速脂肪消耗、减轻体重、增强人体耐力、提高竞技力、吞噬自由基和抑制自由基生成的显著效果,使其最初是在运动领域中脱颖而出,随后又风靡全社会成为一种新型膳食补充剂,并作为一种全新的减肥保健新概念,在美国一上市便被评为A级膳食补充剂,荣获1997年度美国医药发明奖,1998年成为全美减肥产品销量冠军。
以丙酮酸钙为主的减肥品迅速风靡全球。
丙酮酸盐的开发应用已成为国内外研究的热点,新的用途不断被开发,发展前景十分广阔[1]。
目前生产丙酮酸的方法主要有化学法、酶转化法和生物发酵法。
自1977年日本研究所率先实现由酒石酸为原料化学合成法生产丙酮酸的工业化,丙酮酸工业化生产的历史已有30余年[2]。
直至20世纪90年代,工业上还一直沿用化学法生产丙酮酸,产率可达到50%~55%,该法工艺简便易行,是国内生产丙酮酸的主要方法,但是化学方法生产的丙酮酸对环境污染比较严重,设备损耗大,且丙酮酸产品是消旋体[3]、底物转化率低、生产成本高,缺乏市场竞争力。
酶转化法虽然具有很大的优越性,但是在工业化方面有较大的困难,迄今还未见工业化生产成功的报道。
发酵法生产丙酮酸的研究起始于20世纪50年代。
日本学者经过近四十多年的研究选育出了丙酮酸的高产菌株,并于1989年实现了工业化发酵生产,其发酵产酸水平最高达67.8g/ L,转化率0.494g/g[4]。
丙酮酸含量测定一、目的:丙酮酸是一种重要的中间代谢物。
通过本实验掌握测定植物组织中丙酮酸含量的原理和方法,增加对代谢的感性认识。
二、原理:植物样品组织液用三氯乙酸除去蛋白质后,其中所含的丙酮酸可与 2,4- 二硝基苯阱反应,生成丙酮酸一 2 , 4 一二硝基苯踪,后者在碱性溶液中呈樱红色,其颜色深度可用分光光度计测量。
与同样处理的丙酮酸标准曲线进行比较,即可求得样品中丙酮酸的含量。
三、仪器、试剂、材料1、1.5 mol/L NaOH2、 8% 三氯乙酸3、 0.1% 2,4 一二硝基苯肼 4 、丙酮酸标准液5、.材料大蒜的鳞茎。
四、操作步骤1、.植物材料提取液的制备称取 0.5—1g大蒜于研钵内加适量 8% 三氯乙酸,仔细研成匀浆,再用 8% 三氯乙酸洗入 25ml 容量瓶,定容至刻度。
塞紧瓶塞,振摇提取,静置 30min 。
取约 10ml 匀浆液离心( 4000 r/min ) 10min ,上清液备用。
2、标准曲线制作(略)3、.组织液中丙酮酸的测定取 1. 0ml 上清液于一刻度试管中,加 2ml 8 %三氯乙酸,加 1.0ml 0.1%2.4 -二硝基苯肼液,摇匀,再加 5.0 ml 1.5mol/L, NaOH 溶液,摇匀显色,10min 后在 520 nm 波长下比色,记录吸光度,在标准曲线上查得测定管的丙酮酸含量。
五、结果处理丙酮酸含量(mg/g鲜重)=A*V*稀释倍数/样品重(g)*1000<P>式中, A 为在标准曲线上查得的丙酮酸的微克数。
V为提取液体积。
六、注意事项1. 所加试剂的顺序不可颠倒,先加丙酮酸标准液或待测液,再加 8% 三氯乙酸,最后加 1.5mol/ L NaOH 。
2 .应反应 10min 后再比色。
黄原胶中丙酮酸含量的研究
刘如林;李志明;施贻君;衡斌
【期刊名称】《微生物学杂志》
【年(卷),期】1989(000)004
【摘要】本文比较了野油菜黄单胞菌(Xanthomonas campestris)不同菌株及不同菌落在同一条件下以及N·K—01菌株在不同条件下所产黄原胶的丙酮酸含量;检查了不同丙酮酸含量黄原胶的流变学性质.研究表明,选择适当菌株,控制发酵条件,可以得到不同丙酮酸含量的黄原胶;胶中丙酮酸含量越高,其流变学性质越好.丙酮酸含量是黄原胶质量的重要指标。
【总页数】6页(P1-6)
【作者】刘如林;李志明;施贻君;衡斌
【作者单位】南开大学生物系;南开大学生物系;天津;天津
【正文语种】中文
【中图分类】Q93
【相关文献】
1.发酵因素对黄原胶丙酮酸含量的影响 [J], 刁虎欣;王建龙
2.添加游离丙酮酸对黄单胞杆菌产黄原胶中丙酮酸功能基团含量的影响 [J], 赵润宝;詹晓北;郑志永;张丽敏
3.离子色谱法测定黄原胶中丙酮酸含量 [J], 范诚;闫长虹;刘克清;符军放;刘卫丽;王超;丁玉
4.离子排斥法测定丙酮酸发酵提取液中的丙酮酸含量 [J], 左莹;李静;施超欧;谢小
波;刘霞
5.黄原胶发酵中丙酮酸含量的研究 [J], 李卫旗;姚恕
因版权原因,仅展示原文概要,查看原文内容请购买。
丙酮酸钠质量标准
丙酮酸钠是一种常用的化学试剂,在医药、化工等领域有着广泛的应用。
下面是一些丙酮酸钠的质量标准:
1. 外观:无色透明液体。
2. pH值:约为7.0-8.5。
3. 含量:丙酮酸钠的含量应不低于99%。
4. 杂质:丙酮酸钠应不含杂质、不含有害物质,如重金属、细菌等。
5. 水分:丙酮酸钠中的水分含量应不超过0.5%。
6. 溶解度:丙酮酸钠应能够完全溶解于水。
7. 稳定性:丙酮酸钠应具有一定的稳定性,不易分解、变质。
以上是一些常见的丙酮酸钠质量标准,不同的生产企业或应用领域可能会有不同的标准要求。
在使用丙酮酸钠时,应根据实际情况选择符合要求的产品,并按照正确的方法和剂量进行使用。
丙酮酸含量测定
一、目的:丙酮酸是一种重要的中间代谢物。
通过本实验掌握测定植物组织中丙酮酸含量的原理和方法,增加对代谢的感性认识。
二、原理:植物样品组织液用三氯乙酸除去蛋白质后,其中所含的丙酮酸可与 2,4- 二硝基苯阱反应,生成丙酮酸一 2 , 4 一二硝基苯踪,后者在碱性溶液中呈樱红色,其颜色深度可用分光光度计测量。
与同样处理的丙酮酸标准曲线进行比较,即可求得样品中丙酮酸的含量。
三、仪器、试剂、材料
1、1.5 mol/L NaOH
2、 8% 三氯乙酸
3、 0.1% 2,4 一二硝基苯肼 4 、丙酮酸标准液
5、.材料大蒜的鳞茎。
四、操作步骤
1、.植物材料提取液的制备
称取 0.5—1g大蒜于研钵内加适量 8% 三氯乙酸,仔细研成匀浆,再用 8% 三氯乙酸洗入 25ml 容量瓶,定容至刻度。
塞紧瓶塞,振摇提取,静置 30min 。
取约 10ml 匀浆液离心( 4000 r/min ) 10min ,上清液备用。
2、标准曲线制作(略)
3、.组织液中丙酮酸的测定
取 1. 0ml 上清液于一刻度试管中,加 2ml 8 %三氯乙酸,加 1.0ml 0.1%2.4 -二硝基苯肼液,摇匀,再加 5.0 ml 1.5mol/L, NaOH 溶液,摇匀显色,10min 后在 520 nm 波长下比色,记录吸光度,在标准曲线上查得测定管的丙酮酸含量。
五、结果处理
丙酮酸含量(mg/g鲜重)=A*V*稀释倍数/样品重(g)*1000
<P>式中, A 为在标准曲线上查得的丙酮酸的微克数。
V为提取液体积。
六、注意事项
1. 所加试剂的顺序不可颠倒,先加丙酮酸标准液或待测液,再加 8% 三氯乙酸,最后加 1.5mol/ L NaOH 。
2 .应反应 10min 后再比色。