丙酮酸的测定方法
- 格式:docx
- 大小:91.76 KB
- 文档页数:4




紫外分光光度法测定丙酮酸
紫外分光光度法是一种常用的分析方法,可以用于测定丙酮酸的浓度。
测定步骤如下:
1. 准备样品:将待测溶液中的丙酮酸转移至紫外光度计量筒中。
如果样品浓度较高,可以适当稀释。
2. 设置仪器:将紫外光度计设置在适当的波长,通常在190-400nm 之间选择一个合适的波长。
同时进行零点校准,即不加入样品的情况下记录光吸收。
3. 测量样品:将样品加入光度计量筒中,记录下吸光度值。
4. 计算浓度:根据比尔定律,计算出丙酮酸的浓度。
比尔定律表示吸光度与浓度之间呈线性关系。
需要注意的是,测定时要避免其他物质的干扰,确保样品中只含有丙酮酸。
同时,还需要注意选择适当的波长和合适的光程,以确保准确测量。
根据具体测定要求和样品特性,可能需要进行样品预处理、稀释或其他操作。
具体操作步骤应根据仪器和试剂的说明进行。

检测丙酮酸的存在方法有丙酮酸(Acetone)是一种重要的有机溶剂和中间体化合物,在化学、医药、化妆品等多个领域具有广泛的应用。
下面将介绍一些用于检测丙酮酸存在的方法。
1. 火焰光度法(Flame Photometry):火焰光度法是一种常用的检测丙酮酸存在的方法。
该方法基于丙酮酸在火焰中释放金属离子的特性。
将样品通过火焰燃烧,然后使用光度计测量火焰中金属离子的发射光谱,根据发射光信号的强度进行分析和测定。
2. 气相色谱法(Gas Chromatography, GC):气相色谱法是一种高效、灵敏的分析方法,可以用于检测丙酮酸的存在。
该方法将待测样品中的丙酮酸通过气相色谱柱分离,并通过检测器检测产生的色谱峰来进行定性和定量分析。
3. 液相色谱法(Liquid Chromatography, LC):液相色谱法是一种广泛应用于生化分析中的方法,也可以用于检测丙酮酸的存在。
通常采用高效液相色谱(High Performance Liquid Chromatography, HPLC)分析仪器,通过样品与流动相之间的相互作用(如吸附、分配、亲和等)来实现分离和检测。
4. 分光光度法(Spectrophotometry):分光光度法是一种常用的定量分析方法,也适用于丙酮酸的检测。
此方法基于化合物与特定试剂反应后在特定波长范围内吸收或散射光线,利用分光光度计测量吸光度或透射率,并根据标准曲线确定丙酮酸的浓度。
5. Raman光谱法:Raman光谱法是一种非破坏性的分析技术,可以用于无需前处理的丙酮酸检测。
根据样品中分子键振动产生的拉曼散射光谱,通过光谱解析和比对来确定丙酮酸的存在。
6. 红外光谱法(Infrared Spectroscopy):红外光谱法基于物质吸收红外辐射的特性,可以用于检测丙酮酸。
该方法通过分析丙酮酸分子中化学键振动能级的吸收峰,来确定其存在和浓度。
7. 质谱法(Mass Spectrometry, MS):质谱法是一种高灵敏度、高分辨率的分析方法,可用于定性和定量分析。

双试剂法测定alt原理
ALT(谷丙转氨酶)双试剂法测定的原理是:先让血清与缺少α-酮戊二酸的底物溶液混合,37℃保温5min,使样品中所含的α-酮酸(如丙酮酸)引起的副反应进行完毕。
然后,加入α-酮戊二酸启动ALT的催化反应,在波长340nm处连续监测吸光度下降速率。
根据线性反应期吸光度下降速率(-△A/min),计算出ALT活力单位。
双试剂法相对于单试剂法有一定的优势,如试剂可以存放时间比较长,应用方便,并且在操作过程中可以更有效地排除血液中其他成分对检测结果的干扰,达到准确测量转氨酶水平的目的。

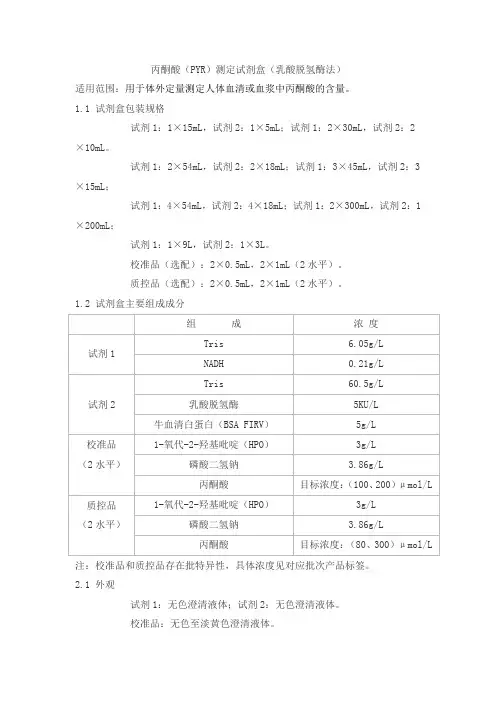
丙酮酸(PYR)测定试剂盒(乳酸脱氢酶法)适用范围:用于体外定量测定人体血清或血浆中丙酮酸的含量。
1.1 试剂盒包装规格试剂1:1×15mL,试剂2:1×5mL;试剂1:2×30mL,试剂2:2×10mL。
试剂1:2×54mL,试剂2:2×18mL;试剂1:3×45mL,试剂2:3×15mL;试剂1:4×54mL,试剂2:4×18mL;试剂1:2×300mL,试剂2:1×200mL;试剂1:1×9L,试剂2:1×3L。
校准品(选配):2×0.5mL,2×1mL(2水平)。
质控品(选配):2×0.5mL,2×1mL(2水平)。
1.2 试剂盒主要组成成分注:校准品和质控品存在批特异性,具体浓度见对应批次产品标签。
2.1 外观试剂1:无色澄清液体;试剂2:无色澄清液体。
校准品:无色至淡黄色澄清液体。
质控品:无色至淡黄色澄清液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 试剂空白吸光度在37℃、340nm波长、1cm光径条件下,试剂空白吸光度应不小于0.5。
2.4 分析灵敏度测定浓度在200µmol/L附近的样本时,吸光度变化值(ΔA)应不小于0.02。
2.5 线性在(30,1200)µmol/L线性范围内,线性相关系数r不小于0.990。
在(150,1200)µmol/L范围内的线性相对偏差不大于±10%;测定结果(30,150]µmol/L时线性绝对偏差不大于±15µmol/L。
2.6 重复性重复测试高低浓度的样本,所得结果的变异系数(CV%)应不大于8%。
2.7 批间差不同批号试剂测试同一份样本,测定结果的批间相对极差应不大于10%。
2.8 准确度与已上市产品进行比对试验,在(30,1200)µmol/L范围内,与比对系统的相关系数r不小于0.975;在(100,1200)µmol/L区间内与比对系统的相对偏差应不大于±15%,(30,100] µmol/L区间内与比对系统的绝对偏差应不大于±15µmol/L。

核磁共振法测定丙酮酸水解反应的速度常数及化学平衡常数一. 实验目的:1. 了解核磁共振仪的基本原理,操作及基本图谱解析2. 利用核磁共振仪测定丙酮酸水解正逆反应的速度常数及平衡常数二.实验原理:核磁共振仪现已成为有机化学中新型化合物结构鉴定中的不可缺少的工具,另外在其它学科中也日益得到广泛的应用,如生物技术、材料化学、分析化学、物理化学……本实验是利用核磁共振谱图给出的特定信息来测定物理化学中物质的物性常数----物质发生化学反应的速度常数及平衡常数。
核磁共振峰的化学位移反映了共振核的不同化学环境。
当一种共振核在两种不同状态之间快速交换时,共振峰的位置是这两种状态化学位移的权重平均值。
共振峰的半高宽∆ω与核在该状态下平均寿命τ有直接关系。
因此,峰的化学位移、峰位置的变化、峰形状的改变等均为物质的化学反应过程提供了重要信息。
本实验所用丙酮酸水解反应是许多含有羰基的化合物在水溶液中常见的酸碱催化反应。
1.丙酮酸水解反应的原理:丙酮酸在酸性溶液中会水解为2,2-二羟基丙酸,这是一个可逆水解反应,可用下式表示:CH 3C OCOOH + H 2OrCH 3C OHCOOH OH(1)在这个实验中,核磁共振技术可用于测定正逆反应的速度常数k f ,k r 及平衡常数K .象许多其它的有机化合物一样,这是一个酸催化反应,H +浓度会对反应动力学有影响。
丙酮酸水解反应的机理如下:I: CH 3C COOH O+H+CH 3C COOH OH+(2)此步可快速平衡,平衡常数为K 1。
II: CH 3C COOH OH++H ++H 2OCH 3C COOH OHOHfHk Hr(3)这里引入缩写的概念:A= CH 3COCOOH ,B= CH 3C(OH)2COOH ,AH += CH 3C +OHCOOH B 的生成速度由步骤II 决定,所以: B H r 1AH f1B d d c c k c k tc ++-= (4a) B H r 1A H 1f 1c c k c c K k ++-=(4b)B H r H A H f H c c k c c k ++-=(5)方程(4b)利用了步骤I 反应可很快达到平衡,故++=H A AH 1c c c K 。

货号:MS2201 规格:100管/96样丙酮酸激酶(Pyruvate kinase,PK)试剂盒说明书微量法正式测定前务必取2-3个预期差异较大的样本做预测定测定意义:PK(EC 2.7.1.40)广泛存在于动物、植物、微生物和培养细胞中,催化糖酵解过程中的最后一步反应,是糖酵解过程中的主要限速酶之一,也是产生ATP的关键酶之一,因此测定PK活性具有重要意义。
测定原理:PK催化磷酸烯醇式丙酮酸和ADP生成ATP和丙酮酸,乳酸脱氢酶进一步催化NADH和丙酮酸生成乳酸和NAD+,在340nm下测定NADH下降速率,即可反映PK活性。
自备实验用品及仪器:紫外分光光度计/酶标仪、台式离心机、水浴锅、可调式移液器、微量石英比色皿/96孔板、研钵、冰和蒸馏水试剂的组成和配制:提取液:100mL×1瓶,4℃保存;试剂一:液体20mL×1瓶,4℃保存;;试剂二:粉剂×1支,-20℃保存;试剂三:液体17μL×1支,4℃保存;样本的前处理:1、细菌或培养细胞:先收集细菌或细胞到离心管内,离心后弃上清;按照细菌或细胞数量(104个):提取液体积(mL)为500~1000:1的比例(建议500万细菌或细胞加入1mL提取液),超声波破碎细菌或细胞(冰浴,功率20%或200W,超声3s,间隔10s,重复30次);8000g 4℃离心10min,取上清,置冰上待测。
2、组织:按照组织质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL提取液),进行冰浴匀浆。
8000g 4℃离心10min,取上清,置冰上待测。
3、血清(浆)样品:直接检测。
测定步骤:1、分光光度计或酶标仪预热30min以上,调节波长至340nm,蒸馏水调零。
2、样本测定(1)在试剂二瓶中加入17mL试剂一和1mL蒸馏水充分溶解,置于37℃(哺乳动物)或25℃(其它物种)水浴5min;用不完的试剂分装后-20℃保存,禁止反复冻融。

实验七丙酮酸含量的测定一、实验目的掌握植物组织中丙酮酸含量测定的原理和方法;二、实验原理植物样品中的组织液,用三氯乙酸去蛋白质后,其中所含的丙酮酸可与2,4—二硝基苯肼作用,生成丙酮酸—2,4—二硝基苯腙,后者在碱性溶液中呈樱红色,其颜色可用分光光度计测量,与已知丙酮酸标准曲线进行比较,即可求得样品中丙酮酸的含量;三、实验器材与试剂1、.实验器材分光光度计;研钵;具塞刻度试管:20mL×8;容量瓶:100mL×2;移液管:1mL×15mL×4;量筒:10mL×1;离心机;天平;大蒜、大葱或洋葱2、试剂18%三氯乙酸当日配制置冰箱中备用21.5mol/L氢氧化钠30.1%2,4—二硝基苯肼:称取2.4—二硝基苯肼100mL,溶于2mol/LHCl中配成100mL溶液,盛入棕色试剂瓶,保存于冰箱内;4丙酮酸钠四、实验操作步骤1.丙酮酸标准曲线的制作:称取丙酮酸钠7.5mg于烧杯中,用8%三氯乙酸溶解,转入100mL容量瓶中,并用8%三氯乙酸定容,此液为60μg/mL的丙酮酸原液;取6支试管,按下表数据配制不同浓度的丙酮酸标准液:1 2 3 4 5 6管号丙酮酸原液量mL 0 0.6 1.2 1.8 2.4 3.0 8%三氯乙酸量mL 3.0 2.4 1.8 1.2 0.6 0 丙酮酸浓度μg/mL0 12 24 36 48 601.5mol/L的氢氧化钠溶液,摇匀显色,在520nm波长下比色;做标准曲线;2.植物样品组织液的提取:称取植物样品大蒜、大葱或洋葱5g,于研钵中加入少许石英沙及少量8%三氯乙酸,仔细研成匀浆,再用8%三氯乙酸洗入100mL容量瓶中沙留在研钵内,定容至刻度;静置30min,取10mL匀浆液离心4000r/min10min,取上清液备用;3.组织液中丙酮酸的测定1.5mol/L氢氧化钠溶液,摇匀显色;在520nm波长下比色,记录吸光度,在标准曲线上查得丙酮酸的含量;五、结果处理式中:A—标准曲线中查得的丙酮酸克数;六、思考题:测定丙酮酸含量的基本原理是什么。
血清钾离子的丙酮酸激酶法测定概述1. 本文旨在探讨血清钾离子的丙酮酸激酶法测定方法及其临床应用意义。
高钾血症是一种常见的临床情况,及时准确地测定血清钾离子水平对于临床诊断和治疗具有重要意义。
而丙酮酸激酶法是目前用于测定血清钾离子的一种常见方法。
测定原理2. 丙酮酸激酶法是一种酶动力学测定法,其基本原理是利用丙酮酸激酶催化反应将丙酮酸和辅酶A反应生成乙醛和丙酮酸,同时转移ADP 磷酸根生成ATP。
而在此反应过程中,ADP的浓度与生成的乙醛分子数量成正比,因此可以通过检测ADP的浓度来间接测定血清钾离子的水平。
实验操作3. 取血清标本并离心制备样品;加入适量的丙酮酸激酶、辅酶A、ATP和谷氨酸钾盐,混合后在37摄氏度恒温下进行反应;通过添加一种特定的酶来将生成的乙醛转化成乙酸,然后测定反应前后ADP的浓度变化,从而得出血清钾离子的水平。
临床应用4. 丙酮酸激酶法测定血清钾离子水平在临床应用中具有重要意义。
血清钾离子水平的异常变化可以反映出机体内部的一些疾病情况,比如肾脏疾病、糖尿病、心脏病等。
血清钾离子水平的测定可以指导临床药物治疗,及时调整药物剂量,避免药物不良反应的发生。
丙酮酸激酶法测定血清钾离子水平在临床中具有非常重要的意义。
优缺点5. 丙酮酸激酶法作为一种常用的血清钾离子测定方法,具有诸多优点。
此法操作简便,结果准确可靠,且不受血清中其它物质影响;此法对常见的医用药物没有干扰作用,具有很高的特异性。
然而,此法也存在一些缺点,比如对实验条件要求较高,需要较为精确的实验操作和配制试剂,且操作流程较为繁琐。
总结6. 丙酮酸激酶法测定血清钾离子的水平是一种简单、可靠的方法,具有重要的临床意义。
在临床诊断和治疗中,准确测定血清钾离子水平对于指导治疗具有重要的意义。
然而,我们也需要进一步了解此方法的优缺点,并在实际操作中严格按照操作步骤进行,以保证测定结果的准确性和可靠性。
希望本文对读者了解血清钾离子的丙酮酸激酶法测定方法有所帮助。
测定丙酮酸含量的基本原理
测定丙酮酸含量的基本原理是利用化学反应或仪器分析的方法来确定样品中丙酮酸的浓度。
一种常用的方法是通过酸碱中和反应进行测定。
首先,将含有丙酮酸的样品溶解在适当的溶剂中,得到丙酮酸溶液。
然后,将丙酮酸溶液滴定至中性终点。
在滴定过程中,加入酸碱指示剂,如酚酞或溴丙酚绿等,使溶液产生颜色变化。
当溶液中的丙酮酸被完全中和时,颜色发生明显变化,表示反应终点达到。
根据滴定液的体积和已知的滴定液浓度,可以计算出丙酮酸的浓度。
另一种常用的方法是利用光谱分析仪器测定丙酮酸的含量。
这种方法称为分光光度法。
首先,将样品制备成适当的溶液,并将其放置在光谱分析仪器中。
然后,根据丙酮酸分子的特定吸收波长,在特定波长下测量样品的吸光度。
根据比色法或比浊法,可以将吸光度与丙酮酸的浓度相关联。
通过构建标准曲线,可以准确测定未知样品中丙酮酸的含量。
除了以上提到的方法,还有其他一些测定丙酮酸含量的基本原理,如电化学分析方法、色谱分析方法等,这些方法的原理和操作过程可以根据实际需要选择合适的方法进行测定。
丙酮酸溶解度丙酮酸是一种有机化合物,化学式为C3H6O3。
丙酮酸与水的相容性较好,在常温下可以溶解于水中,形成无色的溶液。
丙酮酸溶液的酸碱性较弱,pH值在5-6左右。
丙酮酸的溶解度受到多种因素影响,包括温度、溶剂、溶质浓度等。
以下是一些相关参考内容,以帮助了解丙酮酸的溶解度特性。
1. 温度对丙酮酸溶解度的影响温度是影响溶质溶解度的重要因素之一。
一般来说,固体物质在溶剂中的溶解度随着温度的升高而增加。
对于丙酮酸而言,其在水中的溶解度也随着温度的升高而增加。
实验研究表明,在室温下,丙酮酸可以完全溶解于水中。
随着温度的升高,丙酮酸的溶解度也随之增加。
但需要注意的是,当温度超过一定范围时,丙酮酸可能发生分解反应,导致其溶解度的下降。
2. 溶剂对丙酮酸溶解度的影响溶剂的性质对溶质的溶解度也有一定的影响。
除水外,丙酮酸还可以溶解于一些有机溶剂中,如乙醇、丙酮等。
这些有机溶剂的极性较高,能够与丙酮酸分子发生相互作用,从而促进其溶解。
但与水相比,这些有机溶剂的溶解度较低。
3. 溶质浓度对丙酮酸溶解度的影响溶质浓度是指单位体积内溶质的质量。
一般来说,溶剂中溶质的溶解度与其浓度成正比关系。
对于丙酮酸而言,其溶解度与其浓度也存在一定的关系。
当丙酮酸的浓度较高时,其在溶剂中的溶解度也相应较高。
但需要注意的是,随着溶质浓度的增加,溶剂中溶质分子间相互作用的增强可能导致溶解度的下降。
总之,丙酮酸的溶解度受到多种因素的影响,包括温度、溶剂、溶质浓度等。
为了更准确地确定丙酮酸的溶解度,可以通过实验方法进行测定,并结合理论模型进行分析。
同时,还可以参考相关文献和研究成果,以进一步了解丙酮酸的溶解度特性。
丙酮酸的测定方法内部编号:(YUUT-TBBY-MMUT-URRUY-UOOY-DBUYI-0128)
实验七丙酮酸含量的测定
一、实验目的
掌握植物组织中丙酮酸含量测定的原理和方法。
二、实验原理
植物样品中的组织液,用三氯乙酸去蛋白质后,其中所含的丙酮酸可与2,4—二硝基苯肼作用,生成丙酮酸—2,4—二硝基苯腙,后者在碱性溶液中呈樱红色,其颜色可用分光光度计测量,与已知丙酮酸标准曲线进行比较,即可求得样品中丙酮酸的含量。
三、实验器材与试剂
1、.实验器材
分光光度计;研钵;具塞刻度试管:20mL×8;容量瓶:100mL×2;移液管:
1mL×15mL×4;
量筒:10mL×1;离心机;天平;
大蒜、大葱或洋葱
2、试剂
(1)8%三氯乙酸(当日配制置冰箱中备用)
(2)1.5mol/L氢氧化钠
(3)0.1%2,4—二硝基苯肼:称取2.4—二硝基苯肼100mL,溶于2mol/LHCl中配成100mL溶液,盛入棕色试剂瓶,保存于冰箱内。
(4)丙酮酸钠
四、实验操作步骤
1.丙酮酸标准曲线的制作:
称取丙酮酸钠7.5mg于烧杯中,用8%三氯乙酸溶解,转入100mL容量瓶中,并用8%三氯乙酸定容,此液为60μg/mL的丙酮酸原液。
取6支试管,按下表数据配制不同浓度的丙酮酸标准液:
1.5mol/L的氢氧化钠溶液,摇匀显色,在520nm波长下比色。
做标准曲线。
2.植物样品组织液的提取:
称取植物样品(大蒜、大葱或洋葱)5g,于研钵中加入少许石英沙及少量8%三氯乙酸,仔细研成匀浆,再用8%三氯乙酸洗入100mL容量瓶中(沙留在研钵内),
定容至刻度。
静置30min,取10mL匀浆液离心(4000r/min)10min,取上清液备用。
3.组织液中丙酮酸的测定1.5mol/L氢氧化钠溶液,摇匀显色。
在520nm波长下比色,记录吸光度,在标准曲线上查得丙酮酸的含量。
五、结果处理
式中:A—标准曲线中查得的丙酮酸克数。
六、思考题:测定丙酮酸含量的基本原理是什么?。