麦克斯韦气体速率分布律
- 格式:doc
- 大小:152.00 KB
- 文档页数:6

麦克斯韦气体速率分布律Maxwell Velocity Distribution大家知道,由气体的温度公式可以得出气体分子的方均根速率。
例如在时,氦气。
氧气。
但我们要注意的是,方均根速率仅是运动速率的一种统计平均值,并非气体分子都以方均根速率运动。
事实上,处于平衡状态下的任何一种气体,各个分子均以不同的速率、沿各个方向运动着。
有的速率大于方均根速率,有的速率小于方均根速率,它们的速率可以取零到无穷大之间的任意值。
而且由于气体分子间的相互碰撞,每个分子的速度也在不断地改变,所以在某一时刻,对某个分子来说,其速度的大小和方向完全是偶然的。
然而就大量分子整体而言,在平衡状态下,分子的速率分布遵守一个完全确定的统计性分布规律又是必然的。
下面我们介绍麦克斯韦应用统计理论和方法导出的分子速率分布规律。
气体分子按速率分布的统计规律,最早是由麦克斯韦于1859年在概率论的基础上导出的,1877年玻耳兹曼由经典统计力学中也导出该规律。
由于技术条件的限制,测定气体分子速率分布的实验,直到本世纪二十年代才实现。
1920年斯特恩(O.Stern首先测出银蒸汽分子的速率分布;1934年我国物理学家葛正权测出铋蒸汽分子的速率分布;1955年密勒(Mlier和库士(Kusch测出钍蒸汽分子的速率分布。
斯特恩实验是历史上最早验证麦克斯韦速率分布律的实验。
限于数学上的原因和本课程的要求,我们不推导这个定律,只介绍它的一些基本内容。
*麦克斯韦(J. C. Maxwell,1831—1879)英国物理学家,经典电磁理论的奠基人,气体动理论的创始人之一。
他提出了有旋电场和位移电流概念,建立了经典电磁理论,这个理论包括电磁现象的所有基本定律,并预言了以光速传播的电磁波的存在。
1873年,他的《电磁学通论》问世,这本书凝聚着杜费、富烂克林、库仑、奥斯特、安培、法拉第……的心血,这是一本划时代巨著,它与牛顿时代的《自然哲学的数学原理》并驾齐驱,它是人类探索电磁规律的一个里程碑。



麦克斯韦气体速率分布律推导麦克斯韦-玻尔兹曼速率分布律描述了理想气体中分子速度的统计分布。
以下是该分布律的推导过程。
首先,考虑一个由大量相同分子组成的理想气体,这些分子在容器中随机、无序地运动。
由于分子间的碰撞非常频繁,我们可以假定每个分子的运动是相互独立的。
我们的目标是求出分子速率的分布函数。
1. 假设分子的运动是三维的随机运动,并且分子间无相互作用力。
2. 假设分子的运动是各向同性的,即在任何方向上运动的概率都是相等的。
3. 假设分子的运动是稳定的,即分子的速率分布不随时间改变。
4. 引入分子速度的微分元素d³v,表示速度在v到v+dv之间的分子数。
5. 引入微元体积元素dV和微元时间元素dt。
接下来,我们将使用微元分析法来推导速率分布律。
对于一个具有速率v的分子,在时间dt内,它将沿着速度方向移动的距离为v·dt。
因此,它所扫过的体积元素为dV = v²·cos²(θ)·sin(θ)·dv·dt,其中θ是速度方向与某一选定方向(通常是x轴)的夹角。
现在,考虑在dt时间内所有具有速率v的分子所扫过的体积总和,即所有可能的方向θ的贡献。
由于θ的取值范围是0到π,我们可以将上述体积元素乘以角度元素dθ(从0到π)并积分,以得到总的体积元素dV_total:dV_total = ∫(v²·cos²(θ)·sin(θ)·dv)·dθ·dt由于cos²(θ)·sin(θ)是关于θ的偶函数,而在0到π的范围内积分,它的积分结果为零。
为了解决这个问题,我们需要考虑在速度方向上的微小位移。
在速度方向上的微小位移为v·cos(θ)·dt,因此,在dt时间内,具有速率v的分子在速度方向上的微小体积元素为dV_v = v·cos(θ)·dv·dt。



麦克斯韦速度分布律公式麦克斯韦速度分布律麦克斯韦速度分布律是统计物理学中描述理想气体速度分布的重要定律之一。
它描述了在给定温度下,气体分子速度的分布情况。
以下是与麦克斯韦速度分布律相关的公式和解释说明:麦克斯韦速度分布律公式1.麦克斯韦速度分布函数:f(v) = (m / (2 * π * k * T) )^(3/2) * 4 * π * v^2 * exp(-m*v^2 / (2 * k * T))其中,f(v)是速度的概率密度函数,m是分子的质量,k是玻尔兹曼常数,T是气体的温度,v是速度。
2.平均速度:<v> = ∫(v * f(v)) dv计算麦克斯韦速度分布函数与速度的乘积的积分,求得平均速度。
3.均方根速度:vrms = √(3 * k * T / m)均方根速度描述了气体中分子速度的大小,它是所有分子速度平方的平均值的平方根。
麦克斯韦速度分布律解释以下是对麦克斯韦速度分布律公式的解释说明和例子:1.麦克斯韦速度分布函数公式解释:麦克斯韦速度分布函数表示了在给定温度下,速度在不同取值上的概率密度。
函数中的指数项含有一个负号,指数的绝对值大小与速度的平方成正比,即速度越大,对应的指数项越小,概率越小。
这符合物质中分子速度的分布趋势,常见的速度大都集中在某个范围内。
2.平均速度解释:平均速度表示在给定温度下,所有可能速度的加权平均值。
将速度与麦克斯韦速度分布函数相乘后积分,可以得到平均速度。
这意味着在一个气体体系中,速度的概率分布决定了平均速度的大小。
3.均方根速度解释:均方根速度是速度分布的一种描述方式,它描述了速度的大小和分散程度。
均方根速度是气体中所有分子速度平方的平均值的平方根。
根据麦克斯韦速度分布律,均方根速度与温度呈正比,与分子质量的平方根成反比。
总结麦克斯韦速度分布律是描述气体速度分布的重要定律,通过麦克斯韦速度分布函数、平均速度和均方根速度等公式,我们可以计算在给定温度下,气体分子速度的分布情况。

麦克斯韦速度分布定律麦克斯韦速度分布定律是描述气体分子速度分布的统计规律之一,由19世纪末的苏格兰物理学家詹姆斯·麦克斯韦提出。
该定律在热力学和统计物理学中有着广泛的应用,能够揭示气体分子运动特征,对于理解气体动力学和热传导等现象具有重要意义。
根据麦克斯韦速度分布定律,理想气体分子的速度服从麦克斯韦-玻尔兹曼速度分布。
其概率密度函数为:f(v) = (m / (2πkT))^(3/2) * 4πv^2 * e^(-mv^2 / (2kT))其中,f(v)表示速度为v的分子的概率密度,m为分子质量,k为玻尔兹曼常数,T为气体温度。
该概率密度函数描述了气体分子速度的分布情况。
根据这一函数,可以得到气体分子不同速度下的概率密度,以及平均速度、平均速度的平方等相关参数。
麦克斯韦速度分布定律具体刻画了速度分布的趋势,从而为研究气体热力学性质提供了重要依据。
根据麦克斯韦速度分布定律可以得到以下几个重要结论:1. 峰值速度:麦克斯韦速度分布定律的概率密度函数在具体速度处取得最大值,即存在一个峰值速度。
这个峰值速度与气体的温度和质量有关,温度越高或质量越小,峰值速度越大。
2. 平均速度:根据麦克斯韦速度分布定律,可以计算出气体分子的平均速度。
平均速度与系统的温度有关,随着温度的升高,平均速度也增加。
3. 速度分散度:麦克斯韦速度分布定律还可以用来计算气体分子速度的分散度。
速度分散度可以通过计算速率最大值附近的速度范围来确定。
由于速度分散度对于描述气体的输运性质至关重要,因此,该定律在研究气体动力学和热学性质时经常被应用。
麦克斯韦速度分布定律是热力学和统计物理学中的重要模型,它将分子速度的概率分布与系统的热力学性质联系在一起。
通过该定律,我们可以更好地理解气体分子的运动规律,研究气体的输运性质和热传导现象。
同时,在工程和科学领域的应用中,麦克斯韦速度分布定律也为材料设计、能源开发和天文物理学等提供了重要指导。

麦克斯韦速率分布律介绍麦克斯韦速率分布律是描述理想气体粒子速度分布的统计物理学定律。
它是由19世纪物理学家詹姆斯·麦克斯韦提出的,通过分析气体分子的碰撞和运动,揭示了粒子速度的分布规律。
麦克斯韦速率分布律在理解和研究气体的性质和行为方面起着重要作用。
物理背景在理想气体状态下,气体分子间无相互作用力,分子之间碰撞时可以视为弹性碰撞,满足动量守恒和能量守恒。
根据统计物理学的理论,在给定温度下,气体粒子的速度具有一定范围的分布。
麦克斯韦速率分布函数麦克斯韦速率分布函数是描述理想气体速度分布的函数,可以用来计算在给定温度下不同速度范围内气体分子的数量。
麦克斯韦速率分布函数的形式为:[f(v)=4()^{3/2} v^2 e^{-}]其中,[f(v)]为速度为[v]的气体分子的数量,[m]为分子的质量,[k]为玻尔兹曼常数,[T]为气体的温度。
速度分布特点根据麦克斯韦速率分布律,气体分子的速度分布具有以下特点:1. 最概然速度最概然速度是指在给定温度下,气体粒子速度分布函数的峰值对应的速度值[v_p]。
最概然速度与温度无关,只取决于粒子的质量。
最概然速度可以通过对速度分布函数求导并令导数等于零来求得。
2. 平均速度平均速度是指在给定温度下,所有速度可能取值的加权平均值。
根据麦克斯韦速率分布律,平均速度与温度成正比,与粒子质量无关。
3. 方均根速度方均根速度是指在给定温度下,速度平方的平均值的开平方。
方均根速度与温度成正比,与粒子质量无关。
麦克斯韦速率分布律的应用麦克斯韦速率分布律在研究气体性质和行为时具有广泛的应用。
以下是一些麦克斯韦速率分布律的应用:1. 气体的热容根据麦克斯韦速率分布律可以计算出给定温度下气体分子的平均动能和热容。
热容是指单位物质在温度变化下吸收或释放的热量。
通过麦克斯韦速率分布律,我们可以计算气体的平均动能,并根据统计物理学的理论将其与热容联系起来。
2. 气体的扩散速率扩散是指气体中各个分子在温度梯度下的运动。
麦克斯韦气体速率分布律Maxwell Velocity Distribution大家知道,由气体的温度公式 T N R kT v m A 2323212==可以得出气体分子的方均根速率MRT m kT v 332==。
例如在C ︒0时,氦气sm v 13052=。
氧气s m v 4612=。
但我们要注意的是,方均根速率仅是运动速率的一种统计平均值,并非气体分子都以方均根速率运动。
事实上,处于平衡状态下的任何一种气体,各个分子均以不同的速率、沿各个方向运动着。
有的速率大于方均根速率,有的速率小于方均根速率,它们的速率可以取零到无穷大之间的任意值。
而且由于气体分子间的相互碰撞,每个分子的速度也在不断地改变,所以在某一时刻,对某个分子来说,其速度的大小和方向完全是偶然的。
然而就大量分子整体而言,在平衡状态下,分子的速率分布遵守一个完全确定的统计性分布规律又是必然的。
下面我们介绍麦克斯韦应用统计理论和方法导出的分子速率分布规律。
气体分子按速率分布的统计规律,最早是由麦克斯韦于1859年在概率论的基础上导出的,1877年玻耳兹曼由经典统计力学中也导出该规律。
由于技术条件的限制,测定气体分子速率分布的实验,直到本世纪二十年代才实现。
1920年斯特恩(O.Stern)首先测出银蒸汽分子的速率分布;1934年我国物理学家葛正权测出铋蒸汽分子的速率分布;1955年密勒(Mlier)和库士(Kusch)测出钍蒸汽分子的速率分布。
斯特恩实验是历史上最早验证麦克斯韦速率分布律的实验。
限于数学上的原因和本课程的要求,我们不推导这个定律,只介绍它的一些基本内容。
*麦克斯韦(J. C. Maxwell ,1831—1879)英国物理学家,经典电磁理论的奠基人,气体动理论的创始人之一。
他提出了有旋电场和位移电流概念,建立了经典电磁理论,这个理论包括电磁现象的所有基本定律,并预言了以光速传播的电磁波的存在。
1873年,他的《电磁学通论》问世,这本书凝聚着杜费、富烂克林、库仑、奥斯特、安培、法拉第……的心血,这是一本划时代巨著,它与牛顿时代的《自然哲学的数学原理》并驾齐驱,它是人类探索电磁规律的一个里程碑。
在气体动理论方面,他还提出气体分子按速率分布的统计规律。
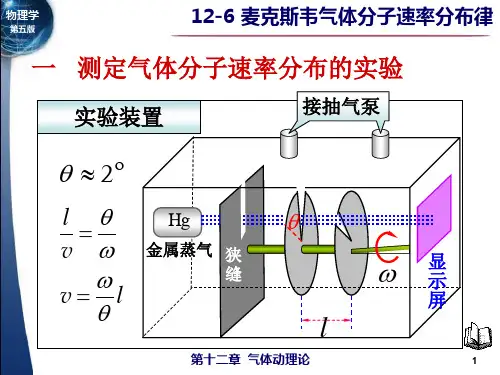
一、测定气体分子速率的实验1.实验装置A ——蒸汽源,常用汞蒸汽BC ——速度选择器D ——显示屏2.实验原理当圆盘B 、C 以角速度ω转动时,每转动一周,分子射线通过圆盘一次,由于分子的速率不一样,分子由B 到C 的时间不一样,所以并非所有通过B 的分子都能够通过C 达到显示屏D ,只有速率满足下式的分子才能通过C 达到Dωθ=v l 即 l v θω=实际上当圆盘B 、C 以角速度ω转动时,能射到显示屏D 上的,只有分子射线中速率在v →v+Δv 区间内的分子。
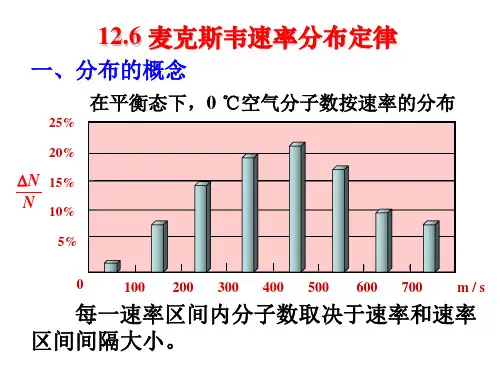
3.实验结果当圆盘以不同的角速率转动时,从显示屏上可测量出每次所沉积的金属层的厚度,各次沉积的厚度对应于不同速率间隔内的分子数,比较这些厚度,就可以知道在分子射线中,在不同速率间隔内的分子数与总分子数的比率,即相对分子数。
1)分子数在总分子数中所占的比率与速率和速率间隔的大小有关;2)速率特别大和特别小的分子数的比率非常小;3)在某一速率附近的分子数的比率最大;4)改变气体的种类或气体的温度时,上述分布情况有所差别,但都具有上述特点。
二、麦克斯韦分子速率分布定律1.速率分布函数令N 表示一定量的气体所包含的总分子数,dN 表示速率分布在v →v+d v 内的分子数,dN/N 表示在这一速率区间内的分子数占总分子数的百分率。
由实验可知,dN/N 与d v 成正比,且与速率v 有关,我们把这个关系写成如下的形式dv v f N dN )(= 式中NdvdN v f =)(此函数能够定量地反映给定气体在平衡态下速率分布的具体情况,我们把这个函数称为速率分布函数。
2.麦克斯韦气体分子速率分布律1859年,麦克斯韦运用统计理论导出气体分子按速率分布的规律:当气体处于平衡态时,分布在任一速率间隔v →v+d v 内的分子数占总分子数的比率为dv v e kT m N dN kT mv 222/322 4-⎪⎭⎫ ⎝⎛=ππ这个结论称为麦克斯韦速率分布律。
式中 m 是分子的质量;T 是热力学温度;k 是玻耳兹曼常量。
而)(v f 为222/322 4)(v e kT m v f kT mv -⎪⎭⎫ ⎝⎛=ππ——速率分布函数f(v)的物理意义:f(v)表示气体分子在速率v 附近单位速率间隔内的分子数占总分子数的百分率。
或气体任一分子速率恰在v 附近单位速率间隔内的几率。
这样f(v)的大小就定量地反映了在温度T 时,分子按速率分布的具体情况。
如果画出f(v)—— v 的变化曲线,也就是速率分布曲线,如右图,它与实验得到的分布结果吻合。
说明速率分布函数是符合实际的。
为了加深地理解,我们作以下说明:1)几率:在任一速率区间v →v+d v 上,取以分布函数NdvdN v f =)(的量值为高,以速率间隔dv 为宽的窄条的面积为N dN dv Ndv dN =⋅,也就是分布在该区间内的分子数占总分子数的百分率;或任一分子速率恰在该区间隔的几率。
2)⎰21)(vv dv v f N dN =表示速率分布在v 1→v 2内的分子数占总分子数的百分率。
或说任一分子速率恰在v 1→v 2区间隔的几率。
3)归一化条件(Normalization Condition )速率分布曲线下的总面积,表示各个速率区间内分子数的百分率的总和,即百分之百,应等于1。
⎰⎰∞==001)(N N dN dv v f这个关系是由f(v)本身的意义所决定的,或者说是f(v)必须满足的条件,故称其为分布函数的归一化条件。
4)速率分布曲线以速率v 为横轴,以速率分布函数f(v)为纵轴,可作出速率分布曲线。
由此曲线可看出,曲线有一极大值,与此极大值对应的速率叫最概然速率(最可几速率),它的物理意义在下面讨论,另外从速率分布曲线的形状看出:具有很大速率和很小速率的分子的百分比都很小。
三、气体分子的三种统计速率气体分子的速率可以在零到无穷大之间,速率很大和很小的分子的相对分子数较小,而具有中等速率的分子所占总分子数的比率较大。
这里讨论三种具有代表性的分子的速率,它们是分子速率的三种统计值。
1.最概然速率(the most probable speed )1)定义:从f(v)与v 的关系曲线图中可以看出,f(v)有一极大值,与f(v)的极大值相对应的速率叫做最概然速率,用v p 表示。
2)物理意义:在一定温度下,气体分子分布在最概然速率附近的单位速率间隔内的相对分子数最大。
它的值是由速率分布函数对v 求一阶导数并令其为零得到,即()0==p v v dv v df因而可得m kT v p 2=用摩尔质量表示,有MRT M RT mN kTN v A A p 41.122===注意:最概然速率并不是最大速率。
2.平均速率(mean speed )1)定义:大量气体分子速率的算术平均值叫做平均速率,用v 表示。
N v N N v N v i i i i i ∑∑∑==2)计算:如取dN 代表气体分子在v →v+d v 间隔内的分子数,则平均速率可由积分计算NvdN v ⎰=由速率分布函数可得 dv v Nf dN )(=因而平均速率为⎰⎰⎰==dv v vf Ndv v vNf N vdN v )()(= 考虑到 222/322 4)(v e kT m v f kT mv -⎪⎭⎫ ⎝⎛=ππ 和积分公式 )2/(12302αα=⎰∞-dx x e x 得平均速率为 m kT v 8π=用摩尔质量表示,有MRT M RT v 60.1 8=π=3.方均根速率(root-mean-square speed )前面我们曾根据理想气体的温度公式求得了气体分子的方均根速率,那么用速率分布函数也可以求得同样的结论。
由平均值的定义可得。
1)定义:速率平方平均值的平方根。
N v N N vN v i i i i i ∑∑∑==2222)计算:对于气体分子⎰⎰⎰===dv v f v Ndvv Nf v N dNv v )()(2222 考虑到 222/322 4)(v e kT m v f kT mv -⎪⎭⎫ ⎝⎛=ππ 和积分公式 2/1540)(832απα=⎰∞-dx x e x得平均速率为mkT v 32=用摩尔质量表示,有MRT M RT v 73.1 32==4.关于三种速率的讨论1)三种速率都与温度的平方根成正比,与质量的平方根或摩尔质量的平方根成反比温度高,v p 大摩尔质量大,v p 小2)三种速率的大小顺序为2v v v p <<,且 73.160.141.12::=::v v v p 3)三种速率各有不同的含义,也各有不同的意义讨论速率分布时——用最概然速率讨论分子碰撞时——用平均速率讨论分子平均平动动能时——用方均根速率例4.试求氮气分子的平均平动动能、方均根速率和平均速率。
设(1)在温度时C t 01000=,(2)在温度时C t 00=。
解:(1)在温度时C t 01000=,由平均平动动能和方均根速率的公式得 J J kT 20231063.212731038.12323--⨯=⨯⨯⨯==ε s m s m M RT v 3321006.11028127331.833⨯=⨯⨯⨯==- s m s m M RT M RT v 231083.91028127331.860.160.1 8⨯=⨯⨯==-=π(2)同理,在温度时C t 00=J J kT 21231065.52731038.12323--⨯=⨯⨯⨯==εs m s m M RT v 493102827331.83332=⨯⨯⨯==- s m s m M RT M RT v 455102827331.860.160.1 83=⨯⨯==-=π 例5.试计算气体分子热运动速率的大小介于100p p v v -和100p p v v +之间的分子数占总分子数的百分数。
解:按题意,50)100()100(,10099100p p p p p p p p v v v v v v v v v v =--+=∆=-=。
在此,利用p v ,引入pv v W =,把麦克斯韦速率分布律改写成如下简单形式: W e W W W f N N w ∆=∆=∆-224)(π(1) 现在, 10099==p v v W ,501=∆=∆p v v W把这些值代入(1)式,即得%66.1501)10099(4422)10099(22=⨯=∆=∆--e W e W N N w ππ。