3.1原子之间的互作用
- 格式:ppt
- 大小:1.33 MB
- 文档页数:2



原子间相互作用势解读原子间相互作用势是描述两个或多个原子之间相互作用力的函数。
它是描述原子、分子或固体材料性质的关键因素,对于理解化学反应、材料力学性能、相变、晶体结构等都起着重要的作用。
本文将对原子间相互作用势进行解读。
一种显著的原子间相互作用势是范德华力(Van der Waals forces),它是由电荷偶极、氢键、格列高利亚力和弥散力等组成。
这些力可以通过公式来描述,例如Lennard-Jones势能公式:V(r)=4ε[(σ/r)^12-(σ/r)^6]这个公式中,r是两个原子间的距离,ε和σ是相互作用的参数。
这个公式表示了势能和原子间距离的关系,当两个原子非常接近时,势能会变得非常大,当原子间距离较大时,势能会变得非常小。
除了范德华力,库仑力也是原子间相互作用势的重要组成部分。
库仑力是由原子间的电荷交互作用引起的,它可以通过库仑电势公式来描述:V(r)=k*q1*q2/r其中r是两个原子间的距离,q1和q2是原子的电荷,k是电常数。
这个公式表示,当两个原子带有相同的电荷时,它们之间会存在排斥力;当两个原子带有相反的电荷时,它们之间会存在吸引力。
除了范德华力和库仑力,还有其他一些原子间相互作用势也非常重要。
例如,金属间相互作用势(Metal-Metal Interaction Potential)用于描述金属之间的相互作用力,分子间相互作用势(Molecule-Molecule Interaction Potential)用于描述分子之间的相互作用力。
通过使用原子间相互作用势,我们可以研究原子间的排列方式和结构稳定性。
例如,在材料科学中,人们可以使用原子间相互作用势预测材料的熔点、弹性模量、黏度等性质。
在化学反应中,通过分析原子间相互作用势,我们可以了解反应的速率和过程。
虽然原子间相互作用势是描述原子间相互作用的重要工具,但是它并不是完美的。
由于原子间相互作用力很复杂,我们通常只能采用近似的方法来描述这些力。





§3 化学键3.1 原子间的相互作用当两个原子相互靠近时,它们之间存在的相互作用力包括原子核与核外电子之间的吸引力,以及原子核、核外电子之间的排斥力。
这种原子之间的相互作用可用图2.2表示,在某一间距r0处,吸引力和排斥力达到平衡,势能最低,原子最稳定。
图2.4 两个原子之间的相互作用力、势能与原子间距的关系由于核外电子,特别是价电子的不同,原子之间的结合方式(化学键)也不同,包括:依靠电子的转移或共享形成的强键(一次键),如金属键,离子键,共价键;借分子之间的偶极吸引力而形成的弱键(二次键),如范德华(V an der waals)键、氢键。
3.2 金属键金属原子形成晶体时,金属中的自由电子为整个晶体所共有,可以在整个晶体中自由运动,失去价电子的金属正离子则在三维空间中作周期性排列,这种键合称为金属键。
金属键的主要特点是无饱和性和方向性,从而导致密堆结构和良好延展性;价电子的自由运动则使金属具有良好的导电和导热性能。
图2.5 金属键示意图3.3 离子键金属原子和非金属原子分别形成正离子和负离子,正、负离子相互吸引结合在一起形成离子晶体,这种键合称为离子键。
由离子键构成的化合物称为离子化合物,如NaCl等。
由于负离子的体积比正离子的体积大,所以离子化合物的晶体结构特点是:负离子在三维空间中作周期性排列,正离子占据负离子所形成的间隙。
离子键的特点是键合作用强、无方向性。
另外,由于很难产生自由运动的电子,离子化合物都是良好的电绝缘体。
但当处在高温熔融状态时,正负离子在外电场作用下可以自由运动,即呈现离子导电性。
图2.6 离子键示意图3.4 共价键两个或多个电负性相差不大的原子间通过共用电子对而形成的化学键即为共价键。
共价键特点是有饱和性和方向性,因此以共价键形成的晶体结构稳定、熔点高、坚硬无塑性,一般是绝缘体。
图2.7 共价键示意图3.5 范德华力在某一瞬间,一个原子(分子)的正负电荷重心可能不重合,从而形成小的偶极子。

原子间相互作用势解读静电相互作用的形式可以用库伦定律来描述,即原子之间的电荷之间的相互作用力与它们之间的距离成反比。
具体来说,原子之间的相互作用势能可以表示为:V_Coulomb = k * (q1 * q2) / r其中,q1和q2是原子之间的电荷,r是它们之间的距离,k是一个常数。
范德华相互作用则更为复杂一些。
它可以用范德华力场模型来描述,其中最常用的是Lennard-Jones势函数。
Lennard-Jones势函数可以表示为:V_LJ=4ε[(σ/r)^12-(σ/r)^6]其中,ε是势能的尺度参数,σ是势能的距离参数,r是原子之间的距离。
Lennard-Jones势函数的形式可以分为两个部分:第一个部分是吸引项,即(σ/r)^12,它表示原子之间的瞬时电偶极引起的吸引力;第二个部分是排斥项,即(σ/r)^6,它表示原子之间的电子云重叠引起的排斥力。
这两个项的平衡决定了原子间的总体相互作用。
在实际应用中,原子间相互作用势通常还会加入其他修正项,以更准确地描述实际系统中的相互作用。
例如,对于离子化合物,静电相互作用势能可以通过考虑离子晶体间的库伦吸引力和斥力来表示。
而对于金属材料,电子间的交换和相关作用也需要被纳入考虑。
通过选择适当的参数,我们可以用原子间相互作用势来模拟和预测原子间的结合、位移和振动等行为。
这对于研究和理解固体材料的性质具有重要的意义。
例如,通过原子间相互作用势,我们可以解释和预测材料的热膨胀系数、热导率、机械性能等。
总而言之,原子间相互作用势是描述原子之间相互作用力的数学函数。
它包括静电相互作用和范德华相互作用,可以通过适当地选择参数来模拟和预测原子间的行为。
在分子动力学模拟和固体材料建模中具有广泛的应用。
高中物理必修一第三章相互作用知识点总结第一篇:高中物理必修一第三章相互作用知识点总结高中物理必修一第三章相互作用复习资料板块一:基本知识点一、重力,基本相互作用1、力和力的图示2、力的作用效果3、力是物体与物体之间的相互作用(1)、施力物体(2)受力物体(3)力的相互性(牛顿第三定律)4、力的三要素:大小,方向,作用点5、重力:由于地球吸引而受的力大小G=mg 方向:竖直向下重心:重力的作用点由物体形状和质量分布共同决定均匀分布均匀、形状规则物体:几何对称中心不一定在物体身上6、四种基本作用(记住)(1)万有引力(2)电磁相互作用(3)强相互作用(4)弱相互作用二、弹力1、性质:接触力2、弹性形变:当外力撤去后物体恢复原来的形状3、弹力产生条件(形变的物体是施力物体)(1)挤压(2)发生弹性形变4、方向:与形变方向相反(①按照接触类型分:3类;②绳、杆、弹簧)5、常见弹力(1)压力垂直于接触面,指向被压物体(2)支持力垂直于接触面,指向被支持物体(3)拉力:沿绳子收缩方向(4)弹簧弹力方向:可短可长沿弹簧方向与形变方向相反6、弹力大小计算(胡克定律)(实验)F=kx k 劲度系数 N/m x 伸长量三、摩擦力产生条件:两个物体接触且粗糙(有弹力)有相对运动或相对运动趋势静摩擦力:相对运动趋势不代表物体一定静止静摩擦力方向:沿着接触面与运动趋势方向相反大小:0≤f≤Fmax 大小的计算方法:平衡或牛顿第二定律滑动摩擦力:有相对滑动不代表物体一定运动大小:f=μN(注意N不一定等于mg)N 相互接触时产生的弹力四、力的合成与分解(力的合成实验)实验方法:等效替代求合力方法:平行四边形定则(合力是以两分力为邻边的平行四边形对角线,对角线长度即合力的大小,方向即合力的方向)合力与分力的关系1、合力可以比分力大,也可以比分力小2、夹角θ一定,θ为锐角,两分力增大,合力就增大3、当两个分力大小一定,夹角增大,合力就增大,夹角增大,合力就减小(0<θ<π)4、合力最大值F=F1+F2 最小值F=|F1-F2|(思考三力合成的合力范围)力的分解:已知合力,求替代F的两个力原则:分力与合力遵循平行四边形定则本质:力的合成的逆运算作分力的基本操作:明确分力的方向——以合力为对角线分力为邻边构建平行四边形计算法求合力、分力的实质:解三角形(三角函数的运算)五、受力分析步骤和方法 1.步骤(1)研究对象:受力物体(2)隔离开受力物体(3)顺序:①场力(重力,电磁力......)②弹力:(绳子拉力沿绳子方向;轻弹簧压缩或伸长与形变方向相反;轻杆可能沿杆,也可能不沿杆;垂直于接触面)③摩擦力静摩擦力方向1.求 2.假设滑动摩擦力方向与相对滑动方向相反④其它力(题中已知力)(4)检验是否有施力物体六、摩擦力分析根据运动状态分析:根据平衡或牛顿第二定律分析七、重难点模型1、三力平衡模型2、斜拉模型3、斜面模型(见右图)斜面倾角θ动摩擦因系数μ=tanθ 物体在斜面上匀速下滑μ>tanθ 物体保持静止μ<tanθ 物体在斜面上加速下滑板块二:必须会做的题类型一:概念辨析1.如图,重力大小为G的木块静止在水平地面上,对它施加一竖直向上且逐渐增大的力F,若F总小于G,下列说法中正确的是A.木块对地面的压力随F增大而减小B.木块对地面的压力就是木块的重力C.地面对木块的支持力的大小等于木块的重力大小D.地面对木块的支持力的大小等于木块对地面的压力大小2.关于弹力的说法,错误的是:A.物质互相接触,就有弹力的相互作用。
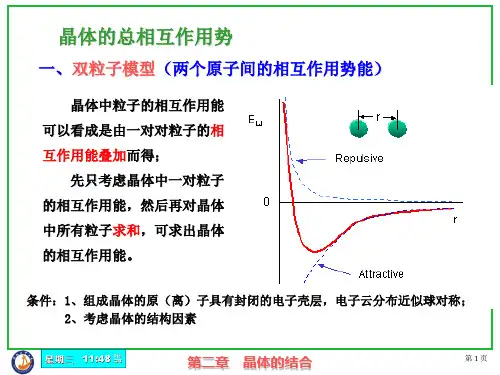
3.3几种典型晶体的结合分散的原子相互结合成晶体的根本原因在于这些原子结合起来后整个系统具有更低的能量。
在结合过程中,有一定的能量W 释放出来,称为晶体的结合能。
如果以分散的原子作为计量相互作用势能的零点,则 -W 就是结合成晶体后系统的相互作用势能。
各种不同的晶体,其结合力的类型和大小是不同的。
但是在任何晶体中,两个原子之间的相互作用力或相互作用势与它们之间距离的关系在定性上是相同的。
晶体中原子的相互作用可以分为两大类,即吸引作用和排斥作用。
吸引作用是异性电荷之间的库仑引力,排斥作用是由于同性电荷之间的库仑斥力和泡利原理引起的排斥。
在某一适当的距离,两种力平衡,晶格处于稳定状态。
两个原子的相互作用势能通常可以用幂函数描述:()n m rBr A r u +-= (3.3.1)此处r 为两个原子之间的距离,A, B, m, n 皆为大于零的常数,第一项表示吸引能,第二项表示排斥能。
由势能u (r )可以计算相互作用力:()()drr du r f -= (3.3.2)图3.3.1 两个原子之间的相互作用力或相互作用势与它们之间距离的关系相互作用力为零时晶格最稳定,由此可以决定原子之间的平衡距离r 0:()00=⎪⎭⎫⎝⎛r dr r du (3.3.3)内能是晶体体积的函数,设开始原子相距很远,逐渐被压缩相互靠近,体积逐渐缩小,系统的相互作用势能U 逐渐下降,体积缩小到一定程度时,相互作用势能达到极小值。
这时如果再压缩系统,排斥的作用转变为主要的,相互作用势能将上升。
根据功能原理,系统温度不变时外界作功p (-dV )等于相互作用势能的增加dU :dVdUp -= (3.3.4)在一般情况下,晶体受到的仅是大气压力p 0,由于数量级为大气压的压力对一般固体体积的影响很小,因此可以近似看作零。
由上式得:00≈=-p dVdU(3.3.5) 这个关系确定了平衡晶体的体积。
体积弹性模量的定义为:0V dV dp V B ⎪⎭⎫⎝⎛-= (3.3.6)其中p 为压力,V dV /-为相对体积变化。
两原子之间的相互作用叫做化学
化学是一门研究物质的组成、性质、结构、变化以及与能量的关系的科学学科。
化学中的一个重要概念是两个原子之间的相互作用,这种相互作用被称为化学键。
化学键是指原子之间的相互作用力,它们使得原子能够结合在一起形成分子或晶体。
化学键的形成涉及到原子中的电子,因为电子是决定原子化学性质的关键因素。
在化学中,常见的化学键包括共价键、离子键和金属键。
共价键是指两个原子通过共享电子对而相互结合。
这种键形成于非金属原子之间,如氧气中的氧分子(O2)。
离子键是指由正负电荷吸引而形成的键,其中一个原子失去电子而变成正离子,另一个原子获得电子而变成负离子。
金属键是指金属原子之间的一种特殊的键,其中金属原子通过电子云的共享而结合在一起。
化学键的强度取决于原子之间的相互作用力,这种相互作用力受到多种因素的影响,包括原子间的距离、电子的分布、原子核的电荷等。
不同类型的化学键在强度上有所不同,共价键通常比离子键强,而金属键通常是最强的。
化学键的形成和断裂是化学反应的基础。
通过改变原子之间的化学键,物质可以发生化学变化,形成新的物质。
化学反应可以是放热的(释放能量)或吸热的(吸收能量),这取决于化学键的形成和断裂过程中的能量变化。
总结来说,化学是研究物质组成、性质和变化的科学学科,其中两个原子之间的相互作用被称为化学键。
化学键的形成和断裂是化学反应的基础,通过改变化学键可以引起物质的化学变化。
不同类型的化学键具有不同的强度和特点,它们在物质的性质和行为中起着重要的作用。
原子交换作用范文原子交换作用是一种重要的化学现象,它是指原子之间的电子交换,从而形成化学键。
原子交换作用对于物质的性质和反应起着重要的作用,对于理解化学反应机制和预测化学反应的速率和平衡也具有重要意义。
本文将从以下几个方面进行详细介绍。
1.原子交换作用的基本概念原子交换作用是指原子间电子的交换。
原子由原子核和绕核运动的电子组成,电子以电荷为基础,其负电荷趋向于正电荷,从而使原子保持稳定。
然而,当两个或多个原子靠近时,它们的电子云可能会重叠,从而产生电子的交换。
电子交换可能导致原子中电子的重新排列,从而形成新的化学键。
2.原子交换作用的类型离子交换是指电子从一个原子转移到另一个原子,从而形成正离子和负离子。
这种交换通常发生在具有不同电子亲和力或电离能的元素之间。
例如,钠原子可以失去一个电子并转变为正离子,氯原子可以接受这个电子并转变为负离子,从而形成氯化钠。
共价交换是指电子在两个原子之间共享,从而形成共价键。
这种交换通常发生在具有相似电子亲和力和电离能的元素之间。
例如,氢原子和氧原子共享电子,形成水分子,其中氢原子通过与氧原子共享一个电子对来稳定。
除了离子交换和共价交换,还存在一种特殊的交换作用,即金属键。
金属键是指金属原子之间的电子交换,形成金属晶格。
金属中的电子能够自由移动,形成电子云,从而使金属具有良好的电导性和热导性。
3.原子交换作用的影响首先,原子交换作用决定了物质的化学反应性质。
不同原子之间的交换方式不同,反应产物也会有所不同。
例如,钠和氯的离子交换会产生氯化钠,而氢和氧的共价交换会产生水。
原子交换作用还可解释为什么一些元素在化学反应中更具活性,而其他元素在化学反应中较不活跃。
其次,原子交换作用决定了物质的抗腐蚀性能。
具有高电子亲和力的金属原子容易进行电子交换,并形成具有抗腐蚀性的化合物。
例如,镀铬的钢材具有良好的抗腐蚀性能,是制造不锈钢的重要原料。
此外,原子交换作用还可以影响材料的导电性、热导性和光学性能等。
原子核的静电势能1.引言1.1 概述概述部分的内容如下:引言是一篇文章的开端,旨在介绍文章的主题,概括性地解释文章的目的和结构,为读者提供一个对文章内容有基本了解的框架。
本文的主题是原子核的静电势能,通过探讨原子核静电势能的定义、原理以及影响因素,我们可以进一步理解原子核的性质和行为。
在本文的正文部分,我们将详细介绍原子核的静电势能的定义和原理,涵盖相关的基本概念和理论框架。
同时,我们还将探讨影响原子核静电势能的种种因素,包括核电荷、核半径和核壳效应等等。
在结论部分,我们将强调原子核静电势能的重要性,并探讨其可能的应用和未来进一步研究的方向。
通过本文的研究,我们可以深入了解并探讨原子核静电势能在核物理学中的重要作用。
掌握原子核的静电势能的概念和原理对于理解原子核的结构和稳定性具有重要意义。
此外,了解影响原子核静电势能的因素,能够帮助我们解释和预测核反应、放射性衰变等核现象。
原子核的静电势能也有可能在核能利用、医学及工业领域中找到实际应用。
为了更加深入地探索和利用原子核的静电势能,我们还需要进一步开展研究,以发现更多关于原子核性质和行为的有趣现象,并探索其在实际应用中的潜力。
通过本文的研究,我们旨在增进对原子核静电势能的理解,并为未来的研究和应用提供一定的参考。
通过对原子核的静电势能的探索,我们可以更加全面地认识原子核的性质和行为,为核物理学领域的发展做出贡献。
1.2文章结构1.2 文章结构本文将按以下结构进行叙述:第一部分为引言部分,对原子核的静电势能进行概述,并介绍文章的目的。
第二部分为正文部分,将首先对原子核的静电势能的定义和原理进行介绍,包括静电势能的起因和计算公式等内容。
其次,将探讨影响原子核静电势能的因素,如原子核的电荷分布、电子云的影响等。
通过对这些因素的分析,可以更好地理解和解释原子核的静电势能的形成机制。
第三部分为结论部分,将阐述原子核的静电势能的重要性,包括其在核物理学和相关领域中的应用以及对原子核结构和性质的影响。