第三单元 3.1原子间的相互作用
- 格式:doc
- 大小:28.00 KB
- 文档页数:3

1《原子间的相互作用》教学设计【课题名称】原子间的相互作用【年级】高一【教材相关内容】化学高中一年级第一学期(试用本)第57页到59页一、教材和学情分析《原子间的相互作用》是第三章“探索原子构建物质的奥秘”第一节。
教材特点是:内容少,只有“化学键”一个概念;较抽象,主要是微观探析,理解概念内涵;具有承上启下的作用,上接原子结构,下连物质结构,《原子间的相互作用》为化学键学习奠定基础,可以当作绪论课。
学生知道原子、分子、离子是构成物质的微粒;学过原子结构和离子,具有原子趋向稳定结构的知识基础。
但是毕竟学生知道的物质结构少,而且抽象思维能力还较薄弱,需要以原有基础为生长点,通过教师引导,思考探究,以自然渐进的方式理解化学键概念和化学键形成过程,达到学习目的。
二、教学目标1、理解化学键的概念,知道化学键是通过物质中相邻原子间吸引、排斥而达到平衡的强烈相互作用,初步体验“平衡”的辩证内涵。
2、知道化学键有离子键、共价键和金属键。
3、通过讨论,理解原子结构差异是原子间形成不同类型化学键的根本原因。
4、了解某些物质宏观性质和微观结构的联系,体验“结构决定性质”的观念。
5、通过教学,培养学生的抽象思维能力。
三、教学重点和难点重点:化学键概念的形成难点:化学键概念的内涵、理解原子结构差异导致化学键的多样性2四、教学思路首先,通过比较同素异形体金刚石、石墨硬度的差异,让学生感受到物质结构对性质的影响,激发学习兴趣。
然后,组织学生阅读课文,初步了解学习内容。
接着,引导学生用已有知识来解释概念,加深理解。
再通过对一些具体物质结构的探究分析,让学生认识原子结构的差异是原子间形成不同类型化学键的根本动因。
最终理解化学键的形成过程,理解结构决定性质。
五、教学过程【引入】展示金刚石、石墨图片,哪种物质更硬?为什么同种元素组成的单质,性质却不相同?为什么已知元素不过百余种,而物质种类却数不胜数,性质各异?想要解决这些问题,就必须了解原子是如何构成物质的。

3.1 原子间的相互作用一、教学目标 1.学问与技能(1)理解一些常见晶体材料;(2)理解化学键的概念和化学键的种类。
2.过程与方法(1)通过学习物质硬度差异的应用,关注生活、生产所用材料、及其与原子间相互作用和化学键的关系。
(2)通过对有关材料的调查、争辩、试验,感受实践创新活动的方法。
3.情感态度与价值观(1)了解材料科学给人类带来的意义。
(2)通过争辩原子间吸引与排斥的相互作用,体验辨证唯物主义的冲突对立同意的观点。
(3)通过对材料的优劣分析,感受事物的双韧性及环境爱护思想。
二.教学重点和难点 1.教学重点化学键的概念和种类。
2.教学难点原子间的相互作用,化学键的涵义。
三.教学用品几种硬度不同的物质,利用Flash 软件模拟原子间相互作用过程。
四.教学流程 1.设计思想提出问题:“一百多种元素的原子是怎样构成几千万种物质的呢?”;然后呈现:很多元素组成类似的物质,而性质却有很大差异,因此原子构成物质的方式不同,使物质呈现不同的性质;告知同学从本节课起将对原子构建物质的奇特作初步的探究,接着引出课题,逐一探究。
2.流程图3.流程图说明[创设情景,引出课题] 呈现几种硬度不同的样品。
设问:“一百多种元素的原子是怎样构成几千万种物质的呢?”[探究活动1]证明这几种样品硬度的大小。
[同学争辩1]为什么各种物质会具有不同的硬度?而同是碳元素组成的金刚石和石墨,其硬度差异又会这样大?(呈现金刚石和石墨结构模型,从物质的组成和结构来说明物质硬度大小的缘由)。
[归纳1]物质的硬度等某些性质不仅与组成物质的元素有关,还与原子间的相互作用的方式和作用的强弱有关。
[同学争辩2]原子是如何结合成分子的呢?分子中的原子间又存在怎样的作用呢? [动画]原子间的相互作用(两个氢原子结合成一个氢分子)。
[归纳2]化学键的概念和化学键的分类[小结]物质的结构打算其性质,而性质又能体现其结构;化学键的涵义和分类五.教学案例1.主题引入呈现几种硬度不同的样品,并让同学探究其相对硬度。


§3 化学键3.1 原子间的相互作用当两个原子相互靠近时,它们之间存在的相互作用力包括原子核与核外电子之间的吸引力,以及原子核、核外电子之间的排斥力。
这种原子之间的相互作用可用图2.2表示,在某一间距r0处,吸引力和排斥力达到平衡,势能最低,原子最稳定。
图2.4 两个原子之间的相互作用力、势能与原子间距的关系由于核外电子,特别是价电子的不同,原子之间的结合方式(化学键)也不同,包括:依靠电子的转移或共享形成的强键(一次键),如金属键,离子键,共价键;借分子之间的偶极吸引力而形成的弱键(二次键),如范德华(V an der waals)键、氢键。
3.2 金属键金属原子形成晶体时,金属中的自由电子为整个晶体所共有,可以在整个晶体中自由运动,失去价电子的金属正离子则在三维空间中作周期性排列,这种键合称为金属键。
金属键的主要特点是无饱和性和方向性,从而导致密堆结构和良好延展性;价电子的自由运动则使金属具有良好的导电和导热性能。
图2.5 金属键示意图3.3 离子键金属原子和非金属原子分别形成正离子和负离子,正、负离子相互吸引结合在一起形成离子晶体,这种键合称为离子键。
由离子键构成的化合物称为离子化合物,如NaCl等。
由于负离子的体积比正离子的体积大,所以离子化合物的晶体结构特点是:负离子在三维空间中作周期性排列,正离子占据负离子所形成的间隙。
离子键的特点是键合作用强、无方向性。
另外,由于很难产生自由运动的电子,离子化合物都是良好的电绝缘体。
但当处在高温熔融状态时,正负离子在外电场作用下可以自由运动,即呈现离子导电性。
图2.6 离子键示意图3.4 共价键两个或多个电负性相差不大的原子间通过共用电子对而形成的化学键即为共价键。
共价键特点是有饱和性和方向性,因此以共价键形成的晶体结构稳定、熔点高、坚硬无塑性,一般是绝缘体。
图2.7 共价键示意图3.5 范德华力在某一瞬间,一个原子(分子)的正负电荷重心可能不重合,从而形成小的偶极子。



课题:探索原子构建物质的奥秘—化学键、离子键教学目标知识与技能:1、理解化学键的概念,知道化学键是物质(分子或晶体)中相邻原子(离子)间的强烈的相互作用。
这种相互作用既有吸引又有排斥作用,是两种作用的平衡。
2、知道化学键有离子键、共价键和金属键3、理解离子键的概念,认识离子键是阴、阳离子间的静电作用及其形成条件。
5、学会用电子式表示简单的离子化合物。
过程和方法:1、感受从原子间相互作用来探索分子或固体(晶体)中原子相互结合的过程。
2、感受离子键形成过程中微观粒子的变化,感受化学反应与微观粒子变化的关系。
情感和价值观:1、通过原子间吸引、排斥而达到平衡的相互作用,初步体验“平衡”的辩证内涵。
重点:化学键、离子键、离子键的概念难点:化学键概念主要内涵的理解,离子化合物电子式的书写教学过程:课前:学生观看3分钟的视屏,关于CNT (碳纳米管)材料做成的触摸屏的性能对比测试,让学生在不知道什么材料做成的触摸屏的前提下,给他们一个悬念,为下面的课堂教学埋下一个伏笔。
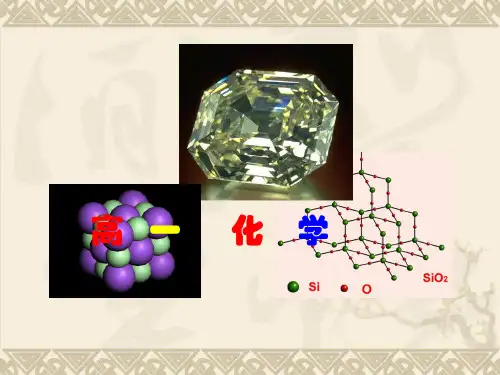
引入:课题ppt 投影探索原子构建物质的奥秘教师:先请同学们看几张图片(ppt),猜猜各是什么?Ppt 显示石墨、金刚石、足球烯的图片。
这三种物质是由什么元素组成的?学生:碳元素教师:它们都是由碳元素组成的。
它们是属于单质还是化合物?又互称为? 学生:单质、同素异形体教师:同学们能不能再举些由相同元素组成的不同物质,单质化合物都可以。
师生互动:教师提示,学生讲,教师黑板罗列。
H 、Cl 、O 形成的HClO 、HClO 2、HClO 3、HClO 4及对应钠盐。
H 、O 形成的H 2O 、H 2O 2Na 、O 形成的Na 2O 、Na 2O 2N、H 、C 、O 形成的NH 4HCO 3、(NH 4)2CO 3、(NH 2)2CO 、NH 2CH 2COOH教师:同学们说了那么多学过的物质,从碳的同素异形体到这么多化合物,我们发现相同元素通过不同的原子个数比,不同的排列组合,可以组成许多种的物质。

3.1 原子间的相互作用【学习目标】1. 了解元素的原子可能通过不同的途径、不同的方式构建成性能各异的物质。
2. 知道物质的组成,结构决定了性质。
3. 了解化学键的概念和化学键的种类。
【学习内容】Ⅰ相关知识回顾1. 原子结构。
原子是由原子核和核外电子两大部分组成。
原子核带正电荷,核外电子带负电荷。
2. 日常生活知识。
不同首饰的硬度,不同工具、不同物质的硬度等。
3. 化学式。
氯化钠中氯和钠的个数比为1:1.氯气分子是由两个氯原子构成的,水分子是由两个氢原子和一个氧原子构成的。
4. 同素异形体。
由同一种元素形成的结构不同的单质互称为同素异形体。
例如:金刚石和石墨都是由碳元素形成的单质,但它们的结构不同,它们之间互称为同素异形体。
臭氧和和氧气都是由氧元素组成的单质,但是氧气是双原子分子,臭氧是三原子分子,它们的结构不同,它们之间也互称为同素异形体。
由于同素异形体的结构不同,它们之间的转化属于化学变化。
同素异形体应具有不同的物理性质。
Ⅱ新知识点讲解一、物质思考:构成物质世界的元素只有100多种,但这些元素的原子构成的物质却高达3000多万种,为什么?由于原子间的结合方式多种多样,即使相同的一些原子,可以通过不同的结合方式,都成多种物质。
想一想:根据你的了解,仅由碳元素组成的物质有哪些?我们在初中化学中已经学过,金刚石和石墨是同素异形体,它们都是只有碳元素组成的,但它们的性质不完全相同,是两种不同的物质。
这是由于碳元素的原子间结合的方式不同,组成了性质不同的物质。
只有碳元素组成的物质除金刚石和石墨外,还有许多物质,如C32、C50、C60、C70、C78、C84、C90、C94、C540等足球烯系列的单质。
试列举一些例子,说明原子间结合成物质的方式不一定相同?二氧化碳在常温下是气体,而组成与二氧化碳相近的二氧化硅却是坚硬的固体,说明二氧化碳和二氧化硅的结合方式是不同的。
还有哪些因素导致物质众多?相同的元素组成的化合物也可能很多。
化学反应的原子间相互作用化学反应是指一种或多种物质在一定条件下,发生化学变化并产生新的物质的过程。
在化学反应中,原子间相互作用起着关键的作用。
原子间相互作用可以分为三类:共价键、离子键和金属键。
本文将围绕这三类相互作用展开讨论。
一、共价键共价键是指两个或多个原子通过共享电子而形成的化学键。
共价键的形成要求参与反应的原子具有较高的电负性,并且能够共享电子。
1. 共价键的形成原理当原子间距离适当且两个原子的价电子轨道重叠时,能量最低的结果是电子被共享,从而形成共价键。
共享电子能够稳定原子,并使得共价键两侧的原子趋于稳定状态。
2. 共价键的特点共价键的特点是共享电子对的形成。
共享电子对通常形成于相互重叠的价电子轨道上,可以是单一共价键、双键或三键。
共价键通常是非极性的,但在某些情况下,由于元素的电负性差异,共价键可能具有极性。
二、离子键离子键是指由两个带电离子之间的电荷吸引力而形成的化学键。
在离子键中,正带电离子与负带电离子之间相互吸引并结合。
1. 离子键的形成原理离子键的形成需要具有较低电负性的金属原子(阳离子)和较高电负性的非金属原子(阴离子)参与反应。
通过电子的转移,金属原子失去外层电子形成阳离子,非金属原子接受这些电子形成阴离子。
阳离子和阴离子之间的静电吸引力导致离子键的形成。
2. 离子键的特点离子键的特点是电荷吸引力的作用。
离子键一般是在金属和非金属之间形成,形成的化合物具有高熔点和离子晶格结构。
三、金属键金属键是指金属之间的电子“海”共享而形成的化学键。
金属键是金属特有的相互作用方式。
1. 金属键的形成原理金属原子的价层电子活动性较高,没有规则的排布,形成一个电子“海”。
当金属原子靠近时,它们的价电子会从一个原子跃迁到另一个原子,形成共享电子“海”,从而形成金属键。
2. 金属键的特点金属键的特点是共享电子的形成方式。
金属键能够在金属中形成金属结构,使其具有良好的导电性和热导性,并且通常具有高硬度和延展性。
原子之间的相互作用嘿,朋友们!今天咱来聊聊原子之间那奇妙的相互作用呀!你想想看,这世界上的一切物质,都是由小小的原子组成的呢。
原子就像是一群小精灵,它们在自己的小天地里玩耍、互动。
原子之间的相互作用,就好像是一场精彩的舞蹈。
它们有的相互吸引,紧紧拥抱在一起,不离不弃;有的呢,又会相互排斥,就像是两个倔强的小孩在闹别扭。
这多有意思呀!比如说,金属里的原子,它们之间的相互作用就很特别。
就好像是一群好兄弟,手挽手、肩并肩,形成了坚固的结构,让金属有了各种各样的特性。
而在化合物里,不同的原子结合在一起,就像是找到了最佳搭档,一起创造出全新的东西。
这不就跟咱交朋友似的吗?有些人跟咱特别合得来,一见面就感觉亲切,这就是相互吸引呀;而有些人呢,可能就是气场不合,见面就觉得不太对劲儿,这就是相互排斥嘛。
再看看我们身边的各种物质,从柔软的棉花到坚硬的石头,从透明的水到五彩斑斓的颜料,不都是原子相互作用的结果吗?这简直太神奇了!你说,如果原子之间不这样相互作用,那这个世界会变成什么样呢?没有了金属的坚固,没有了化合物的多样,那得多无趣呀!而且哦,原子之间的这种相互作用还不是一成不变的呢。
就像我们的心情会变一样,原子之间的关系也会随着条件的改变而变化。
温度啦、压力啦,这些都能影响它们的互动。
你想想,要是温度一高,原子们会不会也变得更活跃,相互之间的舞蹈跳得更热烈呢?那要是压力变大了,它们是不是就得紧紧靠在一起,更加团结了呢?哎呀呀,这原子的世界真是充满了奥秘呀!我们虽然看不见它们在那蹦蹦跳跳,但它们却实实在在地影响着我们生活的方方面面。
所以说呀,可别小瞧了这些小小的原子和它们之间的相互作用。
它们就像是一群默默工作的小工匠,打造出了我们这个丰富多彩的世界。
我们应该对它们充满好奇和敬畏呢!这不就是大自然的神奇之处吗?让这些小小的原子创造出如此多的奇迹!。
第三章 第一节 原子间的相互作用教案上南中学 康志华上课地点:杨思中学 上课教室:207教室上课班级:高一(1) 上课时间:2008、11、11下午第二节 教学目标:知识与技能: 1、理解化学键的概念,明了化学键是物质(分子或晶体)中相邻原子间的强烈的相互作用。
2、知道化学键有离子键、共价键和金属键。
过程与方法:感受从原子间相互作用来探索分子中原子相互结合的科学过程。
情感态度与价值观:1、体验物质性质与物质内部结构的某种联系。
2、培养学生爱科学的情怀。
教学重点和难点:重点:化学键概念的形成。
难点:化学键概念主要内涵(“相邻原子间”、“强烈相互作用”)的理解。
教学手段:多媒体、动画演示。
教学模式:启发——掌握。
教学环节教学过程:教师提供素材:化学——人类进步的关键Flash 动画。
问题情景:近几十年来,随着科学技术的发展和化学的突飞猛进,人类新发现和合成的物质正以每年几十万、上百万种的数量急剧增加。
PPT 展示几种物质。
现在人们已经认识了3000多万种物质,这是社会的需要,更是人类物质文明生活的需要。
问题情景:构成物质世界的元素只有100多种,那么这100多种元素的原子是怎么构成3000多万种物质的呢?教师提供素材:H 2、O 2、Cl 2、HCl 、H 2O 、CO 2、NO 3、CCl 4等比例模型(PPT 展示)化学为人类创造了无数的新材料(PPT 展示)问题情景:原子是如何结合成分子,原子、分子又是如何直接构成物质的呢? 教师提供素材:H 2+Cl 2点燃、见光爆炸录象展示学生探究:原子间的吸引、排斥作用1、H 2+Cl 2点燃、见光为什么会燃烧、爆炸?2、教师引导:6位学生上台做小游戏。
3、学生讨论得出结论。
P63图3.2 原子间的吸引、排斥作用:两个原子(或离子,下同)接近到一定距离时,产生一个原子原子核的正电荷与另一个原子核外电子的负电荷的吸引作用,同时产生原子核与原子核、电子与电子同种电性的排斥作用。
3.1 原子间的相互作用
【学习目标】
1. 了解元素的原子可能通过不同的途径、不同的方式构建成性能各异的物质。
2. 知道物质的组成,结构决定了性质。
3. 了解化学键的概念和化学键的种类。
【学习内容】
Ⅰ相关知识回顾
1. 原子结构。
原子是由原子核和核外电子两大部分组成。
原子核带正电荷,核外电子带负电荷。
2. 日常生活知识。
不同首饰的硬度,不同工具、不同物质的硬度等。
3. 化学式。
氯化钠中氯和钠的个数比为1:1.氯气分子是由两个氯原子构成的,水分子是由两个氢原子和一个氧原子构成的。
4. 同素异形体。
由同一种元素形成的结构不同的单质互称为同素异形体。
例如:金刚石和石墨都是由碳元素形成的单质,但它们的结构不同,它们之间互称为同素异形体。
臭氧和和氧气都是由氧元素组成的单质,但是氧气是双原子分子,臭氧是三原子分子,它们的结构不同,它们之间也互称为同素异形体。
由于同素异形体的结构不同,它们之间的转化属于化学变化。
同素异形体应具有不同的物理性质。
Ⅱ新知识点讲解
一、物质
思考:构成物质世界的元素只有100多种,但这些元素的原子构成的物质却高达3000多万种,为什么?
由于原子间的结合方式多种多样,即使相同的一些原子,可以通过不同的结合方式,都成多种物质。
想一想:根据你的了解,仅由碳元素组成的物质有哪些?
我们在初中化学中已经学过,金刚石和石墨是同素异形体,它们都是只有碳元素组成的,但它们的性质不完全相同,是两种不同的物质。
这是由于碳元素的原子间结合的方式不同,组成了性质不同的物质。
只有碳元素组成的物质除金刚石和石墨外,还有许多物质,如C32、C50、C60、C70、C78、C84、C90、C94、C540等足球烯系列的单质。
试列举一些例子,说明原子间结合成物质的方式不一定相同?
二氧化碳在常温下是气体,而组成与二氧化碳相近的二氧化硅却是坚硬的固体,说明二氧化碳和二氧化硅的结合方式是不同的。
还有哪些因素导致物质众多?
相同的元素组成的化合物也可能很多。
如碳和氢元素组成了如CH4、C2H6、C2H4、C2H2等许多物质。
结论:各种元素的原子可能通过不同的途径,不同的方式构建成性能各异的物质。
二、化学键
探究:原子间可能存在哪些作用?
提示:当两个原子距离较远时,可能存在哪些作用?
当两个原子距离较近时,可能存在哪些作用?
解析:当两个原子间距离较远时,由于一个原子的原子核和另一个原子的核外电子是带异种电荷的,故主要体现为相互吸引;当两个原子间距离较近时,由于两个原子的原子核或两个原子的核外电子带同种电荷,故主要表现为相互排斥。
结论:当两个原子的距离保持一定时,相互吸引与相互排斥的作用处于平衡,形成稳定的物质。
查阅资料,物质内部使各原子结合成一个稳定的整体的一系列的相互作用称什么?
结论:这种作用称为化学键。
化学键的概念:分子或晶体中直接相邻的原子间的强烈的相互作用。
想一想:分子或晶体中不直接相邻的原子间有没有相互作用?
解析:要回答这个问题,我们不妨举一个例子。
水是由许许多多的水分子组成的。
一个水分子中两个氢原子与一个氧原子之间存在着强烈的相互作用,这种相互作用称为化学键。
但一个水分子中的两个氢原子之间、两个水分子之间的原子间也都存在着一定的作用,不过,这种作用很微弱,不能称为化学键。
故分子或晶体中不直接相邻的原子间也有相互作用。
查阅资料,化学键主要分哪些类型?
中学中涉及到的化学键有三种基本类型:离子键、共价键和金属键。
规律方法总结
为什么各种物质具有不同的硬度?
物质的硬度与组成物质的元素有关,也与这些元素原子间的相互作用的方式和作用强弱有关。
同是碳元素组成的金刚石和石墨,硬度差异竟会这么大?金刚石和石墨硬度不同就是碳原子排列方式和作用强弱不同引起的。
课堂例题讲解
例1 用A.质子数B.中子数C.核外电子数D.最外层电子数E.电子层数。
填写下列各空格。
(1)原子种类由_____________决定。
(2)元素种类由_____________决定。
(3)元素有同位素由_____________决定。
(4)相对原子质量由_____________决定。
(5)元素的原子半径由_____________决定。
(6)元素的化合价主要由_____________决定。
(7)元素的化学性质主要由_____________决定
(8)核电荷数由_____________决定。
例2 由同一种元素组成的不同物质,它们的硬度是否相同,必须在理解的基础上牢记。
例3 不同物质产生硬度的差异的可能原因有哪些?
课堂练习
1. 下列各项中与物质硬度无关的是()
A.物质的颜色
B.构成物质的原子间的作用方式
C.物质的组成元素
D.构成物质的原子间相互作用的强弱
2. 某元素的相对原子质量为59,在某氧化物中该元素的质量分数为71%。
则它在该氧化物中的化合价是()
A. +1
B. +2
C. +3
D.+4
3.设X、Y、Z分别代表三种元素。
已知:① X+和Y-两种离子具有相同的电子层结构;
② Z元素原子核内质子数比Y元素原子核内质子数少9;③ Y和Z两种元素可以形成四核42个电子的负一价阴离子。
据此,请填空:
(1) Y元素是________,Z元素是_______。
(2) 由XYZ三种元素所形成的含68个电子的盐类化合物的化学式是_______。
4. 最近,科学家研制得到一种新的分子,它具有空心的类似足球状结构,分子式是C60。
下列关于这种物质的说法正确的是()
A. C60是一种新型的化合物
B. C60和石墨都是碳的同素异形体
C. C60的硬度比金刚石硬
D.C60的摩尔质量为720。