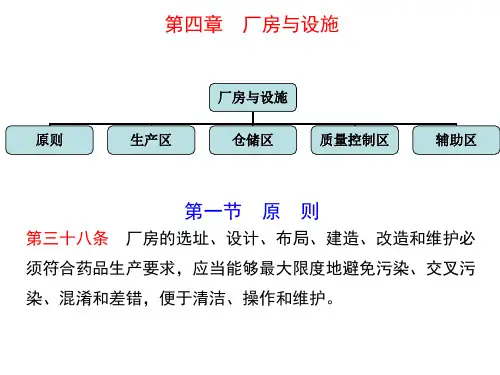
第四章厂房与设施
- 格式:ppt
- 大小:1.81 MB
- 文档页数:53


新版GMP各章节重点问题解读-—第四章:厂房与设施(上)硬件是否符合GMP,直接影响药品质量.硬件的优劣在一定程度上取决于设计质量和施工质量。
厂房和设施是制药企业实施GMP的基础,是一个先决条件,是硬件中的关键部分。
硬件包括厂区建筑物实体及附属配套的公用设施(如空调净化系统、制药用水、电、气系统等)。
本章就厂房与设施必须遵从“防止污染和交叉污染、防止差错和混淆”的GMP原则,以及对生产区、仓储区、质量控制区、辅助区等具体要求进行了阐述。
GMP中“厂房与设施”的“防止污染”即通过合理的厂房与设施来防止在生产、取样、包装和贮存等操作过程中,物料、中间产品和成品受到化学或微生物特性的杂质或异物的不利影响。
“厂房与设施”的“防止交叉污染”即通过合理的厂房与设施来防止通过人流、工器具传送、物料传递、空气流动等途径,造成不同品种物料或药品成分互相干扰、污染,或是因人、工器具、物料、空气等不恰当的流向,让洁净级别低的生产区域的污染物传入洁净级别高的生产区域而造成污染。
计划于2015年3月1日实施的EU(欧盟)GMP修订版本第三章“厂房与设备"在3.6节中增加了防止交叉污染的措施应与其风险级别相适应的内容,同时规定了当药品存在特定风险时,需要使用专用设施的要求。
“防止混淆和差错"就厂房设施而言,主要是提供足够的空间及完善的设施确保物料和产品不会相互混杂,避免操作出现差错的可能。
原则新版GMP细化了对“厂房与设施"总的原则要求(见新版GMP第三十八条),提出了药厂选址要“根据厂房及生产防护措施综合考虑”,厂房所处的环境应能够“最大限度地降低物料或产品遭受污染的风险” (见新版GMP第三十九条)。
强调了总体布局的合理性,即“不应对药品生产造成污染,人流物流互不干扰” (见新版GMP第四十条).在“确保不影响药品的质量”前提下,还应对厂房要按企业制定的GMP文件要求进行清洁或必要的消毒(见新版GMP第四十一条).为确保生产和贮存的产品质量以及相关设备性能不会受到影响,厂房须配置必要的“照明、温度、湿度和通风"等设施(见新版GMP第四十二条)和“防止昆虫或其它动物进入”措施(见新版GMP第四十三条),避免杀虫剂等用品对设备、物料、产品造成污染。



药品生产质量管理规范《药品生产质量管理规范》(Good Manufacture Practice,GMP)是药品生产和质量管理的基本准则,适用于药品制剂生产的全过程和原料药生产中影响成品质量的关键工序。
大力推行药品GMP,是为了最大限度地避免药品生产过程中的污染和交叉污染,降低各种差错的发生,是提高药品质量的重要措施。
世界卫生组织,60年代中开始组织制订药品GMP,中国则从80年代开始推行。
1988年颁布了中国的药品GMP,并于1992年作了第一次修订。
十几年来,中国推行药品GMP取得了一定的成绩,一批制药企业(车间)相继通过了药品GMP认证和达标,促进了医药行业生产和质量水平的提高。
但从总体看,推行药品GMP的力度还不够,药品GMP的部分内容也急需做相应修改。
国家药品监督管理局自1998年8月19日成立以来,十分重视药品GMP的修订工作,先后召开多次座谈会,听取各方面的意见,特别是药品GMP的实施主体—药品生产企业的意见,组织有关专家开展修订工作。
目前,《药品生产质量管理规范》(1998年修订)已由国家药品监督管理局第9号局长令发布,并于1999年8月1日起施行。
历经5年修订、两次公开征求意见的《药品生产质量管理规范(2010年修订)》(以下简称新版药品GMP)于2011年3月1日起施行。
内容包括:目录第一章总则 1第二章质量管理 1第一节原则 1第二节质量保证 1第三节质量控制 2第四节质量风险管理 2第三章机构与人员 2第一节原则 2第二节关键人员 3第三节培训 4第四节人员卫生 4第四章厂房与设施 5第一节原则 5第二节生产区 5第三节仓储区 6第五章设备 7第一节原则 7第二节设计和安装 7第三节维护和维修 7第四节使用和清洁 7第五节校准 8第六章物料与产品 9第一节原则 9第二节原辅料 9第三节中间产品和待包装产品 10第四节包装材料 10第五节成品 10第六节特殊管理的物料和产品 10第七章确认与验证 11第八章文件管理 12第一节原则 12第二节质量标准 13第三节工艺规程 13第四节批生产记录 14第五节批包装记录 14第九章生产管理 15第一节原则 15第二节防止生产过程中的污染和交叉污染 16 第三节生产操作 16第四节包装操作 17第十章质量控制与质量保证 17第一节质量控制实验室管理 17第二节物料和产品放行 20第三节持续稳定性考察 21第四节变更控制 22第五节偏差处理 22第六节纠正措施和预防措施 22第七节供应商的评估和批准 23第八节产品质量回顾分析 23第十一章委托生产与委托检验 24第一节原则 24第二节委托方 25第十二章产品发运与召回 25第一节原则 25第二节发运 26第三节召回 26第十三章自检 26第一节原则 26第二节自检 26第十四章附则 26第一章总则第一条为规范药品生产质量管理,根据《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》,制定本规范.第二条企业应当建立药品质量管理体系。


《药品生产质量管理规范(2010年修订)》-10月份第四章厂房与设施第一节原则第三十八条厂房的选址、设计、布局、建造、改造和维护必须符合药品生产要求,应当能够最大限度地避免污染、交叉污染、混淆和差错,便于清洁、操作和维护。
第三十九条应当根据厂房及生产防护措施综合考虑选址,厂房所处的环境应当能够最大限度地降低物料或产品遭受污染的风险。
第四十条企业应当有整洁的生产环境;厂区的地面、路面及运输等不应当对药品的生产造成污染;生产、行政、生活和辅助区的总体布局应当合理,不得互相妨碍;厂区和厂房内的人、物流走向应当合理。
第四十一条应当对厂房进行适当维护,并确保维修活动不影响药品的质量。
应当按照详细的书面操作规程对厂房进行清洁或必要的消毒。
第四十二条厂房应当有适当的照明、温度、湿度和通风,确保生产和贮存的产品质量以及相关设备性能不会直接或间接地受到影响。
第四十三条厂房、设施的设计和安装应当能够有效防止昆虫或其它动物进入。
应当采取必要的措施,避免所使用的灭鼠药、杀虫剂、烟熏剂等对设备、物料、产品造成污染。
第四十四条应当采取适当措施,防止未经批准人员的进入。
生产、贮存和质量控制区不应当作为非本区工作人员的直接通道。
第四十五条应当保存厂房、公用设施、固定管道建造或改造后的竣工图纸。
页脚内容1第二节生产区第四十六条为降低污染和交叉污染的风险,厂房、生产设施和设备应当根据所生产药品的特性、工艺流程及相应洁净度级别要求合理设计、布局和使用,并符合下列要求:(一)应当综合考虑药品的特性、工艺和预定用途等因素,确定厂房、生产设施和设备多产品共用的可行性,并有相应评估报告;(二)生产特殊性质的药品,如高致敏性药品(如青霉素类)或生物制品(如卡介苗或其他用活性微生物制备而成的药品),必须采用专用和独立的厂房、生产设施和设备。
青霉素类药品产尘量大的操作区域应当保持相对负压,排至室外的废气应当经过净化处理并符合要求,排风口应当远离其他空气净化系统的进风口;(三)生产β-内酰胺结构类药品、性激素类避孕药品必须使用专用设施(如独立的空气净化系统)和设备,并与其他药品生产区严格分开;(四)生产某些激素类、细胞毒性类、高活性化学药品应当使用专用设施(如独立的空气净化系统)和设备;特殊情况下,如采取特别防护措施并经过必要的验证,上述药品制剂则可通过阶段性生产方式共用同一生产设施和设备;(五)用于上述第(二)、(三)、(四)项的空气净化系统,其排风应当经过净化处理;(六)药品生产厂房不得用于生产对药品质量有不利影响的非药用产品。

Austar Promotes Industry Advancement1动力工程部胡士光2011年3月14日新版GMP解读-第四章厂房与设施第四章厂房与设施第一节原则第三十八条厂房的选址、设计、布局、建造、改造和维护必须符合药品生产要求,应当能够最大限度地避免污染、交叉污染、混淆和差错,便于清洁、操作和维护。
第三十九条应当根据厂房及生产防护措施综合考虑选址,厂房所处的环境应当能够最大限度地降低物料或产品遭受污染的风险。
第四十条企业应当有整洁的生产环境;厂区的地面、路面及运输等不应当对药品的生产造成污染;生产、行政、生活和辅助区的总体布局应当合理,不得互相妨碍;厂区和厂房内的人、物流走向应当合理。
污染在生产,取样,包装,二次包装,贮存,运输过程中,不希望的化学杂质或微生物杂质或外界物质,进入开始原料,中间物料或附着在表面。
交叉污染一种产品的开始物料,中间产品,终产品被另外一种产品的开始物料,中间产品,终产品污染。
WHO对污染,交叉污染的定义ContaminationContaminantfrom Environment Operators Contaminantfrom EquipmentCrossContaminationProduct from Environment OperatorsProduct from Equipment第四十六条为降低污染和交叉污染的风险,厂房、生产设施和设备应当根据所生产药品的特性、工艺流程及相应洁净度级别要求合理设计、布局和使用,并符合下列要求:第四十七条生产区和贮存区应当有足够的空间,确保有序地存放设备、物料、中间产品、待包装产品和成品,避免不同产品或物料的混淆、交叉污染,避免生产或质量控制操作发生遗漏或差错。
洁净区与非洁净区之间、不同级别洁净区之间的压差应当不低于10帕斯卡。
必要时,相同洁净度级别的不同功能区域(操作间)之间也应当保持适当的压差梯度。
洁净厂区的建设与保持1.洁净厂区平面布置2.物流,人流通道3.压差梯度4.风闸间5.洁净空调6.洁净空调的操作7.洁净区的监视8.洁净区的检测9.洁净区的清洁洁净厂区平面布置Pressure cascade solids Protection from cross-contamination20PaSam pling Rooom30Pa0PaService Corridor(contains Vacuum & RO water supply)Air Shower20Pa 10PaWarehouseMAL 20PaWeigh Booth20PaPost Staging30Pa30PaT ablet 115PaT ablet 215PaLiquids M ix30PaSoftgel Capsule PackingMAL1Air Lock15Pa30PaClean CorridorEmergency ExitPAL40Pa20Pa20PaM AL 340PaSterile eyedrops dispensing & asceptic fill ing60PaM al e Change 2Fem al e Change 210Pa10Pa 15Pa10PaPacked Goods QuarantineSecondary Packing20PaPrim ary Packing30PaM AL 450PaChange50PaEquipm ent WashM al e Change 1Fem al e Change 1Air Lock 40PaService Room0Pa0Pa11第五十二条制剂的原辅料称量通常应当在专门设计的称量室内进行。

药品生产质量管理规范(GMP)目录基本简介第一章总则第二章质量管理第三章机构与人员第四章厂房与设施第五章设备第六章物料与产品第七章确认与验证第八章文件管理第九章生产管理第十章质量控制与质量保证第十一章委托生产与委托检验第十二章产品发运与召回第十三章自检第十四章附则基本简介第一章总则第二章质量管理第三章机构与人员第四章厂房与设施第五章设备第六章物料与产品第七章确认与验证第八章文件管理第九章生产管理第十章质量控制与质量保证第十一章委托生产与委托检验第十二章产品发运与召回第十三章自检第十四章附则基本简介《药品生产质量管理规范》(Good Manufacture Practice,GMP)是药品生产和质量管理的基本准则,适用于药品制剂生产的全过程和原料药生产中影响成品质量的关键工序。
大力推行药品GMP,是为了最大限度地避免药品生产过程中的污染和交叉污染,降低各种差错的发生,是提高药品质量的重要措施。
世界卫生组织,60年代中开始组织制订药品GMP,中国则从80年代开始推行。
1988年颁布了中国的药品GMP,并于1992年作了第一次修订。
十几年来,中国推行药品GMP取得了一定的成绩,一批制药企业(车间)相继通过了药品GMP认证和达标,促进了医药行业生产和质量水平的提高。
但从总体看,推行药品GMP的力度还不够,药品GMP的部分内容也急需做相应修改。
国家药品监督管理局自1998年8月19日成立以来,十分重视药品GMP的修订工作,先后召开多次座谈会,听取各方面的意见,特别是药品GMP的实施主体-药品生产企业的意见,组织有关专家开展修订工作。
目前,《药品生产质量管理规范》(1998年修订)已由国家药品监督管理局第9号局长令发布,并于1999年8月1日起施行。
历经5年修订、两次公开征求意见的《药品生产质量管理规范(2010年修订)》(以下简称新版药品GMP)于2011年3月1日起施行。
内容包括:目录第一章总则 1第二章质量管理 1第一节原则 1第二节质量保证 1第三节质量控制 2第四节质量风险管理 2第三章机构与人员 2第一节原则 2第二节关键人员 3第三节培训 4第四节人员卫生 4第四章厂房与设施 5第一节原则 5第二节生产区 5第三节仓储区 6第五章设备 7第一节原则 7第二节设计和安装 7第三节维护和维修 7第四节使用和清洁 7第五节校准 8第六章物料与产品 9第一节原则 9第二节原辅料 9第三节中间产品和待包装产品 10第四节包装材料 10第五节成品 10第六节特殊管理的物料和产品 10第七章确认与验证 11第八章文件管理 12第一节原则 12第二节质量标准 13第三节工艺规程 13第四节批生产记录 14第五节批包装记录 14第九章生产管理 15第一节原则 15第二节防止生产过程中的污染和交叉污染 16 第三节生产操作 16第四节包装操作 17第十章质量控制与质量保证 17第一节质量控制实验室管理 17第二节物料和产品放行 20第三节持续稳定性考察 21第四节变更控制 22第五节偏差处理 22第六节纠正措施和预防措施 22第七节供应商的评估和批准 23第八节产品质量回顾分析 23第十一章委托生产与委托检验 24第一节原则 24第二节委托方 25第十二章产品发运与召回 25第一节原则 25第二节发运 26第三节召回 26第十三章自检 26第一节原则 26第二节自检 26第十四章附则 26第一章总则第一条为规范药品生产质量管理,根据《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》,制定本规范。
药物制剂车间GMP规范的要求药品生产质量管理规范(2010年修订)(卫生部令第79号)第四章厂房与设施第一节原则第三十八条厂房的选址、设计、布局、建造、改造和维护必须符合药品生产要求,应当能够最大限度地避免污染、交叉污染、混淆和差错,便于清洁、操作和维护。
第三十九条应当根据厂房及生产防护措施综合考虑选址,厂房所处的环境应当能够最大限度地降低物料或产品遭受污染的风险。
第四十条企业应当有整洁的生产环境;厂区的地面、路面及运输等不应当对药品的生产造成污染;生产、行政、生活和辅助区的总体布局应当合理,不得互相妨碍;厂区和厂房内的人、物流走向应当合理。
第四十一条应当对厂房进行适当维护,并确保维修活动不影响药品的质量。
应当按照详细的书面操作规程对厂房进行清洁或必要的消毒。
第四十二条厂房应当有适当的照明、温度、湿度和通风,确保生产和贮存的产品质量以及相关设备性能不会直接或间接地受到影响。
第四十三条厂房、设施的设计和安装应当能够有效防止昆虫或其它动物进入。
应当采取必要的措施,避免所使用的灭鼠药、杀虫剂、烟熏剂等对设备、物料、产品造成污染。
第四十四条应当采取适当措施,防止未经批准人员的进入。
生产、贮存和质量控制区不应当作为非本区工作人员的直接通道。
第四十五条应当保存厂房、公用设施、固定管道建造或改造后的竣工图纸。
第二节生产区第四十六条为降低污染和交叉污染的风险,厂房、生产设施和设备应当根据所生产药品的特性、工艺流程及相应洁净度级别要求合理设计、布局和使用,并符合下列要求:(一)应当综合考虑药品的特性、工艺和预定用途等因素,确定厂房、生产设施和设备多产品共用的可行性,并有相应评估报告;(二)生产特殊性质的药品,如高致敏性药品(如青霉素类)或生物制品(如卡介苗或其他用活性微生物制备而成的药品),必须采用专用和独立的厂房、生产设施和设备。
青霉素类药品产尘量大的操作区域应当保持相对负压,排至室外的废气应当经过净化处理并符合要求,排风口应当远离其他空气净化系统的进风口;(三)生产β-内酰胺结构类药品、性激素类避孕药品必须使用专用设施(如独立的空气净化系统)和设备,并与其他药品生产区严格分开;(四)生产某些激素类、细胞毒性类、高活性化学药品应当使用专用设施(如独立的空气净化系统)和设备;特殊情况下,如采取特别防护措施并经过必要的验证,上述药品制剂则可通过阶段性生产方式共用同一生产设施和设备;(五)用于上述第(二)、(三)、(四)项的空气净化系统,其排风应当经过净化处理;(六)药品生产厂房不得用于生产对药品质量有不利影响的非药用产品。
“GMP”是英文Good Manufacturing Practice 的缩写,中文的意思是“良好作业规范”,或是“优良制造标准”,是一种特别注重在生产过程中实施对产品质量与卫生安全的自主性管理制度。
它是一套适用于制药、食品等行业的强制性标准,要求企业从原料、人员、设施设备、生产过程、包装运输、质量控制等方面按国家有关法规达到卫生质量要求,形成一套可操作的作业规范帮助企业改善企业卫生环境,及时发现生产过程中存在的问题,加以改善。
目录人用药方面,1988年在中国大陆由卫生部发布,称为药品生产质量管理规范,后几经修订,最新的为2010年修订版。
中国兽药行业GMP是在20世纪80年代末开始实施。
1989年中国农业部颁发了《兽药生产质量管理规范(试行)》,1994年又颁发了《兽药生产质量管理规范实施细则(试行)》。
1995年10月1日起,凡具备条件的药品生产企业(车间)和药品品种,可按申请药品GMP认证。
取得药品GMP认证证书的企业(车间),在申请生产新药时,卫生行政部门予以优先受理。
迄至1998年6月30日,未取得药品GMP认证的企业(车间),卫生行政部门将不再受理新药生产申请。
2002年3月19日,农业部修订发布了新的《兽药生产质量管理规范》(简称《兽药GMP规范》)。
同年6月14日发布了第202号公告,规定自2002年6月19日至2005年12月31日为《兽药GMP 规范》实施过渡期,自2006年1月1日起强制实施。
目前,中国药品监督管理部门大力加强药品生产监督管理,实施GMP认证取得阶段性成果。
现在血液制品、粉针剂、大容量注射剂、小容量注射剂生产企业全部按GMP标准进行,国家希望通过GMP认证来提高药品生产管理总体水平,避免低水平重复建设。
已通过GMP认证的企业可以在药品认证管理中心查询。
《药品生产质量管理规范(2010年修订)》第一章总则第一条为规范药品生产质量管理,根据《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》,制定本规范。
药品生产质量管理规范(GMP)目录基本简介第一章总则第二章质量管理第三章机构与人员第四章厂房与设施第五章设备第六章物料与产品第七章确认与验证第八章文件管理第九章生产管理第十章质量控制与质量保证第十一章委托生产与委托检验第十二章产品发运与召回第十三章自检第十四章附则基本简介第一章总则第二章质量管理第三章机构与人员第四章厂房与设施第五章设备第六章物料与产品第七章确认与验证第八章文件管理第九章生产管理第十章质量控制与质量保证第十一章委托生产与委托检验第十二章产品发运与召回第十三章自检第十四章附则基本简介《药品生产质量管理规范》(Good Manufacture Practice,GMP)是药品生产和质量管理的基本准则,适用于药品制剂生产的全过程和原料药生产中影响成品质量的关键工序。
大力推行药品GMP,是为了最大限度地避免药品生产过程中的污染和交叉污染,降低各种差错的发生,是提高药品质量的重要措施。
世界卫生组织,60年代中开始组织制订药品GMP,中国则从80年代开始推行。
1988年颁布了中国的药品GMP,并于1992年作了第一次修订。
十几年来,中国推行药品GMP取得了一定的成绩,一批制药企业(车间)相继通过了药品GMP认证和达标,促进了医药行业生产和质量水平的提高。
但从总体看,推行药品GMP的力度还不够,药品GMP的部分内容也急需做相应修改。
国家药品监督管理局自1998年8月19日成立以来,十分重视药品GMP的修订工作,先后召开多次座谈会,听取各方面的意见,特别是药品GMP的实施主体-药品生产企业的意见,组织有关专家开展修订工作。
目前,《药品生产质量管理规范》(1998年修订)已由国家药品监督管理局第9号局长令发布,并于1999年8月1日起施行。
历经5年修订、两次公开征求意见的《药品生产质量管理规范(2010年修订)》(以下简称新版药品GMP)于2011年3月1日起施行。
内容包括:目录第一章总则 1第二章质量管理 1第一节原则 1第二节质量保证 1第三节质量控制 2第四节质量风险管理 2第三章机构与人员 2第一节原则 2第二节关键人员 3第三节培训 4第四节人员卫生 4第四章厂房与设施 5第一节原则 5第二节生产区 5第三节仓储区 6第五章设备 7第一节原则 7第二节设计和安装 7第三节维护和维修 7第四节使用和清洁 7第五节校准 8第六章物料与产品 9第一节原则 9第二节原辅料 9第三节中间产品和待包装产品 10第四节包装材料 10第五节成品 10第六节特殊管理的物料和产品 10第七章确认与验证 11第八章文件管理 12第一节原则 12第二节质量标准 13第三节工艺规程 13第四节批生产记录 14第五节批包装记录 14第九章生产管理 15第一节原则 15第二节防止生产过程中的污染和交叉污染 16 第三节生产操作 16第四节包装操作 17第十章质量控制与质量保证 17第一节质量控制实验室管理 17第二节物料和产品放行 20第三节持续稳定性考察 21第四节变更控制 22第五节偏差处理 22第六节纠正措施和预防措施 22第七节供应商的评估和批准 23第八节产品质量回顾分析 23第十一章委托生产与委托检验 24第一节原则 24第二节委托方 25第十二章产品发运与召回 25第一节原则 25第二节发运 26第三节召回 26第十三章自检 26第一节原则 26第二节自检 26第十四章附则 26第一章总则第一条为规范药品生产质量管理,根据《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》,制定本规范。
厂房与设施(2010版GMP)GMP(Good Manufacturing Practice),即良好的生产规范,是指由世界卫生组织(WHO)所制定的适用于药品、食品等相关企业的规范。
其中,厂房与设施是GMP的重要组成部分。
厂房良好的厂房设计应该能够保护产品免受污染,为员工提供安全、舒适的工作环境,并保持厂房的清洁度。
以下是2010版GMP标准所规定的厂房要求:厂房位置厂房应选址在噪声、污染、危险物质及其他不良环境影响的最小允许界限内,确保厂房的安全性和适用性,而且符合法律法规的规定。
厂房设计厂房设计应符合安全、卫生、环保的要求。
厂房空气质量和温度、湿度应采取相应的调节手段,使其符合产品的质量标准需要。
除生产用地外,厂房内及周围的环境也应该保持清洁和卫生,以保证生产产品的质量。
厂房结构厂房内的地面、墙壁和天花板都应该采取适当的材料,表面应光滑、无凹陷、无孔洞、无渗漏。
墙面应该平整无尘、不吸水,地面应平整、无污染、无硬化及裂缝,以保证产品不受到污染。
设施良好的设施设计应该能够保持产品的卫生、安全和稳定。
因此,设施的选择和应用是符合GMP要求的重要内容。
以下是2010版GMP标准所规定的设施要求:设施的管理应当建立管理标准、流程和程序来保证设施的质量和安全性。
设施应该定期进行维护检修,并进行标准的验证和记录。
设施的保障为了确保设施的完好性和安全性,适当的保障措施是非常必要的。
如配备自动控制装置、适当的检测装置、防护装置、绝缘装置、操作安全小件等等。
设施的操作设施的使用和操作必须符合厂商的说明书,并且应该在相应的设施使用培训后,由经过培训的人员负责处理。
设施的检查应确保各种检测设施及设备的可靠性,参数符合要求,保证设备具有稳定性和准确性,以保证生产产品的质量。
总结厂房与设施是GMP中的重要组成部分,也是保障产品质量和安全的重要手段。
良好的厂房与设施设计与管理是药品、食品企业的生产质量管理的首要保证。
因此,企业要严格按照GMP的标准来要求自身的厂房和设施设计以及管理,以达到提高产品质量和保障生产过程的安全性的目的。