学习参考:有机化学中的电子效应
- 格式:doc
- 大小:194.50 KB
- 文档页数:10

3.2 有机化学中的电子效应诱导效应共轭效应超共轭效应3.2 有机化学中的电子效应电子效应: 有机分子中某个基团的存在, 使某种结构中的电子云发生了偏移的现象。
诱导效应(inductive effect )共轭效应(conjugation )超共轭效应(hypercongjugation )场效应(field effect )电子效应(详见“羧酸及其衍生物”)3.2 有机化学中的电子效应一、诱导效应诱导效应(inductive effect)( I ):因分子中原子或基团的极性(电负性)不同而引起成键电子云沿着原子链向某一方向移动的效应。
诱导效应特点:1)电子云沿原子链传递;2)诱导效应随着距离的增长迅速减弱,一般只考虑三根键的影响;3)诱导效应是一种永久效应。
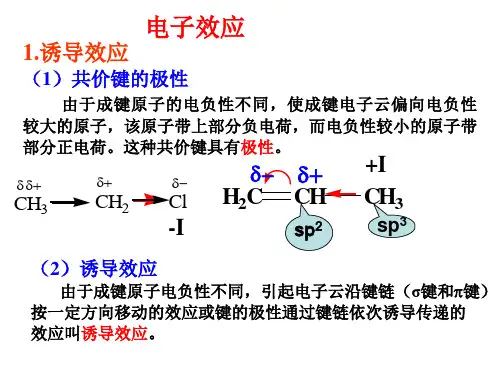
一、诱导效应氯的电负性大于碳原子,导致α-C 带正电性,Cl 原子带负电性;同理, γ-碳原子带更少的部分正电性, 用“δδδ+”表示。
由于α-碳原子带部分正电性, 其电负性大于β-碳原子, 故α-碳原子与β-碳原子间的成键电子对略偏向α-碳原子, 以致β-碳原子带较少的部分正电性, 用“δδ+”表示;CH 3CH 2CH 2CH 2Cl δ+δ-δδ+δδδ+αβγ一、诱导效应诱导效应的方向:给电子的诱导效应+I electron-donating inductive effect吸电子的诱导效应-Ielectron-withdrawing inductive effect 标准诱导效应一般以乙酸的α 氢为比较标准。
H-CH2COOH取代基的电负性小于氢的, 叫给电子基, 用“+I ”表示; 反之叫吸电子基, 用“-I ”表示。
3.2 有机化学中的电子效应一、诱导效应诱导效应大小的一般规律:①与碳原子直接相连的原子,若为同一族,吸电子诱导效应随原子序数增加而降低;若为同一周期,则从右到左吸电子效应降低。
-F > -Cl > -Br > -I-OR > -SR-F > -OR > -NR2> -CR33.2 有机化学中的电子效应一、诱导效应诱导效应大小的一般规律:②碳原子与不同杂化状态的同一元素相连, s成份越多, 吸电子能力越强。

有机化学中的电子效应与取代效应有机化学作为化学的一个重要分支,主要研究碳原子及其化合物的结构、性质和变化规律。
而有机化学中的电子效应与取代效应则是研究有机分子中电子分布和取代基对化合物性质的影响。
本文将着重探讨有机化学中的电子效应和取代效应的特点和应用。
一、电子效应在有机化学中,电子效应是指共轭体系中电子运动或电子密度改变所引起的化学性质变化。
常见的电子效应有共轭效应、杂化效应和亲电性与亲核性。
1. 共轭效应共轭效应是指当有机化合物中存在共轭体系时,电子的运动会影响到整个共轭体系中的化学性质。
一般来说,共轭体系中的π电子可在整个分子上运动,从而引起分子的共轭稳定性和共轭异构体的形成。
典型的共轭体系包括芳香性化合物和共轭双烯等。
共轭效应可以对有机化合物的稳定性、反应性和光学性质产生显著影响。
2. 杂化效应杂化效应是指由于原子轨道杂化的改变,使得有机化合物中的C—C和C—H键的键能、键长和键角等性质发生变化。
杂化效应的经典案例是烷烃和烯烃分子中的σ键和π键的性质差异。
杂化效应对于有机化合物的化学性质和反应机理具有重要的影响。
3. 亲电性与亲核性亲电性和亲核性是指有机化合物中的一种电子云相对于另一种电子云的相对亲和性。
一般来说,具有富电子云的基团属于亲电性较强,而具有亏电子云的基团属于亲核性较强。
亲电性与亲核性的大小决定了基团之间的化学反应类型,如亲电取代反应和亲核取代反应等。
二、取代效应取代效应是指取代基对有机化合物的性质产生的影响。
取代效应可以使分子的稳定性、反应性、溶解度和光学性质发生明显变化。
1. 取代基的电子效应取代基的电子效应主要分为活化效应和稳定效应两种。
活化效应是指取代基提供电子给反应部分,使其具有更强的亲电性或更强的亲核性,从而增强反应活性。
稳定效应则是指取代基通过吸引或推挤电子云,使化合物更加稳定。
2. 取代基的空间效应除了电子效应外,取代基的空间效应对有机化合物的性质也有一定影响。

有机化学基础知识点取代基的电子效应一、引言有机化学是研究有机化合物的科学,其中取代基的电子效应是理解有机化学反应机理和化合物性质的重要基础知识。
本文将介绍取代基的电子效应的基本概念、主要种类及其对化合物性质的影响。
二、取代基的电子效应1. 电子效应的概念取代基的电子效应指的是取代基与有机化合物中的π电子系统相互作用所引起的电子转移和电荷密度变化。
电子效应可以改变有机化合物的稳定性、反应性和理化性质,并直接影响有机化学反应的方向和速率。
2. 电子效应的两种主要类型(1)拉电子效应拉电子取代基是指可以通过共轭体系将电子引入π电子体系中的取代基。
例如,甲基基团(CH3)是一种拉电子取代基,它能够通过σ-σ*反键电子跃迁与共轭体系中的π电子形成共轭,使π电子体系中的电子密度增加。
拉电子取代基的引入通常会使有机化合物的反应活性增强。
(2)推电子效应推电子取代基是指可以通过共轭体系将电子从π电子体系中推出的取代基。
例如,卤素基团(X)是一种推电子取代基,它对共轭体系中的π电子施加电荷,使π电子体系中的电子密度减小。
推电子取代基的引入通常会使有机化合物的反应活性减弱。
三、取代基的电子效应与化合物性质的关系1. 取代基的电子效应对有机化合物的稳定性的影响菜单中的电子效应可以影响有机化合物的稳定性。
一般来说,拉电子取代基的引入会增加分子的稳定性,因为其增加了π电子体系的电子密度,有利于分子的共轭和杂化。
相反,推电子取代基的引入会减小分子的稳定性,因为其减小了π电子体系的电子密度,破坏了分子的共轭和杂化。
2. 取代基的电子效应对有机化合物的反应性的影响(1)取代基的电子效应对亲电性反应的影响拉电子取代基的引入会增加π电子体系的电子密度,增加化合物与亲电子体的反应活性,促进亲电性反应的进行。
推电子取代基的引入则会减小π电子体系的电子密度,降低化合物与亲电体的反应活性,抑制亲电性反应的进行。
(2)取代基的电子效应对亲核性反应的影响拉电子取代基的引入会增加π电子体系的正电荷,增大化合物中电子云的极化程度,增强亲核试剂与化合物的相互作用,促进亲核性反应的进行。




有机反应中的电子效应——有机反应机理作业班级:应用化学101班姓名:祖广权学号:2010014032在有机化学中,分子间中原子间的相互影响一般可以用电子效应和立体效应来描述,其中电子效应主要包括诱导效应和共轭效应。
所谓的电子效应顾名思义,就是通过改变分子中电子云密度的分布来影响分子的理化性质的。
下面我们将对两种相应进行讨论。
一、诱导效应当两个原子形成共价键时,由于原子的电负性不同,使成键电子云偏向于电负性较大的一方,从而形成极性共价键。
而这种极性共价键产生的电场将引起临近价键电荷的偏移。
如:C—F键形成的电场使第二个碳原子也带上部分的正电荷(σσ+),而第三个碳原子带有更小的正电荷(σσσ+)。
在分子中引入一个原子或原子团后,可使分子中电子云密度发生变化,这种变化不仅发生在直接相连的部分,而且沿着分子链影响整个分子的电子云密度分布。
这种因某一原子或原子团的电负性,而引起分子中σ键电子云分布发生变化,进而引起分子性质发生变化的效应叫做诱导效应(inductive effect),通常用I来表示。
例如:溴乙酸的酸性比乙酸的酸性要强,我们可以利用溴原子的诱导效应来解释。
我们知道溴原子的电负性比氢原子的电负性大,吸电子能力比氢原子强,所以在溴乙酸分子中,Br—C键上σ电子向 Br原子方向“偏移”,使C2原子变得带正电性,C2原子再通过C2原子影响O原子,结果在溴乙酸分子中O—H键的σ电子“偏向”O原子,加大了O—H键的极化度,从而有利于氢原子的电离,使酸性较乙酸增强。
显然溴原子的诱导效应是吸电子的。
甲酸的酸性比乙酸强,说明甲基的诱导效应与溴原子是相反的,是推电子的。
我们现在知道,诱导效应有拉电子和推电子之分,那么我们该如何判断一个原子或原子团是拉电子诱导效应还是推电子诱导效应呢?在讨论原子或原子团的诱导效应方向时,我们都以H原子作为比较标准,我们将饱和的H—C键的诱导效应规定为零。
当一个原子或原子团X取代了H—Cabc分子中的H以后,若X—Cabc分子中的Cabc 部分带了部分正电荷(常用σ+来表示)或正电荷增大,则X的诱导效应就是吸电子诱导效应或拉电子诱导效应,用-I表示。

论电子效应对有机化学反应的影响1. 引言1.1 电子效应的定义电子效应是有机化学中非常重要的概念,它指的是共有化学键中电子的移动对分子性质和反应活性的影响。
在分子中,电子可以通过共价键的形式参与化学反应,并且对反应的速率和选择性起着至关重要的作用。
电子效应可以影响分子的电子密度分布,从而改变分子的极性和反应性。
电子效应涉及到电子的移动、共振、电子推移和拉屏效应等多种现象,可以细分为诸如电子给体效应、电子吸引体效应、电子偶极效应等不同类型。
在有机化学反应中,电子效应起着至关重要的作用。
它可以影响反应物的亲核性或亲电性,并且决定了反应的速率和选择性。
电子效应还可以影响反应的过渡态结构,并直接影响反应的反应机理。
理解和控制电子效应对于设计和优化有机化学反应至关重要。
在接下来的将详细探讨不同类型的电子效应在不同有机化学反应中的具体作用。
1.2 电子效应在有机化学反应中的重要性电子效应在有机化学反应中的重要性可以说是至关重要的。
在有机化学中,分子的行为往往受到电子的影响,而电子效应则正是描述了分子中电子在不同化学环境下的行为。
通过电子效应的研究,我们能够更深入地理解有机分子之间的相互作用和反应机制。
在有机化学反应中,电子效应可以影响反应的速率、选择性和产物稳定性。
在亲核取代反应中,电子效应决定了亲核试剂与受体分子之间的亲核攻击位置;在亦氨基反应中,电子效应则影响了亦氨基试剂与电子不饱和键之间的加成位置;而在亲电取代反应和求核取代反应中,电子效应则决定了反应底物分子中的亲电性和求核性基团在反应中的活性。
电子效应对有机化学反应的影响是多方面的,并且在不同类型的反应中发挥着不同的作用。
进一步研究电子效应有助于我们更深入地理解和预测有机化学反应的发生机理,从而为有机合成和药物设计等领域提供更多的理论基础和实践指导。
2. 正文2.1 电子效应的分类电子效应是有机化学中非常重要的概念,它指的是电子对分子性质和反应影响的现象。

有机化学中电子效应及空间效应课件 (一)有机化学是一门分子结构、功能和反应的学科,而电子效应及空间效应则是有机化学中非常重要的概念。
本文将介绍有机化学中电子效应及空间效应的基本概念和应用。
一、电子效应电子效应是研究有机化合物中电荷分布变化对其物理、化学性质的影响的学科。
它主要研究如何通过电子的转移和变化来引起有机化合物发生反应,控制有机化合物的化学性质及理化性质。
目前有机化学中电子效应主要有电负性、电子亲和力、取代基效应、杂化、共振和极性等几个重要概念。
1. 电负性:电负性是指原子对电子的亲和力测量的物理量,描述了一个原子对外界电子的吸引力,通常用Pauling的电负度表示。
通常来说,原子的电负性越大,对外界电子的吸引力越强,化学性质就会更加活泼。
2. 取代基效应:又称为取代基效应,则是不同取代基施加于同一分子时所引起的性质变化。
3. 共振:共振是指一些多重键更准确地说是一种含多种键的共现关系,它是分子中化学键的电子分布不唯一的现象。
我们可以通过共振结构来描述分子中化学键的电子分布。
一般来说,共振结构越多,分子的稳定性越高,反应性越小。
二、空间效应在有机化学中,空间效应是指取代基、自由基、离子、分子或它们的部分在空间三维空间内位置的分布不同,从而导致分子的物理、化学性质的结果。
空间效应有许多种不同的方式来作用于分子中,包括空间赋形、受力、轴向化等。
1. 空间构象:分子中原子的排布空间构象或构型是保持分子几何形状的关键。
空间构象是分子之间重要的相互作用的基础,它决定了分子的物理、化学性质。
2. 常见空间效应:空间效应不仅与键长、键角、半箭头作用等有关,而且还与空间结构及原子的尺寸及构型等有关。
常见的空间效应包括吸电子效应、空气位效应、受扰动因素等。
3. 空间结构:空间结构是指分子中化学键的分布、方向、长度等在空间中的排列结构。
对于一个有机化合物来说,它的化学性质和物理性质可能会发生变化,这些变化与化学键的排布空间结构有关。
有机化学基础知识点有机物的电子效应和共轭效应有机化学是研究碳元素及其化合物的科学,其中有机物的电子效应和共轭效应是基础知识点之一。
电子效应指的是有机分子中原子轨道电子自身或与其它原子间的相互作用产生的效应,而共轭效应则是指相邻多个π键在共同作用下形成一组共轭体系后的效应。
本文将从电子效应和共轭效应两方面进行讨论。
一、电子效应1. 取代基效应在有机化合物中,原子或基团的取代会对分子的性质产生显著影响。
电子给体(电子供应基团)对有机分子具有+I效应(电子效应),使分子带有正电荷;而电子受体(电子吸引基团)则对有机分子具有-I效应(电子效应),使分子带有负电荷。
举例来说,甲醇(CH3OH)中的羟基(-OH)是一个电子给体,在碳原子上提供了一个富电子密度。
而甲酸(HCOOH)中的羧基(-COOH)是一个电子受体,导致碳原子上的电子云向自身集中,并带有负电荷。
2. 形成共轭体系的电子效应当共轭体系中的π键数量增加时,分子的稳定性和共轭效应会增强。
共轭体系可以通过增加共轭双键、共轭三键或环状结构来形成。
例如,苯(C6H6)是一个具有共轭体系的芳香烃,由6个碳原子和6个氢原子构成的六角形结构。
苯环中的π键相互作用形成了一个共轭体系,使苯分子的稳定性增强。
二、共轭效应1. 共轭体系的形成共轭体系指的是由相邻的不同杂化态碳原子上的π键组成的体系。
这些π键在共轭作用下共享电子,并通过共享电子来稳定整个体系。
共轭体系可以由多个碳原子形成的烯烃类物质、芳香族化合物以及其他具有共轭结构的有机分子中找到。
2. 共轭体系的效应共轭体系的形成影响了分子的反应性、吸收光谱和电子结构等性质。
共轭体系的存在使分子的能带结构发生变化,导致电子能级分布宽度增加,从而使分子的稳定性增强。
共轭体系对于有机分子的化学性质具有重要影响。
例如,共轭体系可以使有机分子的吸收光谱发生位移,使其吸收特定波长的光线。
此外,共轭体系也可以影响有机分子的反应性,使其更容易参与一些特定的反应。
在有机化学反应中应用电子效应和相邻效应调控反应条件Introduction有机化学反应是化学研究中最重要的领域之一,它涉及到一系列的化学变换,从基础的化学键形成和断裂到更加复杂的反应机理和分子间相互作用。
对于一个有机化学家来说,掌握各种反应条件的调节是至关重要的。
在这篇文章中,我们将讨论两种重要的调节手段:电子效应和相邻效应。
电子效应(Electronic effect)电子效应是指由于它们的电子结构发生变化而引起的化学反应中的影响。
这种变化可以来自于分子中的电子的重新分配(即共价键和孤对电子的重新定位)和分子之间的电子移动。
电子效应分为两类:诱导效应和共振效应。
诱导效应是由于电子云的电场引力而产生的,共振效应则是由于电子云的共存而导致的。
诱导效应(Inductive effect)诱导效应指的是由于相邻原子之间的电子云密度变化导致的反应中的影响。
它是由于一个原子的电子云中的电子被吸引到另一个原子上而导致的。
这种吸引是由于原子之间的电差而引起的。
例如,在碳原子上添加一个甲基基团时,烷基基团中的电子就会向碳原子诱导电流。
这种诱导是一个向原子内部或内部和外部方向的过程。
在有机化学中,诱导效应通常被用来调节分子结构和反应性质。
共振效应(Resonance effect)共振效应是由于分子中电子分布的重排而产生的效应。
当化学键中的电子在分子内移动时,它们可能会重排到另一个原子中,导致与原来的位置不同的原子上的氢键或改变其化学性质。
例如,对甲苯磺酸中的苯环进行甲基化时,由于苯环中电子密度的变化会导致一系列的反应变化,包括亲核试剂的加成和消除反应。
相邻效应(Neighbor effect)相邻效应指的是在分子中相邻官能基之间相互影响的过程。
它可以通过改变官能基的位置、改变官能基之间的距离或改变溶剂环境来实现。
相邻效应通常由于分子中的非局部相互作用(包括空间电场、空间协同作用和电荷分布)而产生。
如何应用电子效应和相邻效应调节反应条件1.应用诱导效应调节反应性质考虑经典的亲核取代反应。
有机化学中的电子效应(二)引言概述:电子效应是有机化学中一个非常重要的概念,它描述了分子中电子的分布和运动对化学反应的影响。
本文是电子效应系列的第二篇,将继续深入探讨电子效应在有机化学中的应用和重要性。
正文内容:一、原子的电子亲和力1.原子电子亲和力的定义和意义2.电子亲和力与分子架构的关系3.电子亲和力在反应选择性中的应用4.电子亲和力在化学反应速率中的影响5.电子亲和力与溶剂极性的关系二、共轭体系的电子效应1.共轭体系的定义和特征2.共轭体系中的电子共享与电子结构3.共轭体系与分子的共轭效应4.共轭体系在化学反应中的作用5.共轭体系的应用举例三、电子给体和电子受体1.电子给体和电子受体的定义和分类2.电子给体和电子受体在电子转移反应中的作用3.电子给体和电子受体之间的常见反应机制4.电子给体和电子受体在有机合成中的应用5.电子给体和电子受体的官能团效应四、杂原子的电子效应1.杂原子的定义和常见种类2.杂原子的电子亲和力和电负性3.杂原子在分子中的电子效应4.杂原子在催化反应中的应用5.杂原子对分子性质的影响五、电子对效应1.电子对的定义和电子对效应的原理2.电子对的共振效应3.电子对的笼罩效应4.电子对在分子中的空间排布规律5.电子对效应在化学反应中的应用总结:电子效应是有机化学中一个非常重要的概念,它涉及诸多方面的化学现象和反应机理。
本文通过讨论电子效应在不同层面的应用,从电子亲和力、共轭体系、电子给体和电子受体、杂原子以及电子对效应等方面,深入阐述了电子效应的重要性和应用价值。
通过对电子效应的研究,我们可以更好地理解和预测有机化学中的各种反应性质,为有机化学的发展和应用提供更加深入的基础。
有机化学中的电子效应电子效应是影响有机化合物反应活性和反应规律的重要因素之一,深入理解有机化学中的电子效应,可以对有机化学的认识由感性向理性方向发展。
电子效应包括诱导效应、共轭效应和超共轭效应;有时三种效应同时存在,表现共同作用的综合结果。
一、诱导效应(Inductive effect )诱导效应是电子效应的一种,是由路易斯(Lewis )首先提出。
路易斯认为,对于有机化合物,诱导效应是由一个电负性较强的原子X 取代了碳原子上的氢原子后,在C -X 键上产生一个极性分布,这个极性分布通过电性诱导作用,在分子中其它键上引起一系列的极性变化,结果在整个分子中产生一个向着X 原子方向的较大范围的电子运动,这种电子运动称为诱导效应:CCδ-电负性比碳弱的元素原子也可以在分子中引起一系列的极性变化,只是所产生的诱导效应的方向刚好相反。
诱导效应是指在有机化合物分子中引入一个基团或原子后,由于原子的电负性差异,导致σ键电子的移动,使分子中的电子云密度分布发生变化,而这种变化不但发生在直接相连的部分,也可以影响到不直接相连的部分。
这种因某一原子或基团的极性而引起电子沿碳链向某一方向移动的效应,称为诱导效应。
如氯丙烷分子中,取代在碳上的氯原子的电负性较强, C -Cl 键产生偶极,使与氯原子连接的第一个碳原子(α-碳原子)产生部分正电荷(δ+),也使第二个碳原子带有部分正电荷,第三个碳原子带有更少的正电荷,依次影响下去。
这种影响的特征是沿着碳链传递,并随着碳链的增长而迅速减弱或消失,一般传递到第三个碳原子就可忽略不计。
诱导效应是一种静电作用,共用电子并不能完全转移到另一原子,只是电子云密度分布发生变化,亦即键的极性发生变化。
δ+ δ+ δ+ δ- CH 3—CH 2—CH 2→Cl1.静态诱导效应(I s )诱导效应分为静态诱导效应和动态诱导效应。
静态诱导效应是由分子本身结构决定的,是分子本身所固有的极化效应,与由极性溶剂或反应试剂等产生的外电场无关。
⑴ –I 效应和+I 效应静态诱导效应通常采用烷烃H -CR 3上的氢作为比较标准,规定其为0。
如果用电负性较碳原子大的X 取代了H -CR 3中的氢原子后,化合物X -CR 3中-CR 3部分的电子云密度比在H -CR 3中小,X 叫做吸电子基团。
由吸电子基团引起的诱导效应,叫做吸电子诱导效应,用-I 表示。
如果用电负性较碳原子小的Y 取代了H -CR 3中的氢原子,化合物Y -CR 3中-CR 3部分的电子云密度比在H -CR 3中大,Y 叫做给电子基团。
由给电子基团引起的诱导效应,叫做给电子诱导效应,用+I 表示。
δ+ δ- δ-δ+Y→CR3H—CR3 X←CR3+I效应I = 0 -I效应⑵–I效应和+I效应的相对强度静态诱导效应的强弱与取代基或原子的电负性相关。
常见的取代基或原子的电负性强弱顺序如下:-F >-Cl >-Br >-I >-OCH3 >-NHCOCH3 >-C6H5 > H >-CH3 >-C(CH3)3在H左边的是吸电子基团,在H右边的是给电子基团;吸电子或给电子的能力越大,产生的诱导效应也越强。
对于同族元素来说,吸电子诱导效应:-F >-Cl >-Br >-I。
对于同周期元素来说,吸电子诱导效应:-F > -OR > -NR2。
对于不同杂化状态的同一原子来说,s轨道成分越多,吸电子能力越强:≡N > =NR >-NR2;-C≡CR >-C6H5 >-CR=CR2 >-CR2-CR3。
烷基主要是给电子基团,不同烷基的相对给电子强度如下:(CH3)3C-> (CH3)2CH-> CH3CH2-> CH3-。
在碳链上的烷基只在与不饱和碳相连时才显+I效应。
⑶–I效应与+I效应与有机物的酸碱性的影响原子或取代基的电负性,通常由测定取代酸的解离常数求出。
如乙酸是一种弱酸,其解离常数是K a=1.74×10-5。
当α位引入一个电负性比氢强的氯原子时,诱导效应使羧基碳原子的电子沿碳链向氯原子转移,相对降低了羧羟基氧原子的电子云密度,结果就增强了羧基氢原子的解离,氯乙酸的酸性较乙酸强,其解离常数K a=1.55×10-3,比乙酸大80多倍。
若用氯原子继续取代α位上的氢原子,得到的氯代乙酸的酸性也将继续增强。
CH3COOH K a=1.74×10-5CH2ClCOOH K a=1.55×10-3CHCl2COOH K a=5.01×10-2CCl3COOH K a=2.3×10-1当乙酸α位上的氢原子被甲基取代时,所得产物丙酸的酸性(K a=1.4×10-5)却弱于乙酸,可见甲基的电负性小于氢原子,是给电子基,由它引起的诱导效应与氯原子相反,使羟基的氢解离更难,降低了酸性。
⑷诱导效应的传递诱导效应在分子内传递时,随距离的增加而迅速减弱。
如丁酸烃基部分不同碳原子上发生氯原子取代得到的氯代丁酸异构体解离常数K a:CH3CH2CHClCOOH K a=1.39×10-3CH3CHClCH2COOH K a=8.9×10-5CH2ClCH2CH2COOH K a=3.2×10-5氯原子离羧基越远,对羧基的影响越弱,增强酸性的作用就越弱。
2.动态诱导效应(I d)在化学反应中,反应物分子的反应中心如果受到极性试剂的进攻,其共价键的电子云分布受到试剂分子产生的外电场影响会发生变化。
这种变化与外电场强度和共价键的极化能力有关。
这种因极性试剂、极性溶剂等外界电场因素的影响而引起分子中电子云的偏移,使分子发生暂时极化(或极化的暂时加强)的诱导效应称为动态诱导效应。
动态诱导效应是暂时性效应,仅在外界电场存在时存在,但动态诱导效应常对反应常起很重要的作用。
例如在丙烯分子中,分子内部存在着静态诱导效应。
当受到正离子进攻时,诱导极化就加强了,这种影响属于动态诱导效应。
当正离子离去时,则分子又恢复到原来状态。
δ+ δ- δ+ δ-CH 3→CH=CH 2 CH 3→CH=CH 2……Y ++I s 效应 +I d 效应静态诱导效应是分子的内在性质,它既能对反应起促进作用,也能对反应起阻碍作用。
动态诱导效应是由于反应过程中由反应试剂产生的外界电场的极化引起的,电子云的转移及其方向是反应试剂进攻造成的,符合反应变化的要求,即电子云向有利于反应的方向转移,因此动态诱导效应对反应总是起着促进作用。
例如在硝基甲烷分子中,硝基是强吸电子基,具有-I s 效应,使碳上的氢原子有质子化的趋势,但并未离解,仍为共价化合物。
如有强的供电子基如OH -基接近时,负离子对氢原子的作用增强了硝基的-I s 作用,即产生了动态诱导效应。
这种作用相当强,可使 氢完全质子化,并和OH -结合成水:N O 2HOHN OCH 2H 2O+此反应中静态诱导效应和动态诱导效应作用方向一致,有利于氢原子的质子化。
诱导效应并不专指在分子中沿分子链进行传递的电子效应,还包括在空间传递的场效应。
例如,顺、反丁烯二酸的酸性差异,它们的第一级解离常数比较接近(顺丁烯二酸的K a 1= 1.42×10-2,反丁烯二酸的K a 1 = 9.3×10-4),但其第二级解离常数却相差很远。
H C COO -CCOOHH +H 2OH C COO -CCOO-H +H 3O+K a 2 = 8.57×10-7CC H-OOCH COOH+H 2OCCH -OOCH COO -+H 3O+K a 2 = 3.62×10-5假若羧基负离子的影响只沿碳链传递,那么它们的第二级解离常数也应该很接近,因为它们的碳链长度相同,只有羧基分布方向上的差异(构型差异)。
合理的解释是顺丁烯二酸的羧基负离子与第二个羧基位于双键的同侧,空间距离较近,负离子的给电子效应对羧基的影响较大,使羧基解离受抑制,顺丁烯二酸的第二级解离比通常一元羧酸小近50倍;而在反丁烯二酸的酸式盐中,阴离子与第二个羧基位于双键的两侧,空间距离较远,相互影响较小,反丁烯二酸的第二级解离与通常一元羧酸相近。
这种通过空间的相互影响,是诱导效应的特殊形式,尽管不是沿碳链传递,仍是整个诱导效应的一部分,称为场效应或空间效应。
3.诱导效应对有机物性质的影响 ⑴ 吸电子取代基对羧酸酸性的影响烃基上有取代基的羧酸(取代酸)的酸性受取代基的诱导效应,酸性发生改变,具有+I 效应的取代基使取代酸的酸性比未取代的羧酸弱,具有-I 效应的取代基使取代酸的酸性比未取代的羧酸强。
⑵ 烷基对胺的碱性的影响取代在氮原子上的烷基的+I 效应使氮原子上电子云密度增大,胺接受质子的能力增强,碱性增强:(CH 3)2NH > CH 3NH 2 > NH 3。
⑶ 烷基对羰基亲核反应活性的影响取代在羰基碳原子上的烷基的+I 效应使羰基碳原子上电子云密度增大,对亲核试剂的反应活性降低,而吸电子取代基使羰基的反应活性增高:三氯乙醛> 甲醛> 醛> 酮。
⑷烷基对碳正离子稳定性的影响取代在碳正离子上的烷基的+I效应使碳正离子的正电荷密度降低,碳正离子的稳定性增大:3o碳正离子> 2o碳正离子> 1o碳正离子> 甲基碳正离子。
⑸取代基对碳负离子稳定性的影响取代在碳负离子上的吸电子基团的-I效应使碳负离子的负电荷密度降低,碳负离子的稳定性增大:-CH2COOH > -CH2CH2COOH > -CH2CH2CH2COOH (羧基-COOH是吸电子基)。
⑹对烯烃亲电加成反应的反应速度的影响如乙烯及其衍生物的溴化反应:容易。
当在C=C上连有+I基团时,增加了C=C上π电子云的密度,从而有利于亲电试剂的进攻,使反应速度加快,因此四甲基乙烯的反应速度最大。
反之,在C=C上连有-I效应基团时,如-X、-COOH等,会降低双键上的π电子云密度,不利于亲电试剂的进攻,使反应速度降低。
⑺对苯环上亲电取代反应的反应速度的影响苯环上的取代反应是亲电取代反应,带有给电子基的苯环电子云密度增大,亲电试剂容易向苯环进攻,亲电反应速率增高,如烷基苯的取代反应速率高于苯。
带有吸电子基的苯环电子云密度减小,亲电试剂不易向苯环进攻,亲电反应速率降低,如苯磺酸的取代反应速率低于苯。
二、共轭效应(Conjugative effect)在某些有机化合物分子中,由于双键与双键之间、p 轨道与双键之间的相互影响,得电子云不仅仅局限在某个碳原子上或两个原子之间形成的共价键上,而是分散在多个原子构成的“离域”体系中(离域相对于定域-两个原子形成的共价键的限定区域),这种离域体系就是共轭体系。