RFLP
- 格式:doc
- 大小:156.50 KB
- 文档页数:5

限制性片段长度多态性(Restriction Fragment of Length Polymorphism,RFLP)一基本原理各种限制性酶能识别特定的碱基序列,并将其切开。
碱基的变异可能导致切点的消失或新切点的出现,从而引起DNA片段长度和数量的差异。
用特定的限制性内切酶消化目标DNA并通过电泳将长度不同的片断分开,并印记于硝酸纤维滤膜上,再与相应的探针杂交,就可以检测限制性片段长度多态性(RFLP).二主要材料DNA抽提用试剂,限制性内切酶,dNTP及Taq聚合酶电泳用琼脂糖或聚丙烯酰胺配制试剂,PCR扩增仪,水浴锅,电泳仪和电泳槽,硝酸纤维素滤膜或尼龙膜,探针标记物等。
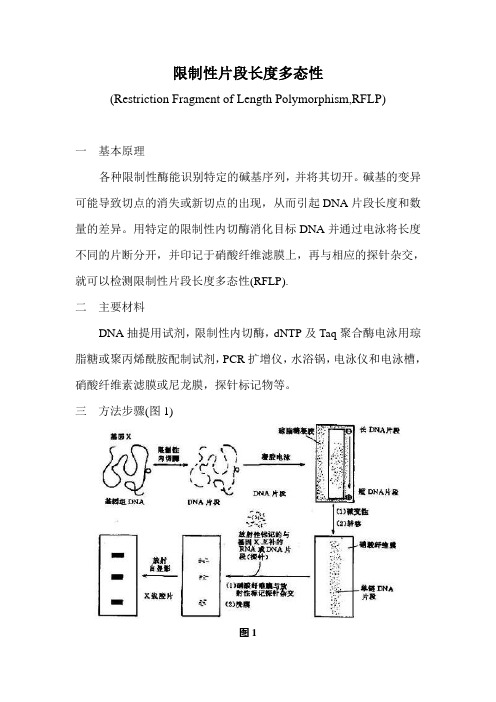
三方法步骤(图1)图1(一) 样本DNA制备采用常规DNA抽提的方法或DNA抽提试剂盒提取样本DNA,置低温下保存。
对大多数样本而言,用于分析的样本DNA片段须先从总DNA中分离获取,并制备足够的量。
为此,RFLP分析常先用PCR方法扩增目标片段。
无论怎么做,必须保证DNA样本的纯度,这一点是非常重要的。
(二) 限制性内切酶降解样本DNA根据不同的目标DAN,选择合适的限制性内切酶。
目前常用的限制性内切酶有EcoRⅠ和HindⅢ等。
该步骤必须保证酶解完全。
如果有必要,可以用琼脂糖凝胶电泳溴化乙锭分析酶解结果。
酶解的时间根据实际情况而定。
(三) 电泳电泳的主要目的是把DNA片段按大小(长短)分离开来,得到一个根据分子量排列的连续带谱。
电泳可采用琼脂糖凝胶电泳,也可采用聚丙烯酰胺凝胶电泳。
时间由几小时到24小时不等。
(四) 转印所谓转印,就是将已经电泳的DNA片段通过一定的方法转到固相支持物上。
常用的固相支持物有硝酸纤维素滤膜或尼龙膜。
转印前需经过碱变性溶液处理,将双链DNA变性为单链DNA。
转印的方法一般有三种。
根据DNA分子的复杂度转移2―12小时。
1 盐桥法;也叫毛细管转移法。
先把硝酸纤维素滤膜放在20×SSC 溶液中浸透,然后把滤膜平铺在凝胶上,再在滤膜上放上浸过20×SSC溶液的滤纸3张,再在该滤纸层上铺上干燥的滤纸3张,由于滤纸的吸附作用,胶下的缓冲液透过凝胶被吸附上来,同时胶中的DNA 分子就转移到滤膜上。



RFLP和RAPD技术原理和操作步骤原理:DNA分⼦⽔准上的多态性检验测定技术是施⾏基因组研讨的基础。
RFLP(Restriction Fragment Length Polymorphism,限⽌断⽚长度多态性)已被⼴泛⽤于基因组遗传图谱构建、基因定位以及有⽣命的物质⾼级演化和分类的研讨。
RFLP是依据不⼀样品种(个体)基因组的限⽌性内切酶的酶切位点碱基发⽣突变,或酶切位点之间发⽣了碱基的插进去、缺失,造成酶切断⽚体积发⽣了变动,这种变动可以经过特别指定探针杂交施⾏检验测定,因此可⽐较不⼀样品种(个体)的DNA⽔准的差别(即多态性),多个探针的⽐较可以稳固建⽴有⽣命的物质的⾼级演化和分类关系。
所⽤的探针为出处于同种或不⼀样种基因组DNA的克隆,位于染⾊体的不⼀样位点,因此可以作为⼀种分⼦标记(马克),构建分⼦图谱。
当某个性状(基因)与某个(些)分⼦标记协同离合时,表明这个性状(基因)与分⼦标记连锁。
分⼦标记与性状之间交换值的体积,即表达⽬的基因与分⼦标记之间的距离,因此可将基因定位于分⼦图谱上。
分⼦标记克隆在质粒上,可以蕃息及保留。
不⼀样限⽌性内切酶割切基因组DNA后,所切的断⽚类型不同,因为这个,限⽌性内切酶与分⼦标记组成不⼀样组合施⾏研讨。
常⽤的限⽌性内切酶普通是HindⅢ,BamHⅠ,EcoRⅠ,EcoRV,XbaⅠ,⽽分⼦标记则有⼏个甚⾄于上千个。
分⼦标记越多,则所构建的图谱就越达到最⾼限度。
构建达到最⾼限度图谱是RFLP研讨的主重要的条⽬标之⼀。
使⽤随机引物扩增寻觅多态性DNA断⽚可作为分⼦标记。
这种办法即为RAPD(Random amplified polymorphic DNA ,随机扩增的多态性DNA)。
尽管RAPD技术诞⽣的时间很短, 但因为其独有特别的检验测定DNA多态性的形式以及迅速、简单⽅便的独特的地⽅,使这个技术已渗透于基因组研讨的多种⽅⾯。
该RAPD技术树⽴于PCR技术基础上,它是利⽤⼀系列(⼀般数百个)不⼀样的随机排列碱基顺着次序的寡聚核苷酸单链(⼀般为10聚体)为引物,对所研讨基因组DNA施⾏PCR扩增.聚丙烯酰胺或⽯花胶糖电泳离合,经EB染⾊或放射性⾃显影来检验测定扩增加产量物DNA断⽚的多态性,这些个扩增加产量物DNA断⽚的多态性反映了基因组相应地区范围的DNA多态性。
RFLP名词解释RFLP是限制性片段长度多态性(Restriction Fragment Length Polymorphism)的缩写,是一种分子生物学技术,常用于分析DNA样本中的基因型。
下面对RFLP进行详细解释,包括其原理、应用和优缺点。
RFLP技术是基于DNA序列的差异来检测个体间的基因型差异。
它利用了DNA序列中的限制性内切酶剪切位点的多态性,通过对DNA样本进行酶切和凝胶电泳,分析得到的DNA片段长度的差异来判断个体的基因型。
RFLP技术的原理如下:1. 获取DNA样本:从个体的细胞中提取DNA样本,可以通过多种方法如血液、唾液、组织样本等获得。
2. DNA酶切:用特定的限制性内切酶对DNA样本进行酶切。
限制性内切酶是一种具有特异性的酶,它会识别和切割特定的DNA序列。
如果个体的DNA序列中存在特定的切割位点,则酶切会产生不同长度的DNA片段。
3. 凝胶电泳:将经过酶切的DNA样本加载到凝胶电泳槽中,经过电场离子迁移,分离出不同长度的DNA片段。
4. 可视化和分析:通过染色或探针杂交等方法,对电泳结果进行可视化,并进行分析确定DNA片段的长度。
RFLP技术得以应用于诸多领域,具有以下几个主要的应用方面:1. 遗传病分析:RFLP技术可以用于检测导致遗传病的基因突变。
通过分析DNA序列中的限制性内切酶位点是否发生改变,可以确定个体是否携带突变基因,并判断其患病风险。
2. 亲子鉴定:利用RFLP技术可以对个体的DNA样本进行比对,确定亲子关系。
通过对父母和子女DNA样本的酶切和电泳分析,可以判断是否存在一致的DNA片段长度,从而确定亲子关系。
3. 种群遗传学研究:通过对不同个体的DNA样本进行RFLP 分析,可以判断不同个体之间的基因型差异,从而对种群内的遗传多样性进行研究,了解不同种群的遗传背景及遗传演化。
4. 进化与系统发生关系研究:RFLP技术可以用于研究不同物种或亚种之间的进化关系。
限制性片段长度多态性(RFLP,Restriction Fragment Length Polymorphism)RFLP技术于1980年由人类遗传学家Bostein提出。
它是第一代DNA分子标记技术。
Donis—Keller利用此技术于1987年构建成第一张人的遗传图谱。
DNA 分子水平上的多态性检测技术是进行基因组研究的基础。
RFLP(Restriction Fragment Length Polymorphism,限制片段长度多态性)已被广泛用于基因组遗传图谱构建、基因定位以及生物进化和分类的研究。
RFLP是根据不同品种(个体)基因组的限制性内切酶的酶切位点碱基发生突变,或酶切位点之间发生了碱基的插入、缺失,导致酶切片段大小发生了变化,这种变化可以通过特定探针杂交进行检测,从而可比较不同品种(个体)的DNA水平的差异(即多态性),多个探针的比较可以确立生物的进化和分类关系。
所用的探针为来源于同种或不同种基因组DNA的克隆,位于染色体的不同位点,从而可以作为一种分子标记(Mark),构建分子图谱。
当某个性状(基因)与某个(些)分子标记协同分离时,表明这个性状(基因)与分子标记连锁。
分子标记与性状之间交换值的大小,即表示目标基因与分子标记之间的距离,从而可将基因定位于分子图谱上。
分子标记克隆在质粒上,可以繁殖及保存。
不同限制性内切酶切割基因组DNA后,所切的片段类型不一样,因此,限制性内切酶与分子标记组成不同组合进行研究。
常用的限制性内切酶一般是HindⅢ,BamHⅠ,EcoRⅠ,EcoRV,XbaⅠ,而分子标记则有几个甚至上千个。
分子标记越多,则所构建的图谱就越饱和。
构建饱和图谱是 RFLP 研究的主要目标之一。
1 原理
该技术是利用限制性内切酶能识别DNA分子的特异序列,并在特定序列处切开DNA分子,即产生限制性片段的特性,对于不同种群的生物个体而言,他们的DNA序列存在差别。
如果这种差别刚好发生在内切酶的酶切位点,并使内切酶识别序列变成了不能识别序列或是这种差别使本来不是内切酶识别位点的DNA序列变成了内切酶识别位点。
这样就导致了用限制性内切酶酶切该DNA序列时,就会少一个或多一个酶切位点,结果产生少一个或多一个的酶切片段。
这样就形成了用同一种限制性内切酶切割不同物种DNA序列时,产生不同长度大小、不同数量的限制性酶切片段。
后将这些片段电泳、转膜、变性,与标记过的探针进行杂交,洗膜,即可分析其多态性结果。
2 实验流程
限制酶酶切DNA片断→限制性酶切片段进行凝胶电泳→转膜→变性→与标记探针杂交→洗膜→结果分析
二、RFLP技术的基本步骤
这一技术主要包括三大步骤:
1、靶DNA的准备先将基因组DNA抽提出来,选用合适的限制性核酸内切酶酶解基因组DNA,将酶解出来的具有各种长度的DNA片段在琼脂糖凝胶电泳分离,使其按片段的长短排列,将D NA片段变性后转移至硝酸纤维膜或尼龙膜上,称印迹(Southernb1ot)转移,并在80℃烘烤或用长波紫外线照射,将DNA固定在膜上。
2、核酸探针的标记将准备作为探针的DNA片段纯化(这些DNA片段可以是基因组DNA的一个片段,或是cDNA,或是人工合成的寡核苷酸),用放射性元素(如α-32p)或非放射性元素(如Dig-dUTP等)标记,经纯化后再用。
探针的获得最先用内切酶处理植物的 DNA获得DNA片段,再将其重组到质粒上,使它能插人细菌寄主细胞并在里面进行复制,通过稀释繁殖,每个菌落一般由携带某一段 DNA的细菌繁殖而来,这种在细菌细胞中扩增、纯化DNA 片段的过程称做DNA克隆,这—系列的克隆经放射性同位素标记就成了一系列的探针。
3、杂交显示将标记好的探针与硝酸纤维膜或尼龙膜上的单链核酸杂交,洗膜去除未杂交的标记探针后,进行放射自显影或加入酶的底物进行显色反应,再对显示出来的谱带进行分析。
3 特点
优点:数据多态信息量大,呈共显性标记,不受显隐性关系、环境条件、发展阶段及组织部位影响。
结果稳定,重复性好,探针多。
缺点:技术复杂,周期长,费用高;检测中需放射性物质,限制了广泛应用;检测多态性水平过分依赖限制性内切酶,使多态性降低;DNA量大,分析速度慢。
在做RFLP分析技术时,有几个问题是需要引起密切注意:
第一,作为检测对象的DNA分子必须保持大分子,在抽提DNA的过程中避免人为地将DNA分子机械性切割成小片段的DNA,否则最终显示的RFLP图谱
可能是一种假象;
第二,在用限制性内切酶消化大分子DNA时,要使DNA被完全消化,否则所得的结果也不可靠;
第三,被消化的DNA浓度不能太高;
第四,电泳时要用低压电泳;
第五,杂交前探针必须充分变性;
第六,要根据探针标记的情况以及探针与靶DNA间序列互补的程度和G、C 的含量来掌握杂交和洗膜的条件;
第七,作放射自显影时,要根据杂交后膜上的放射活性等因素决定曝光的时间。
4 应用
RFLP 技术多应用制作遗传连锁图谱,如水稻RFLP连锁图的建立。
另外,根据RFLP 制作的图谱可以进行对农作物及家畜遗传学的研究和开展人类相关遗传病的研究,以及品种的鉴定、分类等。