化学平衡之恒温恒容(浓度与压强的冲突)
- 格式:docx
- 大小:1.88 MB
- 文档页数:17

解决化学平衡问题的两种方法化学平衡研究的对象是可逆反应,所以一旦反应开始,体系中反应物和生成物的浓度均不能为零。
因此,在研究化学平衡问题时,我们常采用极端假设和过程假设的方法。
这两种方法对于等效平衡的问题研究尤为实用。
所谓等效平衡是指:对于在两个不同容器中发生的同一可逆反应,如果体系中各组分的百分含量均相等,则称这两个容器中的平衡状态为等效平衡状态。
下面分别说明两种假设分析方法的用法。
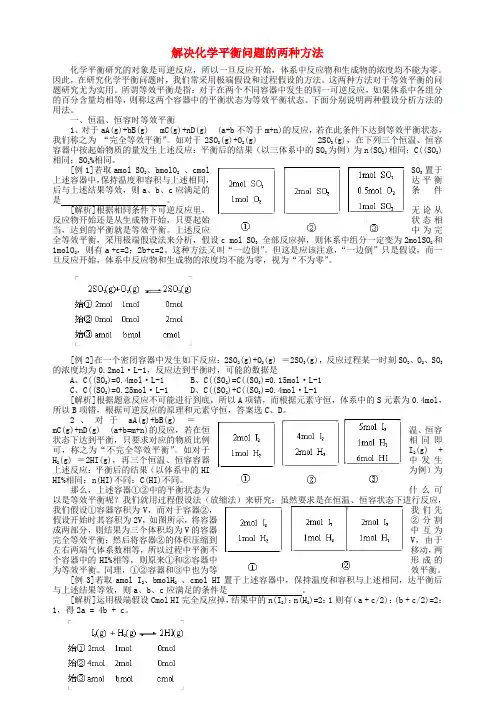
一、恒温、恒容时等效平衡1、对于aA(g)+bB(g)mC(g)+nD(g) (a+b不等于m+n)的反应,若在此条件下达到等效平衡状态,我们称之为“完全等效平衡”。
如对于2SO2(g)+O2(g) 2SO3(g),在下列三个恒温、恒容容器中按起始物质的量发生上述反应:平衡后的结果(以三体系中的SO2为例)为n(SO2)相同;C((SO2)相同;SO2%相同。
[例1]若取amol SO2、bmolO2、cmol SO3置于上述容器中,保持温度和容积与上述相同,达平衡后与上述结果等效,则a、b、c应满足的条件是。
[解析]根据相同条件下可逆反应里,无论从反应物开始还是从生成物开始,只要起始状态相当,达到的平衡就是等效平衡。
上述反应中为完全等效平衡,采用极端假设法来分析,假设c mol SO3全部反应掉,则体系中组分一定变为2molSO2和1molO2,则有a +c=2;2b+c=2。
这种方法又叫“一边倒”。
但这是应该注意,“一边倒”只是假设,而一旦反应开始,体系中反应物和生成物的浓度均不能为零,视为“不为零”。
[例2]在一个密闭容器中发生如下反应:2SO2(g)+O2(g) =2SO3(g),反应过程某一时刻SO2、O2、SO3的浓度均为0.2mol·L-1,反应达到平衡时,可能的数据是A、C((SO2)=0.4mol·L-1B、C((SO2)=C((SO3)=0.15mol·L-1C、C((SO2)=0.25mol·L-1D、C((SO2)+C((SO3)=0.4mol·L-1[解析]根据题意反应不可能进行到底,所以A项错,而根据元素守恒,体系中的S元素为0.4mol,所以B项错,根据可逆反应的原理和元素守恒,答案选C、D。


化学反应的平衡与气体压强化学反应是物质之间发生变化的过程,其中平衡态是指反应物与生成物浓度保持一定比例,而不再发生净变化的状态。
在平衡态下,化学反应会受到许多因素的影响,包括温度、压力、浓度等。
本文将重点讨论化学反应平衡与气体压强之间的关系。
一、Le Chatelier定律Le Chatelier定律是描述化学平衡状态下对外界扰动的敏感性,并指出系统将会偏离平衡态以抵消外界动力的影响。
其中对气体压强的影响是经常被研究的一方面。
二、气体反应中的平衡常数在所有化学反应中,气体反应具有特殊的特点。
根据气体的状态方程,PV=nRT,我们可以得知在一定温度和体积下,气体的压强与气体摩尔数量成正比。
因此,在气体反应中,气体的压强变化将直接影响反应的平衡状态。
三、气体的摩尔比与气体压强根据化学动力学理论,气体反应的速率与各反应物的摩尔比成正比。
因此,在反应物数量固定的情况下,压强的变化将直接影响气体反应的速率。
当压强增加时,系统将倾向于向压力较小的方向移动,以抵消外界的扰动。
反之,当压强减小时,系统将倾向于向压力较大的方向移动。
四、气体反应中的平衡常数与压力根据Le Chatelier定律,由于压力的变化会对反应的平衡态产生影响,气体反应的平衡常数也会随之变化。
根据平衡常数的定义,K = [C]c[D]d / [A]a[B]b,其中A、B为反应物,C、D为生成物,a、b、c、d为对应的摩尔系数。
当系统压力增加时,平衡常数K会增大,以抵消扰动。
而当系统压力减小时,K会减小。
五、应用实例1. 气体的溶解度与压强在溶液中溶解的气体分子数量与气体的压强成正比。
当压强增加时,气体溶解度也会随之增加。
这一规律广泛应用于饮料及其他碳酸饮品的制作过程中。
2. Haber过程Haber过程是用来合成氨气的重要工业过程。
该过程中,反应物氮气和氢气在高温高压下反应生成氨气。
通过调节压力可以控制反应的平衡态以及产物氨气的生成率。
3. 燃料电池燃料电池是利用化学反应将化学能转化为电能的装置。

化学平衡的浓度温度压力对平衡常数的影响化学平衡的浓度、温度和压力对平衡常数的影响化学平衡是指反应物和生成物之间的转化速率达到动态平衡的状态。
在平衡状态下,反应物和生成物的浓度保持不变。
平衡常数是描述平衡系统中反应物和生成物浓度之间关系的一个指标。
浓度、温度和压力是影响化学平衡的重要因素,它们对平衡常数产生不同的影响。
一、浓度对平衡常数的影响浓度是指单位体积溶液中溶质的物质量。
根据平衡常数的定义,它表示了平衡体系中反应物和生成物的浓度比例。
当浓度发生变化时,平衡常数也会改变。
1. 浓度增加对平衡常数的影响当某一物质的浓度增加时,根据Le Chatelier原理,系统会尝试减少这种浓度差。
对于该反应物的反应,可以通过向生成物的方向转移来达到新的平衡状态。
由于平衡系统达到新的平衡位置,平衡常数也会发生变化。
2. 浓度减少对平衡常数的影响当某一物质的浓度减少时,系统会尝试增加这种浓度差,以达到新的平衡状态。
与浓度增加相反,该反应将向反应物的方向转移来达到新的平衡。
同样地,平衡常数也会发生变化。
总的来说,浓度的增加或减少对平衡系统都会产生影响,改变平衡常数的数值。
二、温度对平衡常数的影响温度是影响化学反应速率和平衡常数的重要因素之一。
根据热力学原理,温度的变化会引起反应热的变化,从而对平衡常数产生影响。
1. 温度升高对平衡常数的影响当温度升高时,平衡反应向吸热方向移动,以吸收多余的外界热量。
对于放热反应的平衡反应,升高温度会导致平衡常数减小。
2. 温度降低对平衡常数的影响当温度降低时,平衡反应向放热方向移动,以释放多余的内部热量。
对于吸热反应的平衡反应,降低温度会导致平衡常数增大。
综上所述,温度的变化会使平衡反应向放热或吸热方向移动,从而改变平衡常数的数值。
三、压力对平衡常数的影响压力是气体反应体系中的关键参数,对平衡常数产生重要影响。
根据气体反应的特性,压力的变化将引起平衡体系的变化。
1. 压力增加对平衡常数的影响当压力增加时,平衡反应将向压力较小的方向移动,以减小压力差。


浓度、温度、压强对化学平衡的影响解析高中对化学反应条件对化学平衡的影响一般介绍浓度、温度、压强三种条件,归纳起来就是勒.夏特列原理:如果改变平衡系统的条件(如浓度、温度、压强)之一,平衡将向减弱这个改变的方向移动。
[1]其中浓度学生最容易掌握;温度也只是在与化学反应速率同时出现时,学生容易因平衡移动的原因而出现无法正确判断化学反应速率,问题也不大;在保持温度不变的条件,对于压强对化学平衡移动的影响,由于增大压强可以是压缩体积,也可以是充入某种惰性气体(通常没有说明增大压强是指通过压缩体积),学生对于前者基本可以解决。
但对于后者往往无法理解而经常出错。
这是因为学生还没有从本质上理解压强对平衡移动的影响。
对于一个可逆反应aA(g)+ bB = cC(g)+ dD (g)平衡常数可定量描述为:Kc=([C]c*[D]d)/([A]a*[B]b)[2] (1)([A]、[B]、[C]、[D]为A、B、C、D平衡时的物质的量浓度)或Kp=(pc(C)*pd(D))/(pa(A)*pb(B))[3] (2)(p(A)、p(B)、p(C)、p(D)为A、B、C、D平衡时的分压强)因此,增大压强对平衡移动的影响,本质上就看它是否对反应体系的各物质的浓度或分压强产生影响,如何影响。
如果不影响,当然平稳就不移动;如果使Qc<Kc、Qp<Kp,平衡则向正反应方向移动,否则就相反。
应用这个原理就可以分别从物质的压强、浓度和体积这三个不同的角度对压强对平衡移动的影响作出正确的解答。
一、压强:增大压强,平衡向气态物质系数减少的方向移动;减少压强,平衡向气态物质系数增大的方向移动。
其原理为:增大或减少压强的过程中对反应中的任一气体效果相同,分压强增大或减少相同的倍数,设增大或减少压强是任一气体的分压强变为原来的n倍,那么根据(2)式可得:Qp=Kp*n(c+d-a-b)所以有:(1)当n<1, c+d-a-b>0时,气体分压强减少,Qp<Kp,平衡向正反应方向,即气体体积系数增大的方向移动。


《恒温恒容、恒温恒压条件下的化学平衡》教学案[考纲要求]1.了解化学反应的可逆性。
2.了解化学平衡建立的过程。
理解化学平衡常数的含义,能够利用化学平衡常数进行简单的计算。
2.理解外界条件(浓度,温度,压强,催化剂等)对反应速率和化学平衡的影响,认识其一般规律。
一.课前思考:1-1、在恒温时,一固定容积的密闭容器内发生如下反应:2NO 2(气)N2O4(气)达到平衡时,再向容器内通入一定量NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的浓度:A 不变B 增大C 减小D 无法判断1-2、在恒温时,一固定容积的密闭容器内发生如下反应:2NO 2(气)N2O4(气)达到平衡时,再向容器内通入一定量NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数:A 不变B 增大C 减小D 无法判断1-3、在恒温时,一容积可变的密闭容器内发生如下反应:2NO 2(气)N2O4(气)达到平衡时,再向容器内通入一定量NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的质量百分含量:A 不变B 增大C 减小D 无法判断1-4、一定条件下:2SO2(g)+ O2(g)2SO3(g),△H= —akJ/mol(1) 若在甲、乙两个容积相等的容器中,分别充入甲:2molSO2、1molO2;乙:1molSO2、0.5molO2;在上述条件下充分反应,并保持容积不变,当达到平衡后,试比较:①甲、乙两个容器中放出的热量与a的关系;②甲、乙两个容器中SO2的转化率的大小关系;③甲、乙两个容器中平衡常数的大小关系;(2)若在甲、乙两个容积相等的容积中,分别充入:甲:2molSO2、1molO2;乙:1molSO2、0.5molO2;在上述条件下充分反应,并保持压强不变,当达到平衡后,试比较:①甲、乙两个容器中放出的热量与a的关系;②甲、乙两个容器中SO2的转化率的大小关系;③甲、乙两个容器中平衡常数的大小关系;二、思考与归纳:(1)可逆反应的本质特征是什么?(2)什么是转化率?平衡正向移动则转化率一定升高吗?(3)平衡常数的含义是什么?影响平衡常数的因素有哪些?平衡移动则平衡常数一定会改变吗?(4)上述哪些情况是等效平衡?等效平衡的特征是什么?等效平衡有几种类型?三.应用提升:2-1、某温度下,在一容积可变的密闭容器中,反应2A (g)+B(g)2C(g)达到平衡时,A、B和C的物质的量分别为4moL 、2moL和4moL。

化学平衡恒温恒容与恒温恒压浓度下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you! In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!化学平衡的概念与特征化学平衡是化学反应达到动态平衡状态时的特征。

浓度平衡常数和压强平衡常数的关系浓度平衡常数和压强平衡常数的关系引言浓度平衡常数和压强平衡常数是化学平衡反应中常用的量化指标。
它们可以帮助我们理解平衡反应的方向和平衡位置。
本文将简要介绍浓度平衡常数和压强平衡常数的概念,并探讨它们之间的关系。
浓度平衡常数浓度平衡常数是指在化学平衡反应中,反应物和生成物的浓度之比的乘积,每个物质的浓度的幂次等于该物质的系数。
以一般的平衡反应为例,其浓度平衡常数可以表示为:Kc = [C]c[D]d/[A]a[B]b其中,A、B为反应物,C、D为生成物,a、b、c、d为各个物质的系数,方括号表示浓度。
压强平衡常数压强平衡常数是指在化学平衡反应中,反应物和生成物的分压之比的乘积。
以气相反应为例,其压强平衡常数可以表示为:Kp = (pC^c * pD d)/(pA a * pB^b)其中,pA、pB为反应物的分压,pC、pD为生成物的分压。
浓度平衡常数和压强平衡常数的关系浓度平衡常数和压强平衡常数之间存在一定的关系,特别是在气相反应中。
根据理想气体状态方程,可以将浓度与分压进行转换:p = cRT其中,p为分压,c为浓度,R为气体常数,T为温度。
将上式代入Kc和Kp的定义中,可以得到以下关系:Kp = Kc * (RT)^(Δn)其中,Δn为生成物摩尔数减去反应物摩尔数之差。
解释说明浓度平衡常数和压强平衡常数是反映化学平衡的性质和趋势的重要指标。
通过测定它们的数值,可以推断反应在不同浓度或分压下的平衡位置。
同时,浓度平衡常数和压强平衡常数之间的关系也揭示了温度、摩尔数差异对平衡常数的影响。
当温度一定时,Kc和Kp之间的关系是通过理想气体状态方程推导出来的,它表明了浓度和分压之间的等价关系。
具体而言,在摩尔数差异确定的情况下,浓度的变化和分压的变化是相互关联的,它们的比例因子由理想气体状态方程中的温度和气体常数决定。
总之,浓度平衡常数和压强平衡常数是化学反应平衡的量化指标,它们之间存在一定的关系。
化学平衡移动浓度压强矛盾化学平衡是指在闭合系统中,反应物和生成物的浓度或压强达到一定的稳定状态,反应速率之间达到动态平衡的状态。
在化学平衡中,浓度和压强之间存在着一定的矛盾关系。
本文将从浓度和压强两个方面探讨化学平衡中的这种矛盾关系。
我们来看化学平衡中浓度的矛盾。
在化学反应中,反应物的浓度越高,反应速率也会越快。
这是因为反应物浓度的增加会增加反应物分子之间的碰撞频率,从而增加反应速率。
然而,在化学平衡中,当反应物浓度增加时,反应速率也会相应增加,使得反应体系往生成物的方向移动,从而减少反应物的浓度,使得反应体系恢复到原来的平衡状态。
反之,当反应物浓度减少时,反应速率也会减小,使得反应体系往反应物的方向移动,增加反应物的浓度,使得反应体系恢复到平衡状态。
因此,化学平衡中浓度的增加会导致反应体系向生成物方向移动,而浓度的减少会导致反应体系向反应物方向移动,这就是浓度和化学平衡之间的矛盾关系。
接下来,让我们来看化学平衡中压强的矛盾。
在气相反应中,反应物的压强越高,反应速率也会越快。
这是因为压强的增加会增加反应物分子之间的碰撞频率,从而增加反应速率。
然而,在化学平衡中,当反应物的压强增加时,反应速率也会相应增加,使得反应体系往生成物的方向移动,从而减小反应物的压强,使得反应体系恢复到平衡状态。
反之,当反应物的压强减小时,反应速率也会减小,使得反应体系往反应物的方向移动,增加反应物的压强,使得反应体系恢复到平衡状态。
因此,化学平衡中压强的增加会导致反应体系向生成物方向移动,而压强的减小会导致反应体系向反应物方向移动,这就是压强和化学平衡之间的矛盾关系。
总结起来,化学平衡中的浓度和压强存在着一定的矛盾关系。
增加浓度或压强会增加反应速率,使得反应体系向生成物方向移动,而减小浓度或压强会减小反应速率,使得反应体系向反应物方向移动。
这种矛盾关系使得化学平衡能够保持稳定,达到动态平衡的状态。
需要注意的是,虽然浓度和压强对化学平衡有一定的影响,但并不是唯一决定化学平衡的因素。
化学平衡压强浓度冲突化学平衡压强浓度冲突,这个话题听起来像是在跟你讲一出复杂的化学戏剧,但其实它就像是生活中的小插曲,挺有趣的。
想象一下,在一个小小的实验室里,各种化学反应就像是一场热闹的聚会。
每个分子都在忙着展示自己,争先恐后,试图把自己的一份子搞成大事件。
可别小看了这些分子,个个都是“演员”,还各有千秋。
它们在不同的浓度和压强下就像是在不同的环境中,放飞自我的感觉,有的开派对,有的却闷在角落。
说到浓度和压强,这两者就像是一对欢喜冤家,时常为了一点小事争吵不休。
浓度就像是聚会的人数,越多越热闹,而压强则是场地的大小,空间不够可就得上演“挤眉弄眼”的好戏了。
大家都知道,反应物浓度越高,反应就越快,这就好比是派对上人多,话题热烈,气氛火爆。
但与此同时,压强也在捣乱。
想象一下,聚会的人太多,空气都变得紧绷了,这可不是什么好兆头。
浓度和压强的冲突就像是你一边想点燃激情,一边又得考虑场地的承受能力。
平衡这个词可不简单,它就像是一道难解的数学题。
化学反应达到平衡的时候,反应物和生成物的浓度就会稳定下来。
就像聚会结束后,大家都回家了,剩下的只是那一片狼藉。
不过,在这个平衡点,浓度和压强的冲突可不是个简单的事情。
想想,如果你一边在加酒,一边又不想让气氛太火热,那绝对是个挑战。
这里就要提到勒夏特列原理了,听起来有点高深,但其实它就告诉我们,系统总是想要保持平衡,一旦有什么变化,它就会采取措施来反击。
想象一下,聚会中如果有人突然想要减少浓度,那可能是因为觉得大家都喝多了。
这时候,反应就会向产生更多的物质移动,就像是人们又开始往聚会上涌来,重新点燃气氛。
可是,压强一加大,情况就变了。
就像你把派对办在一个小房间,大家都得蜷缩着,没办法尽情欢笑。
反应物和生成物的浓度也因此受到影响,反应就可能停滞不前。
这时候,你就得灵活应对,想办法让气氛变得轻松。
让我们再深入一点。
比如,设想一个盛夏的下午,你和朋友们在户外聚会,阳光明媚,可是闷热的天气让人有些不适。
化学平衡的浓度与压力变化规律化学平衡是指在封闭系统中,化学反应的正向和逆向反应达到平衡状态的过程。
在平衡状态下,反应物和生成物的浓度以及气体的压强将达到一定的数值,并且在给定条件下保持不变。
本文将探讨化学平衡中浓度和压力变化的规律。
1. 浓度与平衡常数的关系化学平衡反应的浓度与平衡常数之间存在着密切的关系。
对于一般的平衡反应:aA + bB ⇌ cC + dD其平衡常数Kc的表达式为:Kc = ([C]^c * [D]^d) / ([A]^a * [B]^b)其中,[A]、[B]、[C]、[D]分别表示反应物A、B和生成物C、D的摩尔浓度。
可以看出,平衡常数Kc与反应物和生成物的浓度的乘积有关,反映了反应物和生成物在平衡时的相对浓度大小。
当平衡常数Kc大于1时,生成物的浓度相对较高;当Kc小于1时,反应物的浓度相对较高。
2. 浓度变化对平衡位置的影响根据利用Le Chatelier原理,浓度的变化可以影响化学平衡的位置。
当向平衡体系中添加或减少某种物质时,平衡体系会发生向反应物或生成物方向移动以抵消这一变化。
具体而言:- 当向平衡体系中添加某种物质时,平衡体系会向反应物方向移动,使得该物质的浓度减小,从而恢复平衡。
- 当从平衡体系中移除某种物质时,平衡体系会向生成物方向移动,使得该物质的浓度增加,以达到新的平衡状态。
3. 压力与平衡位置的关系对于气体反应,平衡位置还受到压力的影响。
根据理想气体状态方程PV = nRT,可以得出压力与气体摩尔浓度的关系。
在一定温度下,气体的压强与其摩尔浓度成正比。
因此,在气体反应中:- 压力增加,平衡体系会向压力减小的方向移动,以减少气体分子的相互碰撞,达到新的平衡。
- 压力减小,平衡体系会向压力增加的方向移动,以增加气体分子的相互碰撞,以恢复平衡。
需要注意的是,以上讨论基于理想气体反应,并且只适用于影响平衡位置的改变。
对于平衡常数Kc值本身的改变,需要通过改变温度来实现。
恒温恒容平衡的标志解读在化学平衡的研究中,恒温恒容条件下的平衡状态具有重要的意义。
理解恒温恒容平衡的标志,对于深入掌握化学平衡的本质和规律至关重要。
首先,我们来明确一下什么是恒温恒容。
恒温,就是指反应体系的温度保持不变;恒容,则是反应容器的体积固定不变。
在这样的条件下,化学反应会达到一种动态平衡的状态。
那么,如何判断一个反应在恒温恒容条件下是否达到了平衡呢?这就需要我们关注一些关键的标志。
化学平衡的本质是正反应速率和逆反应速率相等。
这是判断恒温恒容平衡的最根本标志。
如果在反应过程中,我们能够测量到正反应速率和逆反应速率相等,那么就可以确定反应达到了平衡。
但在实际操作中,直接测量反应速率往往比较困难。
于是,我们可以通过一些间接的方法来判断。
比如,对于某些反应,各物质的浓度不再发生变化,这通常意味着反应达到了平衡。
以一个简单的可逆反应 A + B ⇌ C 为例,如果随着时间的推移,A、B、C 三种物质的浓度不再改变,那么就可以认为反应达到了恒温恒容下的平衡状态。
再比如,对于有气体参与的反应,如果体系中气体的压强不再改变,也能说明反应达到了平衡。
假设在一个恒温恒容的容器中进行反应2A(g) ⇌ B(g),随着反应的进行,气体的总物质的量在不断变化,从而导致压强也在变化。
当压强不再改变时,就表明反应达到了平衡。
另外,气体的密度也是一个重要的判断标志。
对于全是气体的反应,如果反应前后气体的质量不变,容器体积也不变,那么气体的密度始终是恒定的。
但如果反应前后气体的质量发生了变化,或者气体的物质的量发生了变化(从而导致体积发生变化),当气体的密度不再改变时,就可以判断反应达到了平衡。
对于有颜色变化的反应体系,颜色不再改变也能作为平衡的标志。
例如,在二氧化氮和四氧化二氮的相互转化反应中,二氧化氮是红棕色气体,四氧化二氮是无色气体。
当体系的颜色不再发生变化时,说明二氧化氮和四氧化二氮的浓度不再改变,反应达到了平衡。
当压强和浓度对平衡影响不一致时请读此文化学平衡知识是中学化学教学中的一个难点,学生在运用勒沙特列原理判断化学反应进程和判断平衡移动方向时,经常会碰到与勒沙特列原理有矛盾的问题,特别是浓度对化学平衡移动影响,其判断更是感到束手无策。
下面举2个比较常见的例子。
问题1. t℃,在1L密闭容器中加入1molPCl5后,反应:PCl5(g) PCl3(g) + Cl2(g),达到平衡,当向平衡体系中再加入1molPCl5反应物时。
对该化学平衡的移动有两种解释:(1)由勒沙特列原理知,增加反应物浓度,平衡向正方向移动。
所以,增加PCl5浓度,平衡必然向正方向移动;(2)由勒沙特列原理知,增加压强,平衡向体积缩小方向移动。
所以,增加反应物PCl5浓度,相当于增加体系的压强,压强增加,平衡向体积减小的方向移动,即,平衡向逆方向移动。
问题2. 25℃时,向0.1mol•L-1的HAc溶液中加入HAc,使溶液浓度达到0.2mol•L-1。
对该化学平衡的移动有两种解释:(1)由勒沙特列原理知,增加反应物浓度,平衡向正方向移动。
即,增加HAc浓度,平衡应该向电离方向移动,醋酸的电离度增加;(2)由电离度知,25℃时,0.1mol•L-1的HAc 的电离度为1.32%,0.2mol•L-1 HAc 的电离度为0.948%,可见,增加反应物浓度,醋酸的电离度减小,平衡向逆方向移动。
显然,上述2个问题中,每题都有2个完全相反的回答,肯定只能有一个答案是正确的。
那么,为什么用勒沙特列原理解释同一问题时会产生截然不同而且自相矛盾的答案呢?下面就此进行讨论。
1 勒沙特列原理的应用条件上述问题中之所以出现两种截然不同的答案,是由于在使用勒沙特列原理时忽略了勒沙特列原理的使用条件。
勒沙特列原理是这样表述的:如果改变影响平衡的一个条件(如浓度、温度、压力等)时,平衡就能向减弱这种改变的方向移动。
可见,在使用勒沙特列原理判断平衡移动方向时,只能“单一因素”发生改变。
化学平衡之恒温恒容(压强与浓度的冲突)在恒温、恒容的条件下,对于可逆反应2NO2=N2O4达平衡后,再充入N2O4,NO2的转化率变大恒温恒容的密闭容器中,N2O4=2NO2,现在充入一定量的NO2,重新达到平衡后,与第一次平衡相比NO2的体积分数减小不耐烦的去看最后前面都在扯。
、在恒温、恒容的条件下,对于可逆反应2NO2=N2O4达平衡后,再充入N2O4,NO2的转化率变大恒温恒容的密闭容器中,N2O4=2NO2,现在充入一定量的NO2,重新达到平衡后,与第一次平衡相比NO2的体积分数减小这个问题是一个非常非常典型的问题每一届都有很多人对这个问题感到困惑然后我当初高二的时候其实也被这个等效平衡之恒温恒容困扰了好久现在高三回过头来看终于把它弄懂了再说这个问题之前先让我扯扯当初的一件超有缘分的事当初寒假在讨论这个问题的时候非常巧非常有缘分在同一时间都在高中化学吧两个互不相识的人问了完全相同的问题主要是完全相同!我还记得当初等大神回复的时候一刷新我们两个人的帖子就正好完美的靠在了一起我出于好奇点开了看了下然后就被惊呆了完美吻合啊!一模一样啊!缘分啊!然后我们寒假花了一两天时间一起把这个问题搞懂了如果不是这么有缘分如果不是这么巧或许这个问题高考完我都不会去想把它搞懂。
下面简要叙述一下当时的讨论过程看不耐烦的直接跳后面的结论总结就OK了然后大神们看看笑笑就可以了先举个例子这个例子很典型的哦当初写的快字丑了点然后条件没说的时候都是恒温恒容平衡后之后的情况这个时候用勒夏特列原理分析就成了增大生成物浓度平衡。
增大压强平衡。
这就矛盾了哇是不是感觉很难理解了然后再看看最前面说的那两个超经典的问题在恒温、恒容的条件下,对于可逆反应2NO2=N2O4达平衡后,再充入N2O4,NO2的转化率变大恒温恒容的密闭容器中,N2O4=2NO2,现在充入一定量的NO2,重新达到平衡后,与第一次平衡相比NO2的体积分数减小再去用之前老师教的思路去理解是不是觉得我两句话都是错的是不是感觉第一问是变小第二问是增大啊。
勿喷诶。
这两句话都是对的诶。
下面说下对这两句话的解释事实上是因为对勒夏特列原理的定义理解的不到位很多人连化学书都没这么看过吧(都是直接用辅导书的吧像考点同步解读。
不过考点同步解读的确是一本超赞的辅导书我很多内容都是用它自学的。
)更不要说是记住勒夏特列原理的定义事实上勒夏特列原理是一个只适用于单一变量的原理嗯是的这个原理是只适用于单一变量的改变引起的平衡移动的分析所以当有两个影响平衡的因素同时改变的时候特别是它们二者之间有冲突的时候勒夏特列原理就不再适用了这就是引起我们对这个问题感到困惑不解的根本原因而且当我们对这个问题困惑不解的时候,有一些老师也解释不了了所以很多老师就让我们去用“压容器”去理解(“压容器”应该明白我的意思哇就是抽开中间的隔板把两个等效的罐子摁成一个罐子然后自然而然的成了增大压强了)好像忘记要说什么了下次再补吧好了综上所述核心就是勒夏特列原理是一个只适用于单一变量的原理嗯是的这个原理是只适用于单一变量的改变引起的平衡移动的分析这就是引起我们对这个问题感到困惑不解的根本原因最后说下结论当勒夏特列原理不再适用的时候我们就必须有真正核心 Qc与K去理解——这个是王道嗯是的 K才是这类问题的核心王道所以不要嫌它很麻烦特别是在一些很难用理论知识去理解的问题,用K去计算才是王道。
例如最早说的那个合成氨反应恒容平衡再充氨气这个时候显然Qc大于K(分子大了)所以显然平衡向逆向所以n和c反应物均增大然后因为是只削弱不抵消(请类比楞次定律 ps:无论是楞次定律还是勒夏特列原理本源上还是能量守恒的必然结果)。
或者去类比那个自感电流永远不会超过原电流。
所以 n和c生成物也增大‘上述是第一类情况还是很好理解滴接下来说下最后一类情况也是比较难理解的情况第二类情况第二类情况转化率与百分含量(如体积分数)这个时候其实无论是氢气还是氮气它们的转化率都是增大的自然体积分数就是减小了这种情况好像用勒夏特列原理理解有点困难真的有种对着干的感觉。
有木有。
增大压强平衡XXX 增大生成物浓度平衡XXX 综上平衡XXX首先我们要区分好第一类和第二类情况千万千万不要弄混了!!!然后第一类情况是非常好理解滴其次第二类情况(转化率与百分含量(如体积分数))在高中阶段是不太好解释的我们就把它第二类情况当作是等效于增大压强用“压容器”的方法去理解它就行了。
(注意是当作)以那个合成氨的为例嗯恒容是吧增大压强了哇平衡显然“右移”了哇平衡“右移”会怎么样?显然氢气氮气转化率增大体积分数减小哇 OK (ps:刚刚说了的你再充氨气显然分子大了Qc>K 所以显然左移。
)就是说第二类情况按增大压强导致的平衡右移导致的情况就好平衡右移会怎么样第二类情况就会怎么样!好像又忘记要说什么了。
下次再补吧。
好了这样这个问题就应该算是解决了吧希望不要再困扰大家了在恒温、恒容的条件下,对于可逆反应2NO2=N2O4达平衡后,再充入N2O4,NO2的转化率变大恒温恒容的密闭容器中,N2O4=2NO2,现在充入一定量的NO2,重新达到平衡后,与第一次平衡相比NO2的体积分数减小现在再回过头来看看这个两个东西第一个:第一步:第一类还是第二类(这个要区分好嘞千万不要弄混了!)备注:第一类情况用情况1分析(易)第二类用2分析属于第二类情况是吧(难怪这么难理解。
你看第一类多容易。
)第二步:根据情况2 “等效”成增大压强你增大压强的时候转化率是增大还是减小?显然增大哇。
所以这个情况就是增大嘛。
ok第二个:第一步:1还是2? 2哇第二步:根据情况2 “等效”成增大压强你增大压强的时候体积分数是增大还是减小?显然减小哇。
所以这个情况就是减小嘛。
ok换个例题在一个不导热的密闭反应器中,只发生两个可逆反应:a(g)+b(g)=2c(g) △H1<0;x(g)+3y(g)=2z (g)△H2>0进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述错误的是(A)A.等压时,通入惰性气体,c的物质的量不变B.等压时,通入z气体,反应器中温度升高C.等容时,通入惰性气体,各反应速率不变D.等容时,通入z气体,y的物质的量浓度增大D哪对了是吧?你不是等效成增大压强啊?平衡不是正向移动啊?y的C不是减小啊?呸这是第一类情况分子变大 Qc>K 显然平衡逆向移动 y的n和c都显然增大 ok上述就是99%的情况了这种题目99%都能对了(我只做错了一题)来我们“随便”再找个例题现在看这题是不是选bcefh?是不是感觉很容易?但是。
这题不是我随便找的。
这题就是我做错的那题。
这题选bfh 太诡异了看完答案的解析笑哭我了这就是我要说的第三类情况工业生产中的实际应用问题(这种题目的理解要用Common sense)先说c 题目上说了恒容。
压个毛线的体积啊。
但是!题目要是只说是增大压强那就对了增大压强有两种情况一种是压缩容器另一种是按照原来的投料比再加一次(反应物生成物均等倍数增加)充入一种气体也能导致压强增大哪怕是充入氩气如果只是充任意一种气体导致的增大压强应该会特别注明是哪种气体就像恒容充入氩气这种情况题目就会说恒容时充入X气体如果题目上说增大压强,意思就是说要么是压缩容器要不然就是按照原来的投料比再加一次(反应物生成物均等倍数增加)如果题目刻意说了是压缩体积加压的话那就是第一种情况压缩体积加压就不能选了但是如果他说是增大压强这就可以选了因为既然压缩不了,但它可以按投料比再充一次(反应物生成物均等倍数增加)然后单独充某种气体导致的压强增大,它一定会注明是哪个气体,如果只是说增大压强,就不要去考虑这种情况有点绕。
那一大段话是当初讨论这题的时候我说的。
纯粹只是复制黏贴了下。
再借鉴一下大神说的话:我们默认这里的“压强增大”是“反应物和生成物的浓度成相同倍数增加”的意思。
某些情况下压强增大的确就是反应物和生成物的浓度成相同倍数增加,比如说减小反应容器的体积;但另外一些情况下压强增大和反应物和生成物的浓度成相同倍数增加并不是相同的概念,例如恒容并充入惰性气体(反应物和生成物的浓度不变),或者恒容并加入一种反应物或生成物(只有一种物质的浓度变化,其余物质浓度不变)。
在这些情况下,“压强升高(降低),平衡向压强降低(升高)的方向移动”并不成立。
所以,“压强升高(降低),平衡向压强降低(升高)的方向移动”这条规律并不是错误的规律,但是只适用于浓度成相同倍数增加的情况,比如按照平衡浓度比向恒容反应体系中加入反应物和生成物,或者压缩反应体系。
压强升高(降低)的倍数其实是反应物和生成物浓度升高(降低)的倍数。
所以C错就是了再说e 这个e特别有意思。
如果这个题目变成了xyz怎么地怎么地然后e就是对了的。
但是注意第三类情况的名字。
工业生产中的实际应用。
这个还要用上common sense滴。
你用常识去想想。
你实际上可能按e这样做吗? e那不是坑爹嘛。
至今为止我做过的所有这类题目里面都没有超出这三种情况。
如果有题目不符合这三种情况大家可以把题目发给我再讨论下至此希望我说的话能够让大家不要再困惑这个问题了最后的话首先这些是我一个字一个字手打出来的可能会打错字而且我学渣可能说的这些东西就已经漏洞百出了所以大神们看看笑笑就好了然后由于时间原因只是把当初讨论的东西粗略的筛选了一遍复制黏贴过来的所以很多地方可能都有不当的地方例如重复啰嗦例如语气语调不恰当什么的大家见谅最后面总结就是自己刚刚打上去的不耐烦的直接看最后面就好了然后就是我好像忘记说什么了。
又感觉应该没有了。
反正现在是想不起来了。
到时候再补吧。
完结。