(一) 镁、铝复习教案
- 格式:doc
- 大小:69.50 KB
- 文档页数:2

铝、镁及其重要化合物最新考纲 1.掌握铝、镁及其重要化合物的主要性质及其应用。
2.了解铝、镁及其重要化合物的制备方法。
考点一 铝、镁的性质及应用1.铝的结构和存在铝位于元素周期表第3周期ⅢA 族,原子结构示意图为。
铝是地壳中含量最多的金属元素。
自然界中的铝全部以化合态的形式存在。
2.金属铝的物理性质银白色有金属光泽的固体,有良好的延展性、导电性和导热性等,密度较小,质地柔软。
3.金属铝的化学性质写出图中有关反应的化学方程式或离子方程式:①________________________________________________________________________。
②________________________________________________________________________。
③________________________________________________________________________。
④________________________________________________________________________。
答案 ①4Al +3O 2=====△2Al 2O 3②2Al +Fe 2O 3=====高温2Fe +Al 2O 3③2Al +6H +===2Al 3++3H 2↑④2Al +2OH -+6H 2O===2[Al(OH)4]-+3H 2↑5.铝的用途纯铝用作导线,铝合金用于制造汽车、飞机、生活用品等。
6.(1)铝在自然界中有游离态和化合态两种形式()(2)MgO与Al粉的混合物也可称为铝热剂()(3)冶炼铝时常用焦炭做还原剂()(4)铝与少量NaOH溶液反应得到铝盐,与足量NaOH溶液反应生成偏铝酸盐()(5)相同质量的镁条分别在足量的CO2和O2中完全燃烧,所得固体的质量相同()(6)工业上制造镁粉时,可将镁蒸气在N2中冷却()答案(1)×(2)×(3)×(4)×(5)×(6)×1.依据Al单质的性质,思考回答下列问题:(1)铝的化学性质活泼,为什么日常生活中广泛使用的铝制品通常具有较强的抗腐蚀性能?(2)Al既能溶于强酸,又能溶于强碱,有人说“Al既有金属性,又有非金属性”,你认为这种说法是否恰当?为什么?(3)铝与氢氧化钠溶液反应时,反应机理是怎样的?请用双线桥法标出该反应电子转移的方向与数目。


第2讲镁、铝及其重要化合物复习目标知识建构1.结合真实情景中的应用实例或通过实验探究,了解镁、铝及其重要化合物的主要性质,了解其在生产、生活中的应用。
2.结合实例认识金属性质的多样性,了解通过化学反应可以探索物质性质、实现物质的转化,认识物质及其转化在自然资源综合利用和环境保护中的重要作用。
一、镁、铝1.原子结构和存在(1)原子结构:镁、铝原子结构示意图分别为和,分别位于元素周期表的第三周期ⅡA族和ⅢA族。
(2)存在:在自然界中均以化合态的形式存在,铝是地壳中含量最多的金属元素。
2.单质的物理性质(1)相同点:均为银白色有金属光泽的固体,有良好的延展性、导电性和导热性等,密度、硬度均较小。
(2)不同点:铝的熔点比镁高,硬度比镁大。
3.单质的化学性质镁铝4.镁、铝的冶炼(1)Mg :化学方程式 MgCl 2(熔融)=====电解Mg +Cl 2↑; (2)Al :化学方程式2Al 2O 3(熔融)=====电解冰晶石4Al +3O 2↑。
【判一判】 判断下列说法是否正确,正确的打“√”,错误的打“×”。
(1)工业上制造镁粉时,可将镁蒸气在N 2中冷却( )(2)相同质量的镁条分别在足量的CO 2和O 2中完全燃烧,所得固体的质量相同( )(3)冶炼铝时常用焦炭作还原剂()(4)铝与少量NaOH溶液反应得到铝盐,与足量NaOH溶液反应生成偏铝酸盐()(5)铝制餐具可长时间存放酸性或碱性食物()(6)镁在空气中燃烧的产物固体只有MgO()答案(1)×(2)×(3)×(4)×(5)×(6)×二、镁、铝的重要化合物1.MgO与Al2O32.Mg(OH)2与Al(OH)33.明矾(1)化学式为KAl(SO4)2·12H2O,它是无色晶体,可溶于水。
(2)明矾净水的原理电离方程式为KAl(SO4)2===K++Al++2SO-4,其中Al3+发生水解反应,产生Al(OH)3胶体,能吸附水中悬浮物形成沉淀,使水澄清。
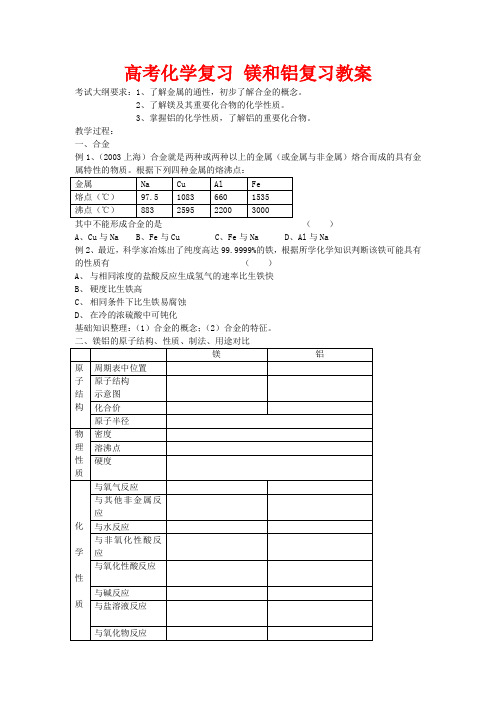
高考化学复习镁和铝复习教案考试大纲要求:1、了解金属的通性,初步了解合金的概念。
2、了解镁及其重要化合物的化学性质。
3、掌握铝的化学性质,了解铝的重要化合物。
教学过程:一、合金例1、(2003上海)合金就是两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。
根据下列四种金属的熔沸点:其中不能形成合金的是()A、Cu与NaB、Fe与CuC、Fe与NaD、Al与Na例2、最近,科学家冶炼出了纯度高达99.9999%的铁,根据所学化学知识判断该铁可能具有的性质有()A、与相同浓度的盐酸反应生成氢气的速率比生铁快B、硬度比生铁高C、相同条件下比生铁易腐蚀D、在冷的浓硫酸中可钝化基础知识整理:(1)合金的概念;(2)合金的特征。
例3、(2004北京东城)将相同质量的镁条分别在①氧气②空气③氮气④二氧化碳中完全燃烧,燃烧后固体的质量由小到大的顺序是()A、②﹤①﹤③﹤④B、④=①=②=③C、③﹤②﹤①﹤④D、③﹤①﹤②﹤④例4、(2005合肥)甲、乙两烧杯中各盛有100mL3mol/L的盐酸和氢氧化钠溶液,向两烧杯中加入等质量的铝粉,反应结束测得生成气体体积比甲/乙=1/2,则加入铝粉的质量为()A、5.4gB、3.6gC、2.7gD、1.8g三、镁和铝的重要化合物1、氧化镁、氧化铝比较2、氢氧化镁、氢氧化铝比较例5、将适量的镁粉与沙子混合,引燃得到一种灰色粉末。
①把该粉末投入水中,可听到有轻微的爆炸声,水中会产生白色沉淀。
②若将此粉末投入浓盐酸中,爆炸声明显增大,且在水面上有火花闪烁。
请用所学的知识解释以上现象。
3、铝三角及其应用写出有关化学应方程式(1)__________________________________________________________(2)__________________________________________________________(3)_________________________________________________________(4)_________________________________________________________(5)_________________________________________________________(6)_________________________________________________________例6、在有固体氢氧化铝存在的饱和溶液中,存在着如下平衡:别加入(1)氢氧化钠溶液,(2)盐酸,(3)已分别用氢氧化钠、硝酸汞溶液处理过的铝条,(4)水。

《镁和铝》教案(第2课时)
(合肥五中生化组周维维)
教学目标
1、知识与技能:镁、铝的化学性质(与非氧化性酸、某些氧化物的反应,铝的钝化,铝与碱反应),铝热反应的有关知识,铝的两性。
引导学生全面观察实验现象和教师的有关操作,培养学生的观察能力。
2、过程与方法:采用对比教学法,将学过的金属钠同镁、铝作横向的对比,使学生从原子结构、典型性质、主要用途等方面强化认识,提高学生的归纳比较能力。
3、情感态度和价值观:向学生介绍有关史料,使学生了解科研过程,既可培养学生的唯物观,又可激发学生爱科学、探索科学的热情。
教学重点
1、镁、铝的化学性质镁和铝的原子核外电子数都较少,易失去电子而表现较强的还原性。
能与氧气、硫、卤素等非金属反应,与非氧化性酸反应,与某些氧化物反应。
镁能在空气和二氧化碳中燃烧,除了说明镁的强还原性外,还表明了二氧化碳不支持燃烧的相对性。
2、铝的特性——铝在常温下遇浓硫酸、浓硝酸会发生钝化。
铝既能与酸反应表现金属性,又能与强碱反应表现非金属性,即表现了铝的两性。
教学难点铝的特性
教学疑点铝与氢氧化钠的反应
教具准备镁和铝金属样品、演示实验所需要的仪器和药品。
学生活动设计对镁、铝化学性质的教学,可在学生阅读、自学教材内容的基础上,将演示实验改为分组学生实验,引导学生认真实验,仔细观察实验现象,积极分析、思考、质疑,然后教师集中进行讲解、答疑、点拨,从而使学生在解决问题的过程中掌握知识,培养能力。
教学过程设计
2Fe+Al2O3 Mg+NaOH。

江苏省口岸中学2012届高三化学一轮复习教案专题四第三单元镁铝(共2课时)第1课时【高考考点】1.掌握镁、铝及其重要化合物的性质和用途2.了解铝热反应及铝的冶炼3.对合金的概念及性质有大致印象【知识要点】一.镁铝的比较【思考1】如何从铝土矿(含Fe2O3、Al2O3、SiO2)中获得纯净的Al2O3?供选用的试剂有:盐酸、CO2、氢氧化钠、氨水.注意每种试剂不能重复使用.二.镁、铝的重要化合物(1)氧化物【思考2】制取Al(OH)3的可能途径有那些?(2)氢氧化物三、合金(1)合金:合金是指两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。
一般来说,合金的性能优于纯金属,合金的熔点比它的各成分金属熔点都低,硬度比它的各成分金属大。
但合金的性质并不是各成分金属性质的总和。
(2)铝合金金属铝中加入其他元素如铜、镁、硅、锌、锂等,即形成各种性能优良的铝合金。
①性质特征铝合金具有密度小、强度高、塑性好、易于成形、制造工艺简单、成本低廉等特点,并且表面易形成致密的氧化物保护膜而具有一定的抗腐蚀能力。
②用途铝合金主要用于建筑业、容器和包装业、交通运输及电子行业,如汽车车轮的骨架,硬盘抽取盒等。
另外,还广泛用于制造飞机构件。
1.(2011广东高考)某同学通过系列实验探究Mg及其化合物的性质,操作正确且能达到目的的是A. 将水加入浓硫酸中得到稀硫酸,置镁片于其中探究讨Mg的活泼性B. 将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成C. 将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀D. 将Mg(OH)2沉淀转入表面皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体2.(2011海南)镁化合物具有广泛用途,请回答有关镁的下列问题:(1)单质镁在空气中燃烧的主要产物是白色的______,还生成少量的____(填化学式);(2)CH3MgCl是一种重要的有机合成剂,其中镁的化合价是______,该化合物水解的化学方程式为________;(3)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。
2023年高二化学教案镁、铝及其化合物(精选3篇)教案一:镁的性质及其化合物教学目标:1. 了解镁的性质和应用。
2. 掌握镁与氧、硫和氯的反应。
3. 熟悉镁的几种常见化合物的命名和性质。
教学过程:1. 引入:通过实验演示和图片展示介绍镁的性质和应用,如镁的轻便性、燃烧性、导电性和腐蚀性等。
2. 镁与氧的反应:- 展示镁与氧反应的实验现象,并解释反应过程。
- 写出反应方程式:2Mg + O2 → 2MgO。
- 引导学生分析反应类型、反应物和生成物。
3. 镁与硫的反应:- 展示镁与硫反应的实验现象,并解释反应过程。
- 写出反应方程式:Mg + S → MgS。
- 引导学生分析反应类型、反应物和生成物。
4. 镁与氯的反应:- 展示镁与氯反应的实验现象,并解释反应过程。
- 写出反应方程式:Mg + Cl2 → MgCl2。
- 引导学生分析反应类型、反应物和生成物。
5. 镁的常见化合物:- 介绍镁的几种常见化合物,如氯化镁、硫酸镁和碳酸镁等。
- 分析这些化合物的性质和应用。
- 让学生完成相关的实验操作或观察,加深对这些化合物的理解。
6. 总结:总结镁的性质和与氧、硫、氯反应的特点,以及常见化合物的命名和性质。
教案二:铝的性质及其化合物教学目标:1. 了解铝的性质和应用。
2. 掌握铝与氧、硫和氯的反应。
3. 熟悉铝的几种常见化合物的命名和性质。
教学过程:1. 引入:通过实验演示和图片展示介绍铝的性质和应用,如铝的轻便性、导电性和耐腐蚀性等。
2. 铝与氧的反应:- 展示铝与氧反应的实验现象,并解释反应过程。
- 写出反应方程式:4Al + 3O2 → 2Al2O3。
- 引导学生分析反应类型、反应物和生成物。
3. 铝与硫的反应:- 展示铝与硫反应的实验现象,并解释反应过程。
- 写出反应方程式:2Al + 3S → Al2S3。
- 引导学生分析反应类型、反应物和生成物。
4. 铝与氯的反应:- 展示铝与氯反应的实验现象,并解释反应过程。
金属及其化合物 镁、铝及其化合物(含答案)课标要求 核心考点五年考情核心素养对接1.结合真实情境中的应用实例或通过实验探究,了解镁、铝及其化合物的主要性质。
2.了解镁、铝及其化合物在生产、生活中的应用。
3.结合实例认识镁、铝及其化合物的多样性。
4.认识镁、铝及其化合物的转化在促进社会文明进步、自然资源综合利用和环境保护中的重要价值镁及其 化合物 2022广东,T12;2021年6月浙江,T15;2021重庆,T6;2021湖南,T6;2020山东,T9;2019全国Ⅰ,T26;2019天津,T2;2019年4月浙江,T31 1.宏观辨识与微观探析:能运用化学方程式、离子方程式描述镁、铝及其化合物的变化;能联系镁、铝的组成和结构解释宏观现象;能根据典型实验现象说明镁、铝及其化合物可能具有的性质,评估所作说明或预测的合理性。
2.证据推理与模型认知:能从镁、铝的提纯工艺流程中提取镁、铝及其化合物的性质,了解镁、铝的用途,建立物质性质与用途之间的联系。
3.科学态度与社会责任:主动关心与镁、铝制备有关的环境保护、资源开发等社会热点问题,形成与社会和谐共处、合理利用资源的观念铝及其 化合物 2023重庆,T2;2023年6月浙江,T4、T20;2023湖南,T7;2023年1月浙江,T7;2022全国甲,T9;2022湖南,T7;2022广东,T6;2022年6月浙江,T8;2021全国乙,T26;2021北京,T7;2021山东,T17;2021广东,T18;2020 北京,T6;2019江苏,T3命题分析预测高考常以选择题的形式考查镁、铝及其化合物的性质、应用、化学方程式的正误判断等;以工艺流程题的形式考查铝的化合物的制备等。
预计2025年高考仍会延续这种考查形式1.镁元素的价类二维图及转化关系2.铝元素的价类二维图及转化关系考点1镁及其化合物1.镁及其重要化合物的物理性质Mg:银白色固体,密度较小、质软、有延展性,是电和热的良导体。
第十一章几种重要的金属
第一节镁和铝
(1)金属的一些共同的物理性;
(2)镁和铝的性质和用途;
(3)合金的概念和特性用途;
(4)镁、铝、Al(OH)3的两性及有关计算;
(6)明矾的净化原理。
一、金属和合金
1.金属
(1)金属的分类;
冶金工业
黑色金属:Fe、Cr、Mn有色金属:除Fe、Cr、Mn以外的金属
按金属密度
轻金属:密度小于4.5g/cm3如:ⅣA族ⅡA族ⅢA族等
重金属:密度大于4.5g/cm3如Fe、Cu、Ag、Pb等
按含量和冶炼难
易常见金属:Fe、Mg、Al等稀有金属:锆、铪等
注:稀有金属不只是从含量一方面决定,因而稀有金属也有可能含量不小。
(2)金属的共性:具有金属光泽(多数为银白色),不透明,容易导电、导热。
有延展性等等,是由金属的结构所决定。
2.合金
(1)定义:两种或两种以上的金属(或金属跟非金属)熔合而成的具有金属特性的物质叫合金。
(2)合金的特性:合金比它的成分金属具有良好的物理的、化学的或机械的等方面的性能;合金有固定的熔点。
一般地说,合金的熔点比其各成分金属的熔点都低。
镁铝可和其它金属和非金属形成合金,其强度和硬度都大于镁铝。
二、镁和铝
1.镁和铝都是银白色金属,具有金属通性。
由于铝原子半径比镁的小,且价电子比镁多,导致铝中金属键比镁单质中金属键强,所以铝的熔、沸点比镁高,硬度也比镁大,导致其金属性Mg>Al。
2.镁和铝同在第3周期,分属ⅡA族和ⅢA族,容易失去价电子形成Mg2+和A13+,在化学反应中都是强还原剂,但还原性镁比铝强。
(1)与O2反应。
常温下与空气中的O2反应生成一层致密的氧化物薄膜,所以镁、铝都有抗腐蚀的性能。
镁、铝都能在空气中燃烧。
镁在空气中燃烧时有三个反应发生:2Mg+O2=2MgO
3Mg+N2=Mg3N2
2Mg+CO2=2MgO+C
(2)与卤素单质、硫等反应。
(3)与酸反应置换出H 2。
其中铝在冷、浓 H 2SO 4,冷、浓硝酸中发生钝化现象。
(4)能将许多金属从其氧化物中还原出来,其中铝热剂发生铝热反应有很强的实用价值。
(5)与H 20反应。
Mg 、A1和冷水都不反应,但在加热条件下与水反应生成氢氧化物和 H20 Mg+2H 20=Mg(OH)2+H 2↑
2A1+6H 20=2A1(OH)3+3H 2↑
其中Al 和H 20的反应就是铝和强碱溶液反应的原因:
2Al +2NaOH + 6H 20 =2NaAl02+3H 2 +4H 20
(还原剂) (氧化剂)
通常,将上面式子简写为:2Al+2NaOH+ 2H 20=2NaAl02+3H 2↑
(6)铝有两性,但此两性不是既显酸性又显碱性,而是既显金属性又显非金属性,从铝与稀酸反应放出H2,说明铝具有金属性,从铝与强碱溶液反应生成含氧酸盐(Al02-的中心原子为 Al ,其它多数含氧酸根离子如SO 42-、N03-、PO 43-等的中心原子均为非金属原子),说明铝显非金属性。
Al 与NaOH 溶液反应表示为
2Al+2NaOH+6H 20=2NaAl02+4H 20+3H 2↑,水是氧化剂,铝是还原剂,铝遇冷的浓硫酸或冷的浓硝酸时会钝化,加热时活化而反应,所以可用铝贮存冷的浓硫酸或浓硝酸。
3.镁、铝的性质的相似性和差异性:
(1)镁铝都是活泼的金属,具有强还原性;
(2)镁只能与酸反应产生H 2,而铝既能与酸又能与强碱溶液反应产生H 2;
(3)镁能与冷的浓硫酸和浓硝酸反应,而铝在冷的浓硫酸或浓硝酸中产生钝化现象。
三、镁和铝的重要化合物
1.氧化物
(1)MgO 和A12O 3,均是白色粉末,质轻、熔点高,是优良的耐火材料。
A12O 3还用于电解法冶炼单质铝。
2Al 2O 3(熔融)吴4Al+3O 2↑
(2)MgO 是碱性氧化物。
Al 2O 3则属两性氧化物,可溶于强碱、强碱,A12O 3+6H ’:2Al 3++3H ,Al 2O 3+2OH 2A1O 2-+H2O
2.氢氧化物
(1)Mg(OH)2是难溶于水的碱,溶解度比 MgCO 3还小。
Al(OH)3,也是难溶于水的白色物质,属于三元弱碱和一元弱酸,可溶于酸和强碱溶液。
3.重要的镁盐和铝盐。
(1)MgCl 2是白色、有苦味、易溶于水、易潮解的晶体,可由光卤石(KCl ·MgC12·6H 20)、海水以及制取食盐剩下的苦卤为原料制取。
M8C12的主要用途是制取金属镁。
海水、苦卤、光卤石 −−−→熟石灰 Mg(OH)2↓−−−−→熔融电解MgCl 2。