C28-A2生物参考区间
- 格式:pdf
- 大小:311.21 KB
- 文档页数:27

中国生物工程杂志China Biotechnology, 2020 ,40(12) =104-107D01:10. 13523/j.c b.2007044体外诊断试剂阳性判断值或参考区间确定要点包雯*(国家药品监督管理局医疗器械技术审评中心北京1_81)我国体外诊断产业正处于蓬勃发展的阶段,积累了一定的技术基础,但尚存在产品设计开发过程不规范等问 题。
如何在符合我国国情的前提下,指导企业科学合理的开展体外诊断试剂的设计和开发成为亟待解决的问题。
这就要求企业不仅应重视临床性能的评价,也需系统而全面地进行分析性能的研究,以综合评价产品的安全有效 性;其中关键的项目之一为定性检测试剂的阳性判断值或定量检测试剂的参考区间。
正确的建立体外诊断试剂的 阳性判断值或参考区间会大幅提高临床评价指标满足验收标准的概率,反之可能对临床试验结果(如灵敏度和特 异性)造成不利影响。
1阳性判断值或参考区间确定的总体要求体外诊断试剂的阳性判断值或参考区间研究是临床前研究的重要组成部分之一。
生产企业应当在主要原材 料和生产工艺经过选择和确认、质量管理体系得到有效控制并且保证产品质量稳定的基础上,制订方案并相应的 开展研究。
试验人员应经过必要的培训,熟悉检测系统的操作程序、样本制备方式和试验方案,严格执行校准和质 量控制方法,定期对设备进行维护和保养。
建议使用多批产品,采用科学合理的试验方法确定产品的阳性判断值 或参考区间。
在对结果进行数据检查后,选择适当的统计方法进行检验或分析,并形成报告。
样本数量需符合统 计学要求。
2阳性判断值或参考区间确定的方案和采用的样本12.1阳性判断值或参考区间的特点阳性判断值或参考区间反映了体外诊断试剂区分受试者目标状态特征(如健康或疾病)的性能,在鉴别良性与 恶性疾病、确定疾病进程、监测治疗效果、判定预后情况、指导临床处置或者影响医疗决策制定等方面具有重要意 义。
阳性判断值或参考区间的正确制定能够充分体现产品的临床表现,如区分正常/异常的能力或诊断准确性。

第二类体外诊断试剂产品注册资料白蛋白测定试剂盒(溴甲酚绿法)参考区间确定资料XXXXXX有限公司一、参考依据依据NCCLS C28-A2 如何确定临床检验的参考区间:批准指南(2000)文件。
该文件是确定定量临床检验项目的参考区间的指南。
二、材料与方法1.标本来源按健康人群要求选择XXXXXXXXX医院健康体检者,收取该医院检验科检测已完成的临床样本。
样本采集/检验时间:XXXX.XX。
对象:在XX地区居住的性别不限、年龄不限的健康人。
健康人的要求:(1)一月内无急性感染史;(2)发育正常,无心血管、肺、肾和肝、胆、胰等器质性疾患;(3)半年内无输血和大手术史;(4)3月内未服用影响凝血功能的药物,2周内无中毒史,未接触毒物及其他有害物质;(5)妇女不在妊娠或哺乳期。
2.使用仪器HITACHI 7020全自动生化仪。
3.检测试剂XXXXXX有限公司生产的白蛋白测定试剂盒(溴甲酚绿法)。
规格:XXmL;批号:XXXXXX;生产日期:XXXXXXXX;有效期XXXXXXXX。
4. 质量控制按照技术要求3.1、3.3~3.6.1、3.7进行产品性能的测定,结果应符合要求。
5. 参考值确定根据项目制定双侧界限或单测界限,采用95%参考区间范围。
6.统计方法应用SPSS20进行数据统计分析。
正态性检验采用Kolmogorov–Smirnov(K-S) 检验。
结果属于正态分布的,用正态分布法计算参考区间范围,其95%参考区间范围分别用下式计算:双侧:SD.1X96单测下限:SD.1+X64-单测上限:SD.1X64结果属于偏态分布的,用百分位法计算参考区间范围,其95%参考区间范围分别用下式计算:双侧:P2.5~P97.5单测下限:P5单侧上限:P95三、试验结果用白蛋白测定试剂盒(溴甲酚绿法)对收集到的标本进行测定,测定结果呈正态分布(见图1)。
95%参考区间用公式求出,得出了本试剂盒测定ALB的参考值范围上下限,见表1。


c28-a2医学实验室参考区间的定义和确定医学实验室参考区间是指在正常人群中,某项生理指标的测量结果在某一范围内的概率分布。
其确定的目的是为了将正常值与异常值区分开来,从而对疾病进行诊断和监测。
下面将详细介绍医学实验室参考区间的定义和确定。
医学实验室参考区间的定义:医学实验室参考区间又称正常范围,是指某项生理指标的测量结果在正常人群中观察到的分布范围。
它由下限和上限所组成,表示了该指标测量结果在正常人群中所占的百分比。
一般使用95%的置信区间来确定参考区间,即该指标测量结果有95%的概率分布在该范围内。
医学实验室参考区间的确定:确定医学实验室参考区间需要考虑多个因素,包括样本来源、样本数量、性别、年龄、种族等。
下面将逐一介绍这些因素的影响。
1.样本来源:医学实验室参考区间的确定需要选择来自正常人群的样本。
这些样本应该是没有明显疾病症状,且无明显影响该指标的因素,如未使用药物、未患有慢性疾病等。
选择样本时需要考虑性别、年龄、种族等因素,以保证参考区间的准确性。
2.样本数量:样本数量是确定参考区间的重要因素之一。
较少的样本数量容易导致偏差,不准确地估计参考区间。
一般来说,样本数量越多,结果越可靠。
根据统计学原理,当样本数量达到一定程度时,参考区间的计算结果将更加可靠。
3.性别、年龄和种族:某些生理指标的参考区间可能会因性别、年龄和种族的不同而有差异。
因此,在确定参考区间时需要对这些因素进行分层分析,以准确划定不同人群的参考区间。
4.统计方法:确定参考区间常用的统计方法有光谱法和非参数法。
光谱法是根据正态分布的假设来估计参考区间,适用于样本数量充足且近似正态分布的情况。
非参数法是基于分位数回归方法来估计参考区间,适用于样本数量较少、分布非正态的情况。
在确定参考区间时,也需要考虑参考区间的可靠性和灵敏度。
参考区间的可靠性指的是该区间的结果在不同实验室、不同设备、不同测量者之间能够重复,能够给出一致的结果。

日立HITACHI 7180糖化血红蛋白测定参考区间验证目的应用CLSIC28-A2 文件对四川迈克试剂在日立HITACHI 7180全自动生化分析仪检测系统中进行参考区间的验证,确定其是否满足临床的要求。
方法运用免疫增强速率比浊法,采用我院门诊健康体检1280例个体标本进行测定,比较参考值和原始参考之间的可比性。
结果仪器测定HbAlc,1280例参考个体中60岁以内,有59例(或5%)的观测值在原始报告的参考限之外,厂商或提供参考区间的实验室报告的95%参考区间可以接受。
60岁以上须建立本实验室的参考区间。
结论我们认为,使用四川迈克试剂在日立HITACHI 7180全自动生化分析仪检测系统中进行检测,其厂家提供的参考区间(3.50±5.85%)在一定范围内可接受,但存在年龄差异,需要建立各年龄组的参考区间。
标签:全自动生化分析仪;参考区间;糖化血红蛋白随着各种全自动生化仪器使用,同一检验项目,采用不同的方法和不同的检验系统进行检验,必须使用适当的方法来进行检验结果的可比性,如果检验结果不可比就必须建立不同仪器、不同方法、不同检测系统的参考区间。
我们依据美国国家临床实验室标准化研究所(CLSI)28-A2 文件的要求[1],对本实验室日立HITACHI 7180全自动生化分析仪检测糖化血红蛋白参考区间进行实验评价,现报道如下。
1 资料与方法1.1一般资料检测组为2013年1月~3月本院健康体检1280名人员,并同时进行肝功能、肾功能、血糖、血脂、血常规测定。
HbAlc用(x±s)表示,参考区间按x±1.96s计算。
男650人、女630人,年龄15~85岁。
1.2仪器与试剂仪器为HITACHI 7180全自动生化分析仪;试剂盒由四川迈克生物有限公司(批号0413021),质控品日本生研(高低值分别为18.5% 4.5%,批号299021),校准品四川迈克(批号0413021),四个浓度值分别为5.0%、8.5%、12.4%、16.5%。

临床实验室如何确定和建立生物参考区间(核准指南――第二版)1内容简介此指南是专为指导临床诊断实验室、诊断仪器试剂制造商和临床检验工作者在定量实验检测中确定参考值和参考区间而制定的。
它包括在临床医学实验室中建立可靠的参考区间所用的方法步骤和推荐程序。
而该推荐程序的主要内容是如何用最简便和最务实的方法去建立一个能保证足够可靠性和实用性的参考区3种方法。
无论你的诊断实验室规模大小,无论你是何种试剂生产商,倘若你想通过一项参考值研究来建立参考区间,你就必须遵循此文献提供的特定的指导方针和程序。
该文献包括了建立足够的和适当的决定参考区间的最低标准。
如果实验室规模太小且缺乏必要的资源去执行这一标准,按照稍后在文件中讨论的该议题程序,那么唯一可接受的替代方法就是,采用相同的或可比较的分析系统,对已经合适地确定的参考区间藉着调用的方法进行参考区间的验证后使用。
本文献从对某些术语定义的解释着手,因为术语对参考值的讨论是极其重要的。
所采用的术语均为国际临床化学家联合会(IFCC)的EPTRV分会提出建议,经过仔细探究后旨在形成更有系统和更明确的理论阐述。
此指南内容包括如何建立参考区间并且叙述了种种要素的特性,诸如用来实验的参考对象的选择程序,考虑分析前和分析中影响因素的重要性,估计有效参考区间的计算方法和要求,参考值的调用等等涉及这一议题的问题均将讨论到。
有关参考区间的描述和应用问题也有涉及,最后有一简单章节谈到如何检测一批重要的但并非主要的参考值话题。
2国际单位的使用(SI单位)虽然国家临床实验标准委员会(NCCLS)通常认可使用国际单位(SI),但这些不能总是与国际理位一致。
分子的)浓度(3分会及●●●●注意:参●样品组的分布和使用适当的统计方法来评估。
●参考限,n-:一个以描述为目的的并取自参考分布范围的值。
注意:常见的做法是确定一个参考限以便描述参考值级数。
假如所有参考值均大于或等于该值,它就是参考下限;而当所有参考值均小于或等于该值时,它就是参考上限。

论著参照C282A2确定胱抑素C的参考值范围苏保鑫1,周 帅2(1.淄博市第一医院检验科,山东淄博255200;2.四川省新成生物有限责任公司,四川成都611731) 【摘要】 目的 建立本实验室胱抑素C(胱氨酸蛋白酶抑制剂,Cytatin C,Cys2C)免疫透射比浊法测定试剂盒的参考值范围。
方法 随机抽取240例健康人员的新鲜血清,利用市售胱抑素C测定试剂盒(免疫透射比浊法)进行测定,测定结果按CLSI C282A2(临床实验室参考值范围的定义和确认2第2版)进行统计处理。
结果 本实验室1~49岁健康人群胱抑素C参考值范围为0159~1106mg/L,50~88岁健康人群胱抑素C参考值范围为0148~1132mg/L。
结论 实验室有必要根据C LSI C282A2文件的规定建立自己的参考值范围。
【关键词】 胱抑素C;免疫透射比浊法;参考值范围【中图分类号】 R44616 【文献标识码】 A 【文章编号】 100420501(2010)022*******D eter m i n e the reference i n terva ls of cyst a ti n C accord i n g to CL S I C282A2.SU B ao2xin1,ZHOU Shuai2.1.The First Hospital of Z ibo,Z ibo,Shandong255200;2.S ichuan S ine w B io2technology Co.,L TD,Chengdu,S ichuan611731,China 【Abstract】 O bjecti ve To build the reference intervals of Cystatin C.M ethods Random ly collecting240samp lesof health pers ons,test the m by systatin C assay kit(I m munolturbidi m etry method)and count the results according t o C LSI C282A2 (How t o define and deter m ine reference intervals in the clinical laborat ory;app r oved guideline2second editi on).Results Con2fir med the reference intervals of cystatin C is0159~1106mg/L t o1~49years old peop le,and0148~1132mg/L t o50~88yearsold peop le.Conclusi on It is necessary for labar ot ory t o deter m ine its own reference intervals accordinge t o the C282A2.【Key words】 cystatin C;i m munoturbidi m etry method;reference intervals 胱抑素C(胱氨酸蛋白酶抑制剂,Cystatin C,Cys2 C)已广泛应用于肾脏功能特别是肾小球滤过率的评价,但其作为新近开展项目,文献与厂家给定的参考值范围多有不一,并且其参考值范围的确定存在很多的争议[1],这为该项目的临床推广工作带来诸多限制。

附件:《体外诊断试剂分析性能评估系列指导原则(征求意见稿)》目录1.体外诊断试剂分析性能评估指导原则――编制说明2.体外诊断试剂分析性能评估指导原则——检测限3.体外诊断试剂分析性能评估指导原则——线性范围4.体外诊断试剂分析性能评估指导原则——可报告范围5.体外诊断试剂分析性能评估指导原则——准确度(回收实验)6.体外诊断试剂分析性能评估指导原则——准确度(方法学比对)7.体外诊断试剂分析性能评估指导原则——精密度8.体外诊断试剂分析性能评估指导原则——干扰实验9.体外诊断试剂分析性能评估指导原则——稳定性10.体外诊断试剂分析性能评估指导原则——参考值(参考区间)附件1:体外诊断试剂分析性能评估指导原则编制说明《体外诊断试剂注册管理办法(试行)》颁布后,体外诊断试剂产品的注册过程中要求提供申报产品的分析性能评估资料,产品性能评估是产品研发、制定产品标准等过程的重要技术支持研究过程,并可能对产品的质量造成一定的影响。
目前国际上对体外诊断试剂的性能评估通常是以美国临床实验室标准化组织(Clinical and Laboratory Standards Institude以下称为CLSI)的相关标准为依据,也是美国FDA 推荐采用的评价标准,但我国还没有相关的标准及指导原则的要求。
为进一步明确体外诊断试剂分析性能评估的技术要求,我中心组织有关专家起草产品分析性能评估指导原则,以明确体外诊断试剂产品性能评估的技术要求。
体外诊断试剂产品性能评估包括检测限、线性范围、可报告范围、准确度(回收实验)、准确度(方法学比较)、精密度、干扰实验、稳定性、参考区间共九个项目。
起草的主要依据CLSI发布的以下标准:1. C28-A2: How to define and determine reference intervals in the clinical laboratory; Approved Guideline-Second Edition.2. EP5-A: Evaluation of precision performance of clinical chemistry devices; Approved Guideline.3. EP6-A: Evaluation of the linearity of quantitative measurement procedures; A Statistical Approach; Approved Guideline.4. EP7-A: Interference testing in clinical chemistry; Approved Guideline.5. EP9-A2: Method comparison and bias estimation using patient samples; Approved Guideline-Second Edition.每项性能的主要研究方法均采用以上标准和国内实际采用的评价方法相结合的方法。

酶化学法测定糖化血红蛋白性能的验证肖弘;王敏;李小盛【摘要】目的对酶化学法测定糖化血红蛋白进行方法学性能的验证.方法参考美国国家临床实验室标准化委员会系列文件和相关文献,结合工作实际对酶化学法测定糖化血红蛋白进行精密度、准确度的分析测量范围和生物参考区间等进行评价,并将实验结果与厂家提供的分析性能或公认的质量指标进行比较.结果批内变异系数(CV) 0.87%~1.29%,批间CV 1.74%~2.12%;在3.0%~16.0%范围内线性良好Y=1.010X-0.004,r=0.999 7,平均回收率101.37%;该方法与TOSOH G7离子交换高效液相层析法二组比较差异无统计学意义(Y=0.962 2X+0.045,r=0.9940,P>0.05);分析测量范围(AMR)验证和生物参考区间验证结果均符合质量要求.结论酶化学法测定糖化血红蛋白主要分析性能符合质量目标要求,适合临床检验科应用.【期刊名称】《检验医学与临床》【年(卷),期】2011(008)012【总页数】3页(P1450-1451,1454)【关键词】糖化血红蛋白;酶化学法;性能验证【作者】肖弘;王敏;李小盛【作者单位】上海市长宁区天山中医医院检验科,200051;上海市长宁区天山中医医院检验科,200051;上海市长宁区天山中医医院检验科,200051【正文语种】中文糖化血红蛋白(HbA1c)的化学结构通常为具有一个特定六肽的血红蛋白分子,是葡萄糖和血红蛋白β链N末端缬氨酸(Val)(βN-1-去氧果糖基血红蛋白)的一个稳定加和物[1]。
在人体内,葡萄糖和血红蛋白β链N末端Val氨基之间进行非酶促反应,先形成不稳定的希夫碱,然后缓慢地重排,形成稳定、不可逆的氨基酮,其合成过程缓慢且不可逆,不受血糖浓度暂时波动的影响,可反映测定前4~8周血糖的平均水平。
HbA1c作为糖尿病筛选、诊断、血糖控制、疗效考核的有效监测指标,在临床中得到了广泛使用,2002年美国糖尿病协会已将其作为监测糖尿病血糖控制的金标准[2],故对糖尿病诊断有特殊诊断意义。

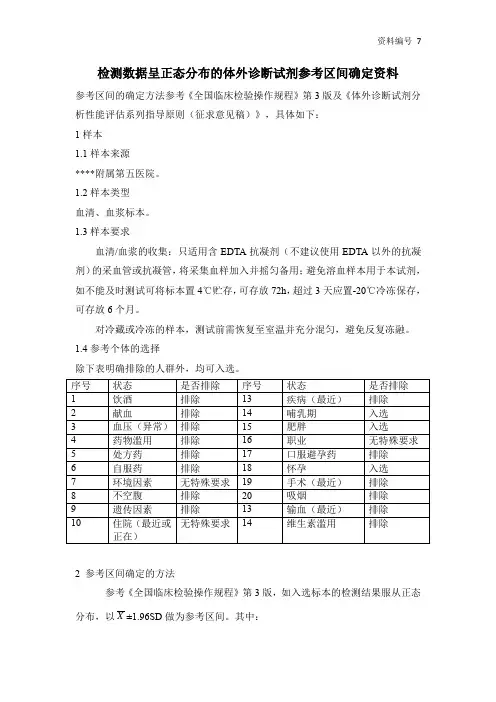
检测数据呈正态分布的体外诊断试剂参考区间确定资料参考区间的确定方法参考《全国临床检验操作规程》第3版及《体外诊断试剂分析性能评估系列指导原则(征求意见稿)》,具体如下:1样本1.1样本来源****附属第五医院。
1.2样本类型血清、血浆标本。
1.3样本要求血清/血浆的收集:只适用含EDTA抗凝剂(不建议使用EDTA以外的抗凝剂)的采血管或抗凝管,将采集血样加入并摇匀备用;避免溶血样本用于本试剂,如不能及时测试可将标本置4℃贮存,可存放72h,超过3天应置-20℃冷冻保存,可存放6个月。
对冷藏或冷冻的样本,测试前需恢复至室温并充分混匀,避免反复冻融。
1.4参考个体的选择除下表明确排除的人群外,均可入选。
2 参考区间确定的方法参考《全国临床检验操作规程》第3版,如入选标本的检测结果服从正态分布,以X±1.96SD做为参考区间。
其中:X = 检测结果的算术平均数SD=()12--∑n X Xn=120如入选标本的检测结果不服从正态分布,则采用95%分位法计算参考区间。
3 参考区间确定试验步骤:使用前请仔细阅读本说明书及***分析仪操作手册,测试应在室温下进行。
取70ul 样本加入到缓冲液中,混匀;取40ul 稀释过后的样本加入到卡条的加样窗口,层析15分钟,按照仪器操作方法的详细说明读取检验结果。
质量控制:当测试出现异常值时,建议进行校准和质控测试。
校准:在加样检测前,请将检测卡放于仪器卡槽中,扫描检测卡背面的二维码,进行仪器校准,不同批次的检测卡,缓冲液及二维码不能混用。
质控:用质控品(选购品,非试剂盒标配品)进行测试,测试结果应在靶值范围内。
5离群值检查经分析,各组数据D<1/3R,无离群值,均纳入后续的统计分析。
6两组之间差异比较(n=120)男女组数量均为60,则Z*=3(120/240)1/2=2.12,如果z值超过了对应的Z*值,两组之间即存在显著性差别,应分别报告参考区间。
另外,应检查标准偏差较大者,如S2,是否大于1.5S1。
--------------临床实验室如何确定和建立生物参考区间(核准指南――第二版)1 内容简介此指南是专为指导临床诊断实验室、诊断仪器试剂制造商和临床检验工作者在定量实验检测中确定参考值和参考区间而制定的。
它包括在临床医学实验室中建立可靠的参考区间所用的方法步骤和推荐程序。
而该推荐程序的主要内容是如何用最简便和最务实的方法去建立一个能保证足够可靠性和实用性的参考区间的草案。
此文献不可能每一种情形都面面俱到,所以有些内容需要通过指南外来充实。
但在特定的区域内,额外的步骤或努力可以提高参考区间的可信度和精确度。
目前的现状是,临床实验室科研人员和仪器试剂制造商缺乏统一的收集数据及操作方法去建立参考区间,故小组委员会希望此文献能为建立可靠的参考区间提供最基本的、统一的实验草案,并为进一步的研究夯实基础。
该程序指南的关键在于决定“相对健康”群体参考值或参考区间时所选择的样品组是否来源于健康良好的人群,这也是此文献的谈论的重点。
当然,对于其他类型诸如生理或病理情况下的参考值的建立,也应该采用相似的方法。
此程序概要适用于任何类型的参考区间的确定,因为它充分考虑了合适的参考个体的选择及各种分析方法影响因素等情况。
然而,这份文献没有专门地谈到怎样建立诊断域值(如危急值或各种医学决定值)。
这些值的决定方法各异,部分还经常要在特定医学条件下由诊断方法的敏感性和特异性来决定。
不同情况下的参考值研究的各种需求本指南也将涉及,包括:●新分析物的测量●用新的或不同的分析方法测量事先已明确知道的分析物或已标准化测定的生理学的数据和参考值。
●用相同或者有可比性的方法去测量同一分析物,并利用其他实验室或试剂生产商提供的参考值作比较研究(参考值的调用)。
被称为“参考值调用”的最后一项议题是比较复杂的。
因为今后所有的临床诊断实验室将会不断地遇到调用参考值的验证和随后的采用它这个问题,而试剂生产商和其他实验室所提供的参考值是不能直接应用的。
毛细管电泳法检测糖化血红蛋白的方法学性能评价目的:評价miniCAP Flex Piercing全自动毛细管电泳分析系统检测糖化血红蛋白(HbA1c)的方法学性能。
方法:精密度评价按照美国临床和实验室标准化委员会(CLSI)颁布的EP15-A3文件的要求进行初步评价;分析测量范围评价按照EP6-A2文件的要求进行;准确度评价使用EP9-A2文件,与高效液相色谱法检测结果进行比对,并计算其在医学决定水平处的偏倚;生物参考区间的验证采用C28-A2文件的方案进行;收集异常高值和异常低值的新鲜标本进行携带污染率的评价;收集确诊的异常血红蛋白病患者的标本进行抗干扰能力的评价。
结果:检测系统检测HbA1c浓度在 4.50%和7.50%时的重复性精密度分别为1.14%、0.70%,期间精密度分别为1.80%、1.36%;当HbA1c浓度在3.6%~12.1%时检测结果呈线性;与日本arkray公司的HA-8160高效液相色谱法检测结果比较,回归方程式为y=0.995x-0.177,线性相关系数R2=0.994,相关性较好,在医学决定的水平10%、16%处的偏倚分别为-2.77%、-1.61%均小于5.0%;携带污染率为1.18%小于3.00%可接受;选取的20份健康参考个体,其HbA1c检测结果均在3.6%~6.1%,参考区间可用;对广东地区常见的血红蛋白变异体HbE、HbS、HbC、HbD有良好的抗干扰能力。
结论:毛细管电泳法检测糖化血红蛋白的精密度、准确度、分析测量范围、携带污染率、生物参考区间均符合临床检测的需要,在抗血红蛋白变异体的干扰能力上优于高效液相色谱法。
糖化血红蛋白是血红蛋白与血糖进行不可逆的非酶促反应的产物,可以反映近2~3个月血糖的水平,是判断糖尿病长期控制的良好指标,同时也与糖尿病并发症相关[1-3]。
糖化血红蛋白检测目前临床上使用较多的为高相液相色谱法,该法具有操作简单、快速、结果可靠等特点,但是对于血红蛋白变异体的抗干扰能力较差[4-5]。
临床常用生化检验项目参考区间第4部分摘要:一、范围和规范性引用文件二、可报告范围的相关概念1.参考个体和参考人群2.参考样本组和参考值3.参考分布和参考限4.参考区间和参考范围三、参考区间的验证1.验证的重要性2.验证方法3.验证的挑战和解决方案正文:一、范围和规范性引用文件本标准规定了中国成人血清甲状腺相关激素的参考区间及其应用。
本标准适用于医疗卫生机构临床实验室血清三碘甲状腺原氨酸、甲状腺素、游离三碘甲状腺原氨酸、游离甲状腺素、促甲状腺激素检验结果的报告和解释,有关体外诊断产品生产厂商也可参照使用。
规范性引用文件包括:卫生部临床检验标准专业委员会提出的《WST 402-2012 临床实验室检验项目参考区间的制定》和美国的国家临床实验室标准委员会(NCCLS) 制定的《关于临床实验室如何确定和建立生物参考区间(NCCLS-C28-A2)》。
二、可报告范围的相关概念1.参考个体和参考人群参考个体是按明确标准选择的用作检验对象的个体,通常是符合特定标准的健康个体。
参考人群是由所有参考个体组成的群体,通常参考人群中的个数是未知数,因此参考人群是一个假设实体。
2.参考样本组和参考值参考样本组是从参考人群中选择的用以代表参考人群的足够数量的个体。
参考值是对参考个体某项特定量进行观察或者测量而得到的值(检验结果),参考值从参考样本组中获得。
3.参考分布和参考限参考分布是参考值的分布,参考人群的分布与分布参数可用参考样本而适宜的统计方法评估。
参考限源自参考分布用于分类目的的值,参考限规定部分的参考值分别小于等于或大于等于下侧或上侧限值,参考限将参考值分类,参考限可能会与其他各种类型的医学决定限不同。
4.参考区间和参考范围参考区间是指从参考下限到参考上限的区间,通常是中间95% 区间,在某些情况下只有一个参考限就有临床意义,通常是参考上限,这时的参考区间是0 到参考上限。
参考区间通称为参考范围、正常范围、正常值等,但参考区间为国际通用规范用语。
北京地区新生儿全血13种酰基肉碱串联质谱法参考区间的调查李启亮;宋文琪;徐樨巍;葛群【摘要】目的建立北京地区新生儿全血13种酰基肉碱含量的参考区间,为遗传代谢病的诊断提供实验依据.方法采用串联质谱法检测北京地区313例新生儿游离肉碱(C0),乙酰肉碱(C2),丙酰肉碱(C3),丁酰肉碱(C4),异戊酰肉碱(C5),己酰肉碱(C6),辛酰肉碱(C8),癸酰肉碱(C10),肉豆蔻酰肉碱(C14),棕榈酰肉碱(C16),十八碳酰肉碱(C18),戊二酰肉碱(C5DC)及3-羟基异戊酰基肉碱(C5-OH)等13种酰基肉碱水平.用美国临床和实验室标准化协会(CLSI)推荐的C28-A2文件提供的参考方法对所有数据进行分析.结果经过正态性检验发现,除C0之外,其他12种酰基肉碱均成偏态分布.各种酰基肉碱的参考区间分别为:C0 8.00~65.00 μmol/L,C2 4.00~55.00 μmol/L,C30.40~9.00μmol/L,C3/C0 0.02~0.30 μmol/L,C3/C2 0.04~0.40μmol/L,C4 0.10~0.90 μmol/L,C5 0.04~1.40 μmol/L,C6 0.04~0.30μmol/L,C8 0.03~0.45 μmol/L,C10 0.04 ~0.60 μmol/L,C14 0.05~0.75μmol/L,C16 0.30~6.00 μm ol/L,C18 0.10~2.50 μmol/L,C5DC 0.01~0.25βmol/L,C5-OH 0.00~0.60 μmol/L.结论建立了北京地区新生儿的各种酰基肉碱的参考区间,为临床诊治和筛查遗传代谢病提供了参考依据.【期刊名称】《临床检验杂志》【年(卷),期】2012(030)006【总页数】3页(P470-472)【关键词】串联质谱法;酰基肉碱;参考区间;新生儿【作者】李启亮;宋文琪;徐樨巍;葛群【作者单位】北京儿童医院检验中心,北京100045;北京儿童医院检验中心,北京100045;北京儿童医院检验中心,北京100045;北京儿童医院检验中心,北京100045【正文语种】中文【中图分类】R722.1先天性代谢异常(inborn errors of metabolism,IEMs)又称遗传代谢病(inherited metabolic disorders),种类繁多,涉及机体各系统组织器官,是新生儿疾病的重要原因。
参照C28-A2确定胱抑素C的参考值范围
苏保鑫;周帅
【期刊名称】《四川医学》
【年(卷),期】2010(031)002
【摘要】目的建立本实验室胱抑素C(胱氨酸蛋白酶抑制荆,Cytatin C,Cys-C)免疫透射比浊法测定试剂盒的参考值范围.方法随机湘取240例健康人员的新鲜血清,利用市售胱抑素C测定试剂盒(免疫透射比浊法)进行测定,测定结果按CLSI C28-A2(临床实验室参考值范围的定义和确认-第2版)进行统计处理.结果本实验室1~49岁健康人群胱抑素C参考值范围为0.59~1.06mg/L,50~88岁健康人群胱抑素C参考值范围为0.48~1.32mg/L.结论实验室有必要根据CLSI C28-A2文件的规定建立自己的参考值范围.
【总页数】3页(P246-248)
【作者】苏保鑫;周帅
【作者单位】淄博市第一医院检验科,山东,淄博,255200;四川省新成生物有限责任公司,四川,成都,611731
【正文语种】中文
【中图分类】R446.6
【相关文献】
1.福州地区健康孕妇血清胱抑素C检测参考值范围的建立 [J], 马梅;成玲;林娟;卓碧敏;王秀清
2.二氧化碳酶法测定试剂盒参考值范围C28-A2验证方法 [J], 陈浩
3.确定多指标医学参考值范围的统计方法第六讲制定临床诊治参考值范围的统计方法 [J], 陈彬;张铭志
4.丽水市健康孕妇血清胱抑素C参考值范围的调查 [J], 黄桂英;莫寿勇;张瑾;江丽莉;张小薇
5.参照CLSI C28-A2文件制定不同妊娠时期胱抑素C的参考范围 [J], 王德彬;赵茹妹;高翠红
因版权原因,仅展示原文概要,查看原文内容请购买。