002-1新GSP风险评估表(质量体系)
- 格式:doc
- 大小:78.50 KB
- 文档页数:3
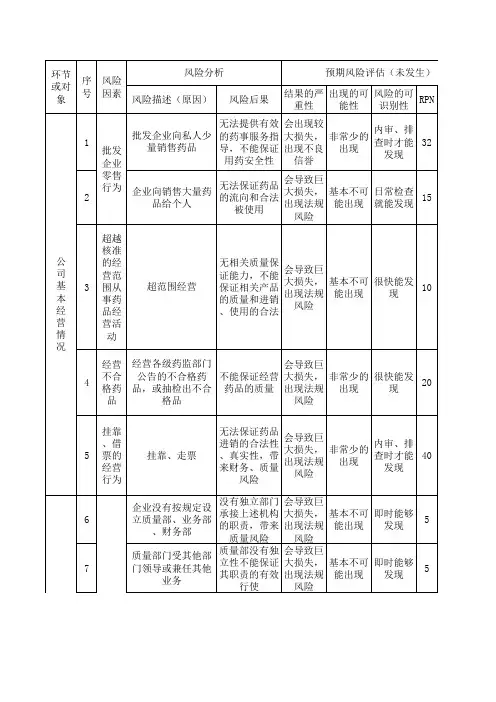
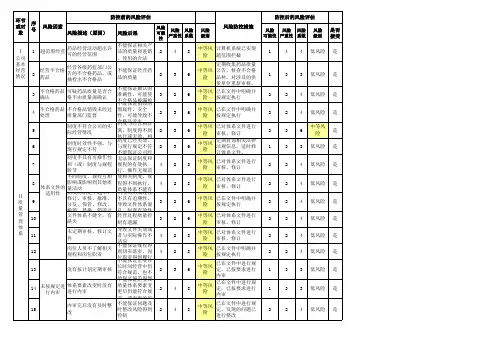
质量体系设置不全
人员与培训人
人员
电子计算机系统、操作记
录
营各环节质量控制
设施设备仓储场所及相关设施设备
及相关设
备
湿
录度
监
控
系
验证与校准
验证
购
收货与验
收
储存与养
护
护
灾害全危险,造成
不必要的药品
流失,不能保
证仓储条件
险预案,首要保障人员安全、其次保证财产
安全。
积极配合救灾抢险。
按不合格品处理
剩余药品。
购买保险减小风险系数。
隐患,会
延续下去
程度的控
制
大损失,
出现法规
风险
药品的出库
、
的出库、运输与配送条件不符合规定的,不得发运。
运输药品过程中,运载工具应当保持密闭。
企业应当严格按照外包装标示的要求搬运、装卸药品。
突发事件
与售
售
售
后
服
务。


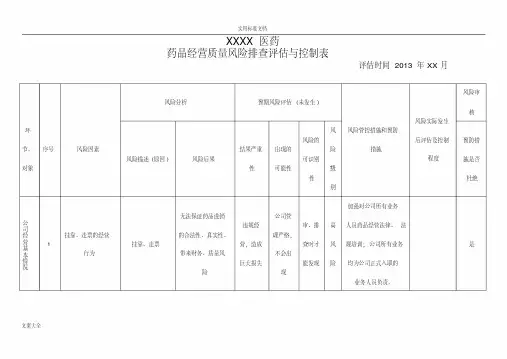
山东沃可欣生物技术有限公司质量风险管理控制表
1
2
山东沃可欣生物技术有限公司各环节质量风险管理控制表
3
山东沃可欣生物技术有限公司各环节质量风险管理控制表
4
山东沃可欣生物技术有限公司各环节质量风险管理控制表
5
山东沃可欣生物技术有限公司各环节质量风险管理控制表
6
山东沃可欣生物技术有限公司各环节质量风险管理控制表
7
山东沃可欣生物技术有限公司各环节质量风险管理控制
8
山东沃可欣生物技术有限公司
9
各环节质量风险管理控制表
山东沃可欣生物技术有限公司
10
各环节质量风险管理控制表
山东沃可欣生物技术有限公司
11
各环节质量风险管理控制表
山东沃可欣生物技术有限公司
12
各环节质量风险管理控制表
山东沃可欣生物技术有限公司
13
各环节质量风险管理控制表
山东沃可欣生物技术有限公司
14
各环节质量风险管理控制表
15。
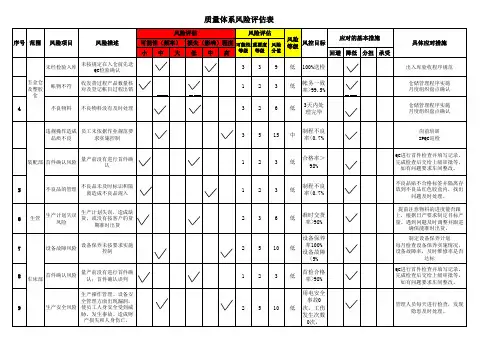

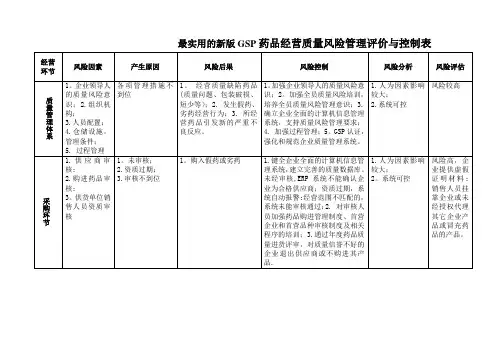
新版GSP质量风险评估审核表质量风险管理评价与控制表风险评价风险控制风险因素供应商审核:供应商产品审核;销售人员资质审核 1、确立企业“购、储、销”的计算机信息管理系统,未经审核,系统不能确认企业为合格供应商;资质过期,系统自动报警、锁缺陷原因 1、未审核;2、资质过期;3、审核不到位定;非授权人不能在系统内审批;2、对审核人员加强药品购进缺陷后果购入假药或劣药管理措施管理制度、首营企业和首营品种审核制度及相关程序的培训;3、1、人为因素影响较大;2、系统可控采购环节通过年度药品质量进货评审,对质量信誉不好的企业退出供应不风险分析购进其产品。
风险高,企业提供虚假证明材料;销售人员挂靠企业或未经授风险减少,风险避免风险评估风险接受权代理其它企业产品或冒充药品的产品风险因素收货检查 1、确立企业“购、储、销”的计算机信息管理系统,未经采购人员制定的采购记录,系统无收货指令;收货需凭系统指令——缺陷原因检查不到位“采购订单”执行;2、对收货人员加强药品购进管理制度、收1、接收非我公司购进的药品;2、接收假药(受污染等)或劣管理措施货管理制度及程序的培训;3、严格执行药品收货原则。
收货环节缺陷后果药;3、接收药品质量明显缺陷(外观质量问题、包装破损、短少等)药品。
风险分析 1、人为因素影响较大;2、系统可控风险评估风险适中,由于是中间环节,后期有质量检查验收环节控制。
风险接受风险避免风险因素检查验收 1、确立企业“购、储、销”的计算机信息管理系统,验收员凭收货员签发的验收指令——“验收通知单”执行验收;2、对验1、未验收;2、检查验收不到位;3、验收延误;4、抽样不到缺陷原因收员加强药品质量检查验收管理制度、抽样验收程序的培训;3、位严格执行冷链管理要求;4、验收不合格的药品报质量管理部并1、验收不合格的假药(受污染等)或劣药;2、验收合格药品管理措施有相应的记录和手续。
质量检查质量缺陷(外观质量问题、包装破损、短少等)药品;3、验缺陷后果验收环节收延误(冷链药品),造成药品质量缺陷(内在质量)、药品失效风险分析 1、人为因素影响较大;2、系统可控风险较高,验收环节是药品入库管理关键环节,是质量管理重风险减少、风险可控风险评估风险接受点风险因素储存管理、养护检查 1、完善人员培训,保管员、养护员积极落实岗位管理职责,严格执行药品保管、储存养护管理制度、仓库温湿度管理制度等相1、药品未按存储条件(常温、阴凉、冷藏)分开储存;2、仓关制度和程序;2、药品应按存储条件(常温库、阴凉库、冷库)库合格储存不到位(未做到“五分开”);药品堆码不到位,未分开储存、仓库合理储存做到“五分开”;药品堆码做到符合“五做到符合“五距”;3、仓库“五防”设施不到位,未及时保养、距”;3、仓库“五防”设施要及时保养、更新,定期清洁药品储更新,药品仓储环境卫生执行不到位;4、仓库温湿度检测、存区域;4、仓库温湿度检测、调控设施、设备满足实时监测和调控设施、设备不到位,不能满足实时检测和自动调控(含冷缺陷原因自动调控(含冷库),必要时,进行仓库温湿度变化的验证;5、库);5、药品存储未按“五区”分开存放,不合格药品未做到药品存储应按“五区”分开存放,不合格药品专区管理实行色标专区管理,实施色标管理不到位;6、养护人员检测温湿度、管理;6、养护员监测温湿度、指导保管员调控温湿度设施需要指导保管员调控温湿度设施执行不到位;7、“药品近效期预警”严格按制度执行;7、“药品近效期预警”畅通;8、养护检查过执行不到位;8、养护检查过程中发现问题未及时按程序处理;储存养护管理措施程中,发现问题及时向质量管理部门报告,质量管理部门应及时9、养护分析执行不到位;10、保管员库房账务、盘点不到位。
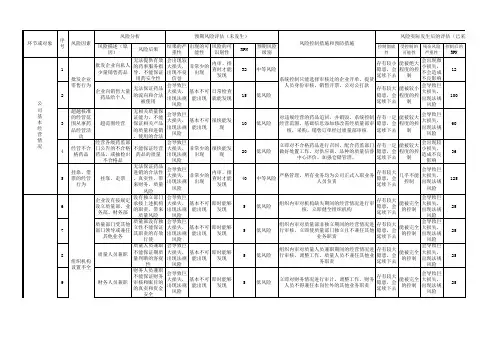
药品经营环节质
量体系
质
量
体
系
行内审
人员与培
训
电子计算机系
统
系统在经营
各环节质量控制
仓储场所及相关设施设备设施设备
温湿度监控系
统
能
验证与校准
应商业务合作中的风险得到有效控制,质量得到保证
核
采购
收货与验
收
储存与养
护
出现
大损失,
出现法规
药品的质量、
安全
药品的出库、运输
与
的出
、运输与配
送
突发事件
证运输条件和运输时限
销售与售后服
务
售
后Array服
务
众用药安全
风险
录
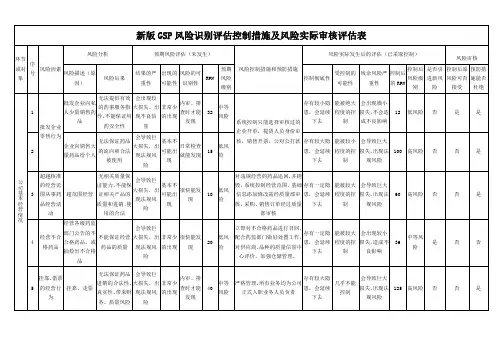
备注:风险指数的确定:对风险出现的可能性、严重性和可检测性根据上表分别进行打分,确定风险指数险,60-125分为高风险。
RPN为20分以下为合理可接受风险。
环节质量风险管理评价与控制表。
1.人为因素影响 较大;2.系统可控1。
人为因素影响 较大; 2。
系统可控1.键全企业全面的计算机信息管 理系统,建立完善的质量数据库。
未经审核 ,ERP 系统不能确认企 业为合格供应商;资质过期,系 统自动报警;经营范围不匹配的, 系统未能审核通过;2. 对审核人 员加强药品购进管理制度、首营 企业和首营品种审核制度及相关 程序的培训;3.通过年度药品质 量进货评审,对质量信誉不好的 企业退出供应商或者不购进其产1。
加强企业领导人的质量风险意 识; 2。
加强全员质量风险培训, 培养全员质量风险管理意识; 3。
确立企业全面的计算机信息管理 系统,支持质量风险管理要求; 4. 加强过程管理;5。
GSP 认证,强化 和规范企业质量管理系统。
1。
企业领导人 的质量风险意 识; 2。
组织机 构; 3。
人员配置; 4.仓储设施, 管理条件; 5。
过程管理 1. 供 应 商 审 核; 2。
购进药品审 核; 3。
供货单位销 售人员资质审 核1 。
经营质量缺陷药品 (质量问题、包装破损、短少等);2. 发生假药、 劣药经营行为; 3. 所经 营药品引起新的严重不 良反应.品。
风险高,企 业提供虚假 证明材料; 销售人员挂 靠企业或者未 经授权代理 其它企业产 品或者冒充药 品的产品。
1.未审核; 2。
资质过期; 3.审核不到位各项管理措施不 到位风险较高 1.购入假药或者劣药1.确立企业全面的计算机信息管 理系统,无采购定单的, ERP 系 统未能生成收货指令;收货需凭 系统指令—— “采购定单”执行;2.对收货人员加强药品采购管理 制度、 收货程序的培训; 3。
严格执行药品收货管理制度。
1。
确立企业全面的计算机信息管 理系统,验收员凭收货员在 ERP系统中的收货确认执行验收; 2。
对验收员加强药品质量检查验收 管理制度、抽样程序、验收程序和进口药品、冷链药品管理制度的培训; 3.严格执行冷链管理药 品要求;4.验收不合格药品, 质量 管理员要履行质量复核手续.1。
质量体
系
人员与培
训
电子计算机系
统
系统在经营各环节质量控制
仓储场所及相关设施设备
设施设备
湿度监控系统
验证
验证与校准
购
收货与验
收
存与
储存与养
护
能出现
大损失,出现法规风险
药品的的运输温度适宜性和可追溯性药
品 的 出 库 、 运 输 与 配 送
害发生时立即启动应急避险预案,首要保障人员安全、其次保证财产安全。
积极配合救灾抢险。
按不合格品处理剩余药品。
购买保
全危险,造成不必要的药品流失,不能保
销售与售后服
务。
质量体
系
人员与培
训
电子计算机系
统
仓储场所及相关设施设备
设施设备
系统
验证
验证与校准
购
货与
回,按不合格品管理。
漏传的电子数据尽力
补齐。
实施电子监管的药品,企业应当按规定进行药品电子监管码扫码,并及时将数据上传至中国药品电子监管网系统平台。
就能发现
现大损失,出现法规
风险
的合法性、真伪和来源的可靠性收货与验收
储存与养
护
大损失,出现法规风险
能出现
药品的的运输温度适宜性和可追溯性药 品 的 出 库 、 运 输 与
、运Array输
与
配
送
售后
售与
的控制大损失,出现不良信誉
隐患,会延续下去。