与铝有关的反应图像分析
- 格式:docx
- 大小:158.75 KB
- 文档页数:11


有关al的化学方程式铝(al)是一种轻质、有色、有光泽的金属元素,它在地壳中的含量仅次于氧和硅,属于主族元素中的第三A族。
铝具有很高的导电性、导热性、反射性和抗腐蚀性,广泛应用于电力、交通、建筑、航空等领域。
铝也是一种活泼的金属,它可以与许多非金属、水、酸、碱等物质发生化学反应,生成不同的化合物。
本文将介绍铝及其化合物的一些常见的化学方程式,以及它们的特点和意义。
铝与非金属的反应铝可以与氧、氯、硫等非金属元素发生反应,生成相应的氧化物、氯化物和硫化物。
这些反应通常需要高温或点燃才能进行,因为铝表面会形成一层致密的氧化铝膜,阻碍了反应的进行。
这些反应的方程式如下:铝与氧反应:4Al + 3O2 = 2Al2O3这是一种燃烧反应,放出大量的热能和光能。
氧化铝(Al2O3)是一种白色或透明的固体,具有高硬度、高熔点和高折射率,是制造陶瓷、耐火材料、磨料和宝石等的重要原料。
铝与氯反应:2Al + 3Cl2 = 2AlCl3这也是一种燃烧反应,放出黄绿色的火焰和白色的烟雾。
氯化铝(AlCl3)是一种白色或淡黄色的固体,具有强酸性和强腐蚀性,是制造其他铝化合物、染料、香料等的重要原料。
铝与硫反应:2Al + 3S = Al2S3这也是一种燃烧反应,放出蓝色的火焰和白色的烟雾。
硫化铝(Al2S3)是一种黄色或灰色的固体,具有难溶于水和酸碱性溶液的特点,是制造其他硫化物和硫酸盐等的重要原料。
铝与水的反应铝可以与水发生反应,生成氢氧化铝和氢气。
这个反应需要高温或催化剂才能进行,因为铝表面的氧化铝膜会阻碍反应的进行。
这个反应可以用来制取氢气或检验水中是否含有碱性物质。
这个反应的方程式如下:铝与水反应:2Al + 6H2O = 2Al(OH)3 + 3H2这是一种置换反应,铝取代了水中的氢。
氢氧化铝(Al(OH)3)是一种白色或灰色的胶状固体,具有两性的特点,即可以与酸和碱发生反应。
氢氧化铝是制造铝、明矾、沸石等的重要原料,也是医药、化妆品、造纸等的重要添加剂。
在空气中都能跟氧气反应,表面覆盖一层致密而坚硬的氧化物薄膜,都具有自我抗腐蚀能力铝合金汽车、船舶、飞机制造、防锈油漆、导线、电缆等易错点:(1)常温下,能用铝制容器盛放浓硫酸、浓硝酸的原因是二者能使铝发生“钝化”,而不是铝与浓硫酸、浓硝酸不反应。
(2)铝不但能与酸(H +)反应,还能够与碱溶液反应,表现为特殊性。
2Al +2OH -+2H 2O===2AlO -2+3H 2↑。
其反应机理应为:铝先与强碱溶液中的水反应生成H 2和Al(OH)3,然后Al(OH)3再与NaOH 反应生成H 2O 和NaAlO 2,反应中铝作还原剂,水作氧化剂,NaOH 无电子得失。
(3)铝热反应是在高温干态下进行的置换反应,铝只能与排在金属活动性顺序其后的金属氧化物反应。
铝不能与MgO 反应,铝热反应不能用来冶炼大量的金属铁、铜等(要考虑冶炼成本)。
(4)Mg 在CO 2中能够燃烧,所以活泼金属镁着火不能用干粉灭火器和泡沫灭火器灭火。
同时镁与氮气反应生成Mg 3N 2。
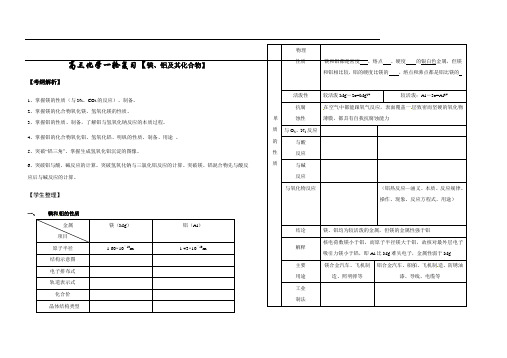
二、铝的重要化合物1.氧化铝(1)物理性质 色态: ;硬度: ;熔点: 。
(2)化学性质①属于两性氧化物,写出有关反应的离子方程式:,②电解 化学方程式为 2Al 2O 3(熔融)=====电解4Al +3O 2↑。
(3)用途熔点很高,是一种较好的耐火材料,天然产刚玉的成分是Al 2O 3,还可制作各种宝石。
2.氢氧化铝 (1)物理性质Al(OH)3是一种难溶于水的白色胶状物质,具有较强的吸附能力。
(2)化学性质 ①两性Al(OH)3的电离方程式为Al(OH)3既能溶于强酸又能溶于强碱,且都生成盐和水。
与强酸反应: , 与强碱溶液反应: 。
②不稳定性Al(OH)3受热分解: 。
(3)制备①向铝盐中加入氨水,离子方程式为 。
②NaAlO 2溶液中通入足量CO 2,离子方程式为 。
③NaAlO 2溶液与AlCl 3溶液混合:离子方程式为 。


![人教版高中化学必修1[知识点整理及重点题型梳理]_铝及其化合物_提高](https://img.taocdn.com/s1/m/0318cb5cddccda38376baf7d.png)
人教版高中化学必修一知识点梳理重点题型(常考知识点)巩固练习铝及其化合物【学习目标】1、铝的性质;2、铝的重要化合物及其相互转化。
【要点梳理】 要点一、铝12.化学性质 Al-3e -=Al 3+(1)与非金属反应: a 、铝与氧气的反应。
【铝及其化合物】实验探究:加热有氧化膜和无氧化膜的铝箔b 、与其它非金属反应: 2Al+3S Al 2S 3 2Al+3Cl 2 2AlCl 3(2)与酸反应:(3)与碱反应2Al+2H 2O+2NaOH =2NaAlO 2+3H 2↑ 2Al+2H 2O+2OH -=2AlO 2-+3H 2↑ 要点诠释:①铝是一种较活泼的金属,它并不直接与碱反应,铝与氢氧化钠溶液的反应,实际分两步进行:首先要铝与水反应:2Al+6H2O=2Al(OH)3↓+3H2↑……①由于生成的Al(OH)3覆盖在Al的表面,故看不到H2的生成;其次是生成的Al(OH)3是两性氢氧化物,它溶于NaOH:Al(OH)3+NaOH=NaAlO2+2H2O……②所以铝与NaOH溶液反应可以看到有气体产生。
将两反应式按①+②×2合并,即得总反应式:2Al+2H2O+2NaOH=2NaAlO2+3H2↑。
所以在上述反应中Al是还原剂,H2O是氧化剂。
其电子转移情况可表示如下:②Al与酸、碱反应产生同量的H2,消耗Al的物质的量之比为1∶1,消耗盐酸和NaOH的物质的量之比为3∶1。
③酸、碱、盐可直接侵蚀铝的保护膜(氧化铝也能与酸或碱反应)以及铝制品本身,因此铝制餐具不宜用来蒸煮或长时间存放酸性、碱性或咸的食物。
④铝热反应:Al+M x O y Al2O3+xM铝热反应的应用:冶炼高熔点金属,如Fe、V、Cr、Mn等或焊接钢轨。
3.用途:铝主要用来制轻合金。
要点二、铝的化合物1.氧化铝(Al2O3)(1)物理性质:白色难熔固体、不溶于水。
(2)化学性质:Al2O3是典型的两性氧化物,既能与酸反应又能与强碱溶液反应。
第三章铁金属材料考点3 “铝三角”的转化关系及有关氢氧化铝沉淀的图像分析学业测评1.(2021·广东·深圳第二外国语学校高一期末)下列关于铝及其化合物的性质、用途的说法不正确的是A.铝粉和氢氧化钠混合物可用作下水道疏通剂B.可用NaOH溶液除去Fe2O3粉末中少量的Al2O3C.铝的氧化膜致密且熔点高,从而能保护内部金属D.铝制品廉价易得,适用于厨房制作和长期存放各类食物【答案】D【解析】A.铝和氢氧化钠遇水反应放出大量的热,加快氢氧化钠对毛发等淤积物的腐蚀,同时产生氢气增加管道内的气压,利于疏通,所以铝粉和氢氧化钠混合物可用作下水道疏通剂,故A正确;B.Al2O3和NaOH溶液反应生成可溶性偏铝酸钠,所以可用NaOH溶液除去Fe2O3粉末中少量的Al2O3,故B正确;C.铝和氧气反应生成的氧化膜致密且熔点高,从而能保护内部金属,故C正确;D.铝能够与酸、碱发生反应,铝制品不能长期存放酸性或碱性较强的食物,故D错误;选D。
2.下列关于金属铝及其化合物的叙述不正确的是A.Al2O3不能跟所有的酸碱溶液反应B.铝是活泼的金属,在化学反应中容易失去电子,表现出还原性C.铝箔徃空气中用酒精灯加热可以融化,且发生剧烈燃烧D.铝箔在空气中用酒精灯加热可以观察到铝融化了但并不滴落【答案】C【解析】A.氧化铝和强酸、强碱反应,不能和弱酸弱碱反应,A正确;B.铝是比较活泼的金属,最外层有3个电子,在化学反应中易失去3个电子而达8电子的稳定结构,表现还原性,B正确;C.加热时铝和氧气会反应生成熔点很高的氧化铝,将内部熔化的铝包裹住,铝熔化了但是不会滴落,不会出现发生剧烈的燃烧,C错误;D.加热时铝和氧气会反应生成熔点很高的氧化铝,将内部熔化的铝包裹住,铝熔化了但是不会滴落,D正确;故选C。
3.现有MgO、Al2O3、Fe2O3、CuO混合物,如果只用一种试剂把Al2O3分离出来,应选用试剂A.氨水B.浓NaOH溶液C.NaCl溶液D.稀H2SO4【答案】B【解析】A.MgO、Al2O3、Fe2O3、CuO与氨水都不反应,故A不符合题意;B.Al2O3能与浓NaOH溶液反应溶解,MgO、Fe2O3、CuO与NaOH溶液都不反应,可以把Al2O3分离出来,故B符合题意;C.MgO、Al2O3、Fe2O3、CuO与NaCl溶液都不反应,故C不符合题意;D.MgO、Al2O3、Fe2O3、CuO与稀H2SO4都反应,故D不符合题意;故答案为B。
适用于高二、三铝盐与偏铝酸盐的性质及应用河南省罗山高中(464200) 徐业政铝盐与偏铝酸盐的性质是有关习题、试题中涉及频率比较高的一类知识,下面分别分别对其性质、相关计算、图像进行总结与分析。
1.铝盐的性质铝盐是指铝离子与酸根形成的盐,其最重要的性质是与碱的反应,该类反应比较复杂:反应现象、产物与碱的强弱及盐与碱的混合方式或相对用量有关,因为碱与铝盐的反应产物一A l(O H)3具有溶于强碱的性质。
铝盐与其它的盐也能反应,其中铝离子与部分酸根离子的反应比较复杂,因为此种反应属于“双水解”反应1.1.与强碱、弱碱的反应例1:除去Mg中的Al的首先使用的试剂应是A 氨水B Na2CO3C NaOHD MgSO4解析:氨水与Mg2+、Al3+均可反应分别生成难溶性的M g(O H)2、A l(O H)3,且二者均不溶于氨水中,故A不能用;Na2CO3可与Mg2+形成MgCO3沉淀、与Al3+发生双水解反应生成A l(O H)3沉淀,B淘汰;用过量的NaOH溶液可使Mg2+转化为M g(O H)2沉淀,Al3+转化为可溶性的N a A l O2,过滤后将沉淀溶于适量的酸中即可达到目的。
MgSO4不能与Al3+反应。
故正确的答案为C。
1.2.与强碱溶液的反应例2:下列各组溶液,只用试管各胶头滴管,不用其它任何试剂就可以鉴别开的是A KOH和Al2(SO4)3B 稀硫酸和NaHCO3C CaCl2和Na2CO3D B a(O H)2和NaHSO4解析:由于将KOH滴加到Al2(SO4)3溶液中先产生白色沉淀后沉淀溶解,而将Al2(SO4)3而滴加到KOH溶液中开始时没有沉淀生成后有沉淀生成,故A可以。
后面的三组不论滴加方式如何,产生的现象相同(C、D均为白色沉淀,B均只产生气泡)而无法鉴别开。
1.3.与酸根离子的反应Al3+能与HCO3―、CO32―、S2―、SO32―、AlO2―等弱酸的酸根离子在溶液中会发生所谓的双水解反应,生成A l(O H)3沉淀和气体(AlO2―无气体生成),如3HCO3―+Al3+=+CO2↑+4A l(O H)3↓。
两性金属Zn和Be与Al(OH)3有关图像分析与计算专题复习与训练考点1两性金属Zn和Be知识拓展与梳理强化训练1、铝、铍及其化合物具有相似的化学性质,已知反应:BeCl2+Na2BeO2+2H2O===2NaCl+2Be(OH)2↓能完全进行,则下列推断正确的是()A.Be(OH)2既能溶于盐酸,又能溶于NaOH溶液B.因BeCl2水溶液的导电性强,故BeCl2是离子化合物C.常温下Na2BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeOD.常温下BeCl2溶液的pH>7,将其蒸干并灼烧后得到的残留物是BeCl2解析铝、铍及其化合物具有相似的化学性质,Be(OH)2与Al(OH)3性质相似,Be(OH)2既能溶于盐酸,又能溶于NaOH溶液,A正确;某些共价化合物水溶液的导电性也较强,B错误;Na2BeO2溶液蒸干灼烧后得到Na2BeO2,C错误;常温下BeCl2溶液的pH<7,蒸干并灼烧后得到的残留物是BeO,D错误。
答案A案例2制备2、锌和铝都是活泼金属,其氢氧化物既能溶于强酸溶液,又能溶于强碱溶液,但是Al(OH)3不溶于氨水,而Zn(OH)2能溶于氨水,生成[Zn(NH3)4]2+。
回答下列问题:(1)单质铝溶于NaOH溶液后,溶液中铝元素的存在形式为________(用化学式表示)。
(2)写出锌和NaOH溶液反应的离子方程式:_________________________________________________________________________________。
(3)下列各组中的两种溶液,用相互滴加的实验方法可以鉴别的是________(填序号)。
①Al2(SO4)3和NaOH ②Al2(SO4)3和氨水③ZnSO4和NaOH ④ZnSO4和氨水(4)写出可溶性铝盐和氨水反应的离子方程式:_______________________________________________________________________________。
与铝有关的图像分析一、向AICI 3溶液中滴加 NaOH 溶液 O 〜A 段:Al 3 3OH > Al OH 3 .A 〜B 段:Al OH 3 OH 一 二 AIO 2一 2H 2O从图1不难看出,向氯化铝溶液中滴加氢氧化钠溶液, 若达不到最大沉淀量时, 对应的 氢氧化钠溶液的体积有两种情况: 一是氯化铝过量即加入的氢氧化钠不足; 二是加入的氢氧 化钠将生成的氢氧化铝溶解了一部分。
NaOII 熔液的休积/L图1向强碱溶液中滴入铝盐溶液 :先无沉淀,当 Al 3全部转化为 AlOf 时,再加入铝盐溶液,则偏铝酸盐与铝盐溶液发生了相互促进水解的反应,产物都是AI (OHL 。
女口图 3 所示:w.w.w.k.s.5.u.c.o.mBC* AiajtfcgvT图3发生反应的离子方程式为:8A 段:Al 3 4OH 一 二 AlOf 2H 2OA 〜B 段:Al 3 3AIO 2— 6H 2O =4AI OH 3、•三、向铝盐溶液中滴入氨水或向氨水中滴加铝盐溶液(I )向铝盐中滴加氨水时,当氨水增加到 n Al 3' : n NH 3 • H 2O 1=1: 3时,产生最大沉淀量如图4所示。
沉淀的物借&图4(II )向氨水中滴加铝盐溶液时,开始时氨水过量,如图5所示,离子反应方程式为:3NH 3 • H 2O Al 3 二 Al OH 3「:;3NH 4mo)AH鼠水的体积/L图5由图4与图5不难看出,氢氧化铝沉淀是不溶于弱碱氨水中的。
四、向偏铝酸盐溶液中滴入强酸w.w.w.k.s.5.u.c.o.m当n AlO/ : n H 川i ;=1: 1时,产生最大沉淀量,继续滴入强酸,沉淀逐渐溶解。
如 图6所示。
图6五、向盐酸中滴加偏铝酸盐溶液w.w.w.k.s.5.u.c.o.m滴入的偏铝酸钠先与盐酸反应生成 AI(OH \沉淀,继而马上被盐酸溶解,反应方程式为:4H AIO/ = AI 3 2H 2O继续滴加的NaAIO 2则与AP 发生水解反应,离子方程式为:mol沉淀的物质的S/JAl 3 3AIO 2- 6H 2O =4AI OH 3 .沉淀量的变化可用图 7表示。
lOolli Cz 「图7六、向 NaA IO 2 溶液中通入 CO 2 w .w.w.k.s.5.u.c.o.m由于产生的 Al OH 3沉淀不溶解在碳酸中,产生的沉淀不消失,如图8所示。
现象是先产生沉淀,继续滴加盐酸沉淀部分溶解,其离子反应方程式为:Mg 2 2OH - = Mg OH 2 y AICI 3 3OH 、Al OH 3 - Al OH 3 OH 、AIO 2一 2H 2OO 口NaOH JS 液的体駅儿八、向明矶溶液中滴加Ba OH 2溶液w .w.w.k.s.5.u.c.o.m当向明矶〔KAI SO 4 2 • 12H 2O 1溶液中滴加氢氧化钡溶液时,在生成氢氧化铝沉淀的 同时生成硫酸钡沉淀, 现象是先生成白色沉淀, 继续滴加时沉淀部分消失,所发生的化学反沉淀的物质的沉淀的七、向AICI 3、MgCI 2溶液中滴加NaOH 溶液 w.w.w.k.s.5.u.c.o.m101y J>J应有:w.w.w.k.s.5.u.c.o.m当溶液中的 Al 3 •完全沉淀时:2KAl SO 4 2 3Ba OH 2 = 2Al OH 3 ":;3BaSC4 Q :; K 2SO 4当溶液中的SO2比全沉淀时:KAl (SQ 》+2Ba (OH \ = KAIO 2 +2BaSQ J +2H 2O其生成沉淀的量与加入碱的体积关系如图12和图13所示。
解析:已知n AlCl 3 =0.03mol ,n 〔Al OH J - 0.01mol ,由沉淀的物质的量小于氯化铝的物质的量可推知此题可能有两个答案:一氢氧化钠不足,二氢氧化钠过量。
由两者反应的离子方程式知:Al 3 30^ - Al OH 37Al OH 3 OH > AlOf 2H 2O当碱的量不足时:V Na OH aq 〕= 75mL当碱过量时: V 〔Na (OH )aq 1 二 °03 3 0.02L = 27.5mL4故此题答案为:B 、Do例2.下列各组溶液,不用其他试剂即能鉴别开的是()A. MgCl 2和 NaOHB. NaCl 和 AgNO 3C. Na 2CO 3和 HClD. AlCl 3 和 KOH解析:从图1与图3的图像差别上不难看出当向氯化铝溶液中滴加氢氧化钠溶液时现象图12 图13图8例1.向30毫升1 moI/L 的AICI 3溶液中逐渐加入浓度为4 mol/L 的NaOH 溶液,若产生0.78克白色沉淀,则加入的 NaOH 溶液的体积可能为()A. 3mLB. 7.5mLC. 15mLD. 27.5mL是先产生白色胶状沉淀,随碱液的加入沉淀又不断消失;而向氢氧化钠溶液中滴加氯化铝溶液时,开始无明显现象后来出现白色胶状沉淀。
故此题答案为 C D。
例3.现有200 mL MgCI 2和AICI3的混合溶液,其中c Mg 二0.2mol / L,c CI 一= 13mol / L,要使Mg2'转化为Mg 0H 2,并使Mg2■与AI3分离开,至少需要4 moI/L的NaOH溶液的体积为( )A. 140mLB. 120mLC. 100mLD. 80mL解析:由题意1c Al3 13mol / L -0.2mol / L 2 I - 0.3mol / L3Mg2 2OH -二Mg OH 2、.n Mg 2件=0.2mol / L 0.2L = 0.04molAl3 4OH 一二AIO2一2H2O3 +n Al = 0.3mol / L 0.2L = 0.06mol需n NaOH 二0.04mol 2 0.06mol 4 = 032 mol贝懦V NaOH 032m°l」-0.08L 4mol • L答案:D例4.将一定质量的Mg Al合金投入100mL一定物质的量浓度的HCI中,合金全部溶解,向所得溶液中滴加 5 mol/L的NaOH溶液至过量,生成的沉淀质量与加入的NaOH溶液的体积关系如图10所示。
求:w.w.w.k.s.5.u.c.o.m(1)原合金中Mg Al质量各多少克。
(2)HCI物质的量浓度。
20160 ISOV(NaOH^AnL图10解析:由图10可知,11.6g是Mg(OH》沉淀的质量, 质量,当V NaOHi;= 2OmL时,中和HCI,无沉淀生成。
(19.4 —116 )g 是AI(OH )3的沉淀ffift gX氢氧化铝沉淀量图像分析第 6页 (共10页)m Mg - 584.8gAl ~ Al OH 327g 78gm(AI)7.8gm Al 二 78 27二 2.7g(2)当 V(NCH ) = 160mL 时,此时 Mg 2+、Al'4全部以 Mg(0H)2、AI(OH )3沉淀v2v 3的形式存在,则溶液中 n Cl 一二n Na = 016 L 5mol / L = 0.8mol ,所以答案:(1) Mg : 4.8g ; Al : 2.7g(2) c HCl i ; = 8mol/ L例5.图11是向MgCI 2、AICI 3混合液中依次加入 M 和N 时生成沉淀的物质的量与加 入的M 和N 的体积关系图(M N 各表示盐酸或氢氧化钠溶液中的一种) ,以下结论不正确的是( )A.混合溶液中 C AICI 3 : c MgCI 2 [=1: 1B. 混合液中 C AICI 3 : C MgCI 2 =3: 1C. V 之前加NaOH 溶液,V 之后加盐酸D. 这种盐酸与NaOH 溶液中溶质的物质的量浓度相同mol图11解析:依所学知识,很容易判断C 是正确的。
设AICI 3物质的量为1 mol ,则生成Al OH 3 3为1 mol ,A — B 段溶解过程消耗 NaOH 也是1 mol (据反应式),由图推知O — V 段每等份相(1) Mg24g m(Mg)Mg OH 258g 11.6gc HCl 二 0.8mol01 L =8mol / L 。
当于NaOH 量为1 mol ,那么O-A 段生成Al OH 3消耗NaOH 应是3 mol ,即3等份,则余 下两等份即2 mol 应生成Mg OH 2所消耗NaOH 量,故Mg OH 2为1 mol , MgCI 2也应 是1 mol ,由此可判断 A 也是正确的,则 B 错误。
对于 D 选项,可分析图像 A 一B , B 一 C 两 段,前者消耗沉淀后者生成沉淀,从而有关系式:Al OH 3 — OH -—AIO -— H ,故可推知n OH 一二n H ,又两段消耗溶液体积相等, 因此不难得出结论:D 选项也是正确的,错误选项只有B 。
例6.向明矶溶液里滴加 Ba OH 2溶液,当SQ 2一恰好完全沉淀时,铝元素的存在形式是 ( )A. 一部分为Al OH 3沉淀,一部分以 Al 3 •形式存在于溶液中B. 一部分为Al OH 3沉淀,一部分以 AIO 2一形式存在溶液中C. 全部为Al OH 3沉淀D. 几乎全部以AIO 2一形式存在于溶液中 解析:从图12不难看出,当SO 2 一完全沉淀时,生成的氢氧化铝沉淀恰好完全溶解, 故此题答案为D 。
w.w.w.k.s.5.u.c.o.m【练习】w.w.w.k.s.5.u.c.o.m2.等体积的AlCl 3和NaOH 两种溶液混合后,沉淀物中含铝元素的质量与溶液中含铝 元素的质量相等,则 AlCl 3和NaOH 两种溶液的物质的量浓度之比是()(1) 1: 3 (2) 2: 3(3) 1 : 4(4) 2: 7A. (1)和(2)B. (1)和(3)C. (2)和(4)D. (3)和(4)1.向含有a mol AlCl 3的溶液中加入含 bmol KOH 的溶液,生成沉淀的物质的量可能是( ) (1) a mol/ 、 b (4) mol3A. (1) (2) (4)C. (1) (2) ( 3) (2) b mol(5) 0 mol (5) (6)B. (5) (6)D.a (3) mol3(6) 4a - b mol(1) (4) (5) (6) (1) (3) (5)3、将3 mol/L NaOH溶液滴入到25 mL 一定浓度的AlCl 3溶液中。
下图是整个过程的数学分析曲线。
其中横轴表示加入OH -的物质的量,纵轴表示产生的Al OH 3沉淀物质的量。
据图示回答下列问题:(1)图中A点表示的意义是_____________ 。
B点表示的意义是 ____________(2)___________________________________________________________________________ 当C点从0点向A点运动时,表示随OH —的不断加入,沉淀量逐渐。