第三章化学势
- 格式:doc
- 大小:62.50 KB
- 文档页数:3

第三章 化学势§3.1 偏摩尔量(1)偏摩尔量的定义多组分系统的任一种容量性质X 可以看作是温度 T 、 压力 p 及各物质的量的函数,X = ƒ(T ,p , n B ,n C ,n D ,…)在定温定压条件下,dT=0,dp=0,则 dX = ΣX B dn BX B 称为物质B 的“偏摩尔量”。
偏摩尔量的物理意义是,在定温定压条件下,往无限大的系统中(可以看作其浓度不变)加入 1mol 物质 B 所引起的系统中某个热力学量 X 的变化,实际上是一偏微商的概念。
§ 3.2 化学势化学势的定义由于等温等压条件下吉布斯自由能的变化值课作为过程方向性的判定,也就是摩尔或偏摩尔吉布斯自由能的降低会推动过程(物质迁移或相变或化学变化)自发进行,故又称偏摩尔吉布斯自由能为化学势。
物质的化学势是决定物质传递方向和限度的强度因素,这就是化学势的物理意义。
§3.3 气体物质的化学势(1)纯组分理想气体的化学势对纯物质系统来说 G B = G mµ = µ θ+ RTln(p/ p θ)此式就是理想气体化学势表达式。
理想气体压力为p θ 时的状态称为标准态, µ θ 称为标准态化学势,它仅是温度的函数。
(2) 理想气体混合物的化学势θθμμpp ln B RT B B += 其中p B 是理想气体混合物中气体B 的分压,μθ是分压p B = p θ 时的化学势,称为气体B 的标准态化学势,它亦仅是温度T 的函数。
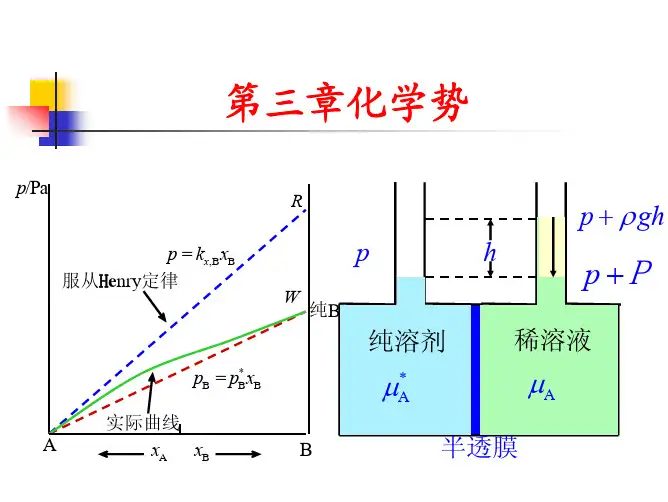
§3.4 理想液态混合物中物质的化学势(1)拉乌尔定律一定温度时,溶液中溶剂的蒸气压 p A 与溶剂在溶液中的物质的量分数X A 成正比,其比例系数是纯溶剂在该温度时的蒸气压 pA (上标“*”表示纯物质) ,称为“拉乌尔定律”。
用数学式可表示为p A = p A *X A此式不仅可适用于两种物质构成的溶液,亦可适用于多种物质构成的溶液。

第3篇化学势化学势,这个在化学领域中被频繁提及的概念,对于许多初学者来说,可能显得有些抽象和难以理解。
它是一个描述物质在化学反应中能量的变化和传递的重要参数,是理解化学反应热力学性质的关键。
那么,化学势究竟是什么呢?它又是如何影响化学反应的呢?我们需要明确化学势的定义。
化学势是一个物质在特定条件下的自由能变化率,它表示了该物质在反应中的能量状态。
简单来说,化学势越高,物质的能量就越高,它就越有可能发生反应。
那么,化学势是如何影响化学反应的呢?化学势决定了物质的反应活性。
当两种物质的化学势相差较大时,它们之间发生反应的可能性就越大。
这是因为化学势高的物质具有更高的能量,它们更倾向于释放能量,从而发生反应。
化学势还影响着反应的方向。
在封闭系统中,化学反应总是朝着化学势降低的方向进行。
这是因为系统会自发地朝着能量更低、更稳定的状态发展。
因此,通过控制化学势,我们可以预测和控制化学反应的方向。
化学势还与反应的平衡状态有关。
在化学反应中,当正反应和逆反应的速率相等时,系统达到平衡状态。
此时,反应物和物的浓度不再发生变化,系统的化学势达到最低。
通过改变反应条件,如温度、压力等,我们可以改变系统的化学势,从而影响反应的平衡状态。
化学势是一个描述物质在化学反应中能量变化的重要参数。
它不仅影响着物质的反应活性,还决定了反应的方向和平衡状态。
理解化学势的概念,对于我们深入理解化学反应的热力学性质具有重要意义。
在深入探讨化学势之前,我们还需要了解化学势与温度、压力等外界条件的关系。
这些外界条件的变化,会直接影响物质的化学势,进而影响化学反应的进行。
温度对化学势的影响。
根据热力学原理,温度的升高会导致物质的分子运动加剧,从而增加物质的化学势。
因此,在高温条件下,化学反应的速率通常会加快,因为反应物分子的碰撞频率和能量都增加了。
然而,对于放热反应来说,温度的升高反而会导致反应速率的降低,因为物的化学势降低了。
压力对化学势的影响。








第三章 化学势
一、单选题
1、关于偏摩尔量,下列说法中错误的是( )
A.偏摩量必须有等温、等压条件
B.只有容量性质才有偏摩尔量,强度性质不可能有偏摩尔量
C.偏摩尔量是两个容量性质之比,它本身是一个强度性质
D.某组分的偏摩尔量不随温度T ,压力p 的变化而变化
2、对于偏摩尔量,指出下列说法错误者( )
(1)偏摩尔量必须有恒温恒压条件;
(2)偏摩尔量不随各组分浓度的变化而变化;
(3)偏摩尔量不随温度T 和压力p 的变化而变化;
(4)偏摩尔量不但随温度T 、压力p 的变化而变化,而且也随各组分浓度变化而变化。
A.(2) (4)
B.(3) (4)
C.(2) (3)
D.(1) (4)
3、在恒定温度与压力p 下,理想气体A 与B 混合后,说法中正确的是( )
(1)A 气体的标准态化学势不变;
(2)B 气体的化学势不变 ;
(3)当A 气体的分压为p A 时,其化学势的改变量为ΔμA =RTln(p A /p ø);
(4)当B 气体的分压为p B 时,其化学势的改变量为ΔμB =-RTln(p B /p*)。
A.(1) (2)
B.(1) (3)
C.(2) (4)
D.(3) (4)
4、298.2K ,1×105Pa ,有两瓶四氯化碳溶液,第一瓶为1dm 3(含有0.2mol 的碘),第二瓶为 2dm 3(含0.4mol 的碘),若以μ1和μ2分别表示两瓶中碘的化学势,则( )
A.μ12=μ2
B.10μ1=μ2
C.μ1=μ2
D.2μ1=μ2
5、在298K ,1×105Pa 下有2dm 3溶有I 2的CCl 4溶液,I 2的化学势为μ1,吉布斯自由能为G 1, 现取出1dm 3溶液,其中I 2的化学势为μ2,吉布斯自由能为G 2,则( )
A.μ1=2μ2、G 1=G 2
B.μ1=2μ2、G 1=2G 2
C.μ1=μ2、G 1=2G 2
D.μ1=μ2、2G 1=G 2
6、下列哪个是化学势( )
A.()j n ,p ,T i n U/∂∂
B.()j n ,p ,T i n H/∂∂
C.()j n ,p ,T i n A/∂∂
D.()j n ,p ,T i n G/∂∂
7、下列各式中哪个是化学势( )
A.()j n ,V ,T i n U/∂∂
B.()j n ,V ,T i n H/∂∂
C.()j n ,V ,T i n A/∂∂
D.()j n ,V ,T i n G/∂∂
8、298K 时从大量浓度为0.01mol·dm 3的溶液中迁移1mol 溶质于另一大量浓度为0.001 mol·dm 3的溶液中,则该过程的Δμ等于(J·mol -1)( )
A.Δμ=RTln(1×10-2);
B.Δμ=RTln(1×10-3);
C.Δμ=RTln0.1;
D.Δμ=RTln10。
9、下列各式哪个不是化学势( )
A.()j n ,p ,T i n G/∂∂
B.()j n ,p ,T i n A/∂∂
C. ()j n ,V ,S i n U/∂∂
D.()j n ,p ,S i n H/∂∂
10、()j
n ,p ,T i n G/∂∂( ) A.只能称为偏摩尔量 B.只能称为化学势
C.既可称为化学势也可称为偏摩尔量
D.首先是B 物质的摩尔吉氏自由能
11、()j
n ,V ,T i n A/∂∂( ) A.只能称为偏摩尔量
B.只能称为化学势
C.既可以称为化学势又可以称为偏摩尔量
D.是B 物质的摩尔赫氏自由能
12、已知水的两种状态A(373K ,101.3kPa ,g),B(373K ,101.3kPa ,l),则μA 与μB 的关系为: ( )
A.μA =μB
B.μA >μB
C.μA <μB
D.两者不能比较
13、实际气体化学位是μ=μø(T)+RTln(γp/p ø)=μø(T)+RTln(f/p ø),则( )
A.f 是气体的真实压力
B.p 是实际气体校正后的压力
C.f 是实际气体校正后的压力,称实际气体的有效压力,即逸度
D.逸度系数γ的数值仅取决于气体的特性,而与温度和压力无关
14、在给定温度下,当p→0时,实际气体的逸度与压力的正确关系式应为( )
A.在p→0时,f<p
B.在p→0时,f/p=1
C.在p→0时,f/p >1
D.在p→0时,f/p <1
15、实际气体化学位表示式为μ=μø(T)+RTln(f/p ø),则( )
A.μ是某一温度下实际气体的真实压力为f 时的化学位
B.μ是某一温度下实际气体的有效压力为γp 即逸度为f 时的化学位
C.f 是实际气体的真实压力
D.μø(T)不仅是温度的函数,也是压力的函数
16、溶剂服从拉乌尔定律及溶质服从亨利定律的二元溶液是( )
A.理想混合物
B.实际溶液
C.理想稀溶液
D.胶体溶液
17、偏摩尔量集合公式∑==k 1B B B n X
X 的适用条件是( )
A.等温、等容各物质的量不变
B.等压、等熵各物质的浓度发生微小改变
C.等温、等容各物质的比例为定值
D.等温、等压各物质浓度不变
18、当不挥发的溶质溶于溶剂形成溶液后,溶液的蒸气压( )
A.升高
B.不变
C.降低
D.升高、降低不一定
19、对于稀溶液中的溶质,下列各式何者不正确?( )
A.p B =k x x B
B.p B =k m m B
C.p B =k c c B
D.p B =k n n B
20、亨利定律的表达式为( )
A.p B =p B *x B
B.p B =k m m B
C.p B =p B *m B /m ø
D.p B =p B *c B /c ø
21、亨利定律适用于( )
A.理想溶液
B.非理想溶液中的溶剂及溶质
C.稀溶液中的溶剂
D.稀溶液中的溶质
22、拉乌尔定律适用于( )
A.非理想溶液中的溶剂
B.稀溶液中的溶质;
C.稀溶液中的溶剂
D.稀溶液中的溶剂及溶质
23、过饱和溶液中溶剂的化学势比纯溶剂的化学势()
A.高
B.低
C.相等
D.0.56
二、计算题
1、有一水和乙醇形成的均相混合物,水的物质的量分数0.4,乙醇的偏摩尔体积为57.5
cm3·mol-1,混合物的密度为0.8494g·cm-3。
试计算混合物中水的偏摩尔体积。
2、在373K时,己烷和辛烷能形成理想混合物,己烷的蒸气压为245.0kPa,辛烷为47.10kPa。
若某组成的该液态混合物,在标准压力下,于373K时沸腾,问:
(1)液相的组成为多少?
(2)平衡气相的组成又是怎样?
3、293K时,NH3与H2O按1:8.5组成的溶液A上方的蒸气压为10.64kPa,而按1:21组
成的溶液B上方的蒸气压为3.597kPa。
(1)293K时,从大量的溶液A中转移1molNH3到大量的溶液B中的ΔG m为多少?
(2)293K时,若将101.325kPa的1molNH3溶解于大量的溶液B中,求ΔG m为多少?
4、苯和甲苯形成理想溶液。
在20℃时,纯苯的蒸气压是9960Pa,纯甲苯的蒸气压是973Pa,
求20℃时等质量的苯和甲苯混合物上苯的分压、甲苯的分压、总压。