物理化学习题第三章化学势
- 格式:docx
- 大小:294.89 KB
- 文档页数:57


第5章溶液体系热力学与化学势1.0.022 st1:chmetcnv TCSC="0" NumberType="1" Negative="False" HasSpace="True" SourceValue="5" UnitName="kg">5 kg Na2CO3·10H2O溶于水中,溶液体积为0.2 dm3,溶液密度为1.04 kg·dm-3,求溶质的质量分数,质量摩尔浓度,物质的量浓度和摩尔分数表示的浓度值。
(答案:wt% = 4.007%,m = 0.3938 mol·kg-1,c = 0.3932 mol·dm-3,x = 7.045×10 –3)解:M Na2CO3 = 105.99×10-3 kg·mol-1M Na2CO3 · H2O = 286.14×10-3 kg·mol-1W(总)= 1.04×0.2 = 0.208kgn Na2CO3= 0.02259/(286.14×10-3)= 0.07863 molW Na2CO3= 0.07863×105.99×10-3 = 8.334×10-3 kgn Na2CO3 ·10 H2O = n Na2CO3 = 0.0225×103/286.14 = 0.07863 molW H2O =(208—8.344)×10-3 = 199.666×10-3 kgn H2O=(199.666×103)/(18.015×103)= 11.083mol质量百分数:wt%=[(8.334×10-3)/0.208] ×100% = 4.007%质量摩尔浓度:m Na2CO3 = 0.07863/(199.666×10-3)= 0.3938 mol·kg-1物质的量浓度:c = n Na2CO3/V = 0.07863/0.2 = 0.3932 mol·dm-3物质的量分数:x Na2CO3 = 0.07863/(0.07863+11.083)= 7.045×10-32.293.15 K时,质量分数为60 %的甲醇水溶液的密度是0.894 6 kg·dm-3,在此溶液中水的偏摩尔体积为1.68×10-2dm3·mol-1。

第三章 多组分系统热力学一.选择题:选择正确答案的编号,填在各题后的括号内:1.下面各个偏导式中,哪个是偏摩尔量( ) A.j n T p Bn ,,⎪⎪⎭⎫⎝⎛∂∂μ B.jn V S B n U ,,⎪⎪⎭⎫ ⎝⎛∂∂ C. jn T p B m n S ,,⎪⎪⎭⎫ ⎝⎛∂∂ D. j n T p B n V ,,⎪⎪⎭⎫ ⎝⎛∂∂ 2.下面各个偏导式中,哪个不是化学势( ) A. jn V S B n U ,,⎪⎪⎭⎫⎝⎛∂∂ B. jn p T Bn H ,,⎪⎪⎭⎫ ⎝⎛∂∂ C. jn p T Bn G ,,⎪⎪⎭⎫ ⎝⎛∂∂ D. jn V T Bn F ,,⎪⎪⎭⎫ ⎝⎛∂∂ 3.理想液态混合物中任一组分B,其偏摩尔量和摩尔量的关系为( )A. B H =*B m H , B. B V VBm *≠, C. B G =*B m G , D. B S =*B m S ,4.一定温度下,纯液体A 的饱和蒸汽压为pA*,化学势为*A μ,凝固点为*f T ,当A 中加入少量不挥发性溶质后,上述三个量p A,μA,Tf,它们的关系为( )A, p A*<pA*A μ<μA*f T <TfB. p A*>pA*A μ <μA*f T <TfC. p A*<pA*A μ<μA*f T >T fD.p A*>pA *A μ>μA*f T >Tf5.一定温度和压力下的乙醇水溶液中,若使乙醇的偏摩尔体积的变化dV>0.此时水的偏摩尔体积的变化dV水( )A. >0B.=0C. <0D.不能确定 6.对多组分体系中B 物质的偏摩尔量XB=Bj n p T Bn X ≠⎪⎪⎭⎫⎝⎛∂∂,,,下列叙述中不正确的是( ) A.X B是无限大量体系中B 物质每变化1 mol 时该体系容量性质X 的变化量B.X 为容量性质, XB也为容量性质C.XB不仅取决于T,p,而且取决于浓度D.X=X n B B ∑7.将固体NaCl 投放到水中, NaCl 逐渐溶解,最后达到饱和.开始溶解时溶液中的NaCl 的化学式为µ(a),饱和时溶液中NaCl 的化学势为µ(b),固体NaCl 的化学势为,则( ) A. µ(a)= µ(b)< µ(c) B. µ(a)= µ(b)> µ(c) C. µ(a)> µ(b)= µ(c) D. µ(a)<µ(b)= µ(c) 8.下列物理量中,( )既是偏摩尔量,又是化学势. A. Bj n p T Bn F ≠⎪⎪⎭⎫⎝⎛∂∂,, B. Bj n p S Bn H ≠⎪⎪⎭⎫ ⎝⎛∂∂,, C. Bj n p T Bn G ≠⎪⎪⎭⎫ ⎝⎛∂∂,, D. Bj n p S Bn U ≠⎪⎪⎭⎫ ⎝⎛∂∂,, 9.理想液态混合物的通性是( ) A 、 ΔV 混合=0 ΔH 混合=0 ΔS 混合>0 ΔG 混合<0 B 、 ΔV 混合=0 ΔH 混合=0 ΔS 混合>0 ΔG 混合=0 C 、 ΔV 混合> 0 ΔH 混合> 0 ΔS 混合>0 ΔG 混合<0 D 、 ΔV 混合=0 ΔH 混合=0 ΔS 混合=0 ΔG 混合=0 10.7、298K 时A 和B 两种气体在某一溶剂中溶解的亨利系数分别为kA 和kB ,且kA>kB ,则当A 和B 压力相同时,在该溶剂中溶解的量是 ( ) A 、 A 的量大于B 的量 B 、 A 的量小于B 的量 C 、 A 的量等于B 的量D 、 A 的量和B 的量无法比较11、313K 时纯液体A 的饱和蒸汽压是纯液体B 的21倍,A 和B 能形成理想液态混合物。



第三章 习题解答1. 在298 K 和标准压力下,含甲醇(B)的摩尔分数x B 为0.458的水溶液的密度为0.89463kg dm -⋅,甲醇的偏摩尔体积313(CH OH)39.80 cm mol V -=⋅,试求该水溶液中水的偏摩尔体积2(H O)V 。
解:3322(CH OH)(CH OH)(H O)(H O)V n V n V =+3330.45832(10.458)18()dm 0.02729 dm 0.894610mV ρ⨯+-⨯===⨯ 3313120.027290.45839.8010(H O)() cm mol 16.72 cm mol 10.458V ----⨯⨯=⋅=⋅-2. 298 K 和标准压力下,有一甲醇物质的量分数为0.4的甲醇-水混合物。
如果往大量的此混合物中加入1 mol 水,混合物的体积增加17.35 cm 3;如果往大量的此混合物中加1 mol 甲醇,混合物的体积增加39.01 cm 3。
试计算将0.4 mol 的甲醇和0.6 mol 的水混合时,此混合物的体积为若干?此混合过程中体积的变化为若干?已知298 K 和标准压力下甲醇的密度为0.79113g cm -⋅,水的密度为0.99713g cm -⋅。
解:312(H O)17.35cm mol V -=⋅313(CH OH)39.01 cm mol V -=⋅33322(CH OH)(CH OH)(H O)(H O)26.01 cm V n V n V =+=混合前的体积为:33[(18/0.9971)0.6(32/0.7911)0.4] cm 27.01 cm ⨯+⨯=31.00 cm V ∆=3. 298 K 时,K 2SO 4在水溶液中的偏摩尔体积V B 与其质量摩尔浓度的关系式为:1/2B 32.28018.220.222V m m =++,巳知纯水的摩尔体积V A , m = 17.96 cm 3·mol -1,试求在该溶液中水的偏摩体积与K 2SO 4浓度m 的关系式。

第三章多组分系统热力学及其在溶液中的应用一、基本公式和内容提要1. 偏摩尔量定义:其中X为多组分系统的任一种容量性质,如V﹑U﹑S......全微分式:总和:偏摩尔量的集合公式:2. 化学势定义物质的化学势是决定物质传递方向和限度的强度因素,是决定物质变化方向和限度的函数的总称,偏摩尔吉布斯函数只是其中的一种形式。
3. 单相多组分系统的热力学公式4. 化学势判据等温等压、只做体积功的条件下将化学势判据用于多相平衡和化学平衡中,得多组分系统多相平衡的条件为:化学平衡的条件为:5.化学势与温度、压力的关系(1)化学势与压力的关系(2)化学势与温度的关系6.气体的化学势(1)纯组分理想气体的化学势理想气体压力为(标准压力)时的状态称为标准态,称为标准态化学势,它仅是温度的函数。
(2)混合理想气体的化学势式中:为物质B的分压;为物质B的标准态化学势;是理想气体混合物中B组分的摩尔分数;是B纯气体在指定T,p时的化学势,p是总压。
(3)实际气体的化学势式中:为实际气体或其混合物中物质B的化学势;为B的标准态化学势,其对应状态是B在温度T、压力、且假想具有理想气体行为时的状态,这个状态称为实际气体B的标准态;分别为物质B的逸度系数和逸度。
7. 稀溶液中的两个经验定律(1)拉乌尔定律一定温度时,溶液中溶剂的蒸气压与溶剂在溶液中的物质的量分数成正比,其比例系数是纯溶剂在该温度时的蒸气压。
用公式表示为。
对二组分溶液来说,,故拉乌尔定律又可表示为即溶剂蒸气压的降低值与纯溶剂蒸气压之比等于溶质的摩尔分数。
(2)亨利定律一定温度时,稀溶液中挥发性溶质的平衡分压与溶质在溶液中的物质的量分数成正比。
用公式表示。
式中:为溶质的浓度分别为摩尔分数、质量摩尔浓度和物质的量浓度表示时的亨利系数,单位分别为Pa、和。
使用亨利定律时应注意:①是溶质在液面上的分压;②溶质在气体和在溶液中的状态必须是相同的。
8.溶液的化学势(1)理想液态混合物中物质的化学势①定义:在一定的温度和压力下,液态混合物中任意一种物质在任意浓度均遵守拉乌尔定律的液态混合物称为理想液态混合物。


第三章 化学反应系统热力学 (习题答案) 2007-6-6§3.1 标准热化学数据 练习1 所有单质的 Om f G ∆ (T )皆为零?为什么?试举例说明?答:所有处于标准状态的稳定单质的O m f G ∆ (T )(因为生成稳定单质,稳定单质的状态未发生改变);如单质碳有石墨和金刚石两种,O m f G ∆ (298.15K ,石墨,)=0kJmol -1.而O m f G ∆ (298.15K ,金刚石,)=2.9kJmol -1, (课本522页),石墨到金刚石状态要发生改变,即要发生相变,所以O m f G ∆ (298.15K ,金刚石,)=2.9kJmol -1,不等于零。
2 化合物的标准生成热(焓)定义成:“由稳定单质在298.15K 和100KPaPa 下反应生成1mol 化合物的反应热”是否准确?为什么?答:单独处于各自标准态下,温度为T 的稳定单质生成单独处于标准态下、温度为T 的1mol 化合物B 过程的焓变。
此定义中(1)强调压力为一个标准大气压,而不强调温度;(2)变化前后都单独处于标准态。
所以题中的定义不准确,3 一定温度、压力下,发生单位化学反应过程中系统与环境交换的热Q p 与化学反应摩尔焓变n r H ∆是否相同?为什么?答: 等压不作其他功时(W ’=0),数值上Q p =n r H ∆; Q p 是过程量,与具体的过程有关,而n r H ∆是状态函数与过程无关,对一定的化学反应有固定的数值;如将一个化学反应至于一个绝热系统中Q p 为零,但n r H ∆有确定的数值。
§3.2 化学反应热力学函数改变值的计算. 练习1 O m r G ∆(T ),m r G ∆(T ),Om f G ∆(B ,相态,T )各自的含义是什么?答:Om r G ∆(T ): 温度为T ,压力为P θ,发生单位反应的ΔG;m r G ∆(T ): 温度为T ,压力为P ,发生单位反应的ΔG;Omf G ∆(B ,相态,T ): 温度为T ,压力为P θ,由各自处于标准状态下的稳定单质,生成处于标准态1mol 化合物反应的ΔG;2 25℃时,H 2O(l)及H 2O(g)的标准摩尔生成焓分别为-285.838及-241.825kJ mol -1 。

第三章 化学平衡测试练习题选择题:1、化学反应若严格遵循体系的“摩尔吉布斯函数—反应进度”曲线进行,则该反应在( A )[A].曲线的最低点[B].最低点与起点或终点之间的某一侧[C].曲线上的每一点[D].曲线以外某点进行着热力学可逆过程.2、有一理想气体反应A+B=2C ,在某一定温度下进行,按下列条件之一可以用θm r G ∆直接判断反应方向和限度:( C )[A].任意压力和组成[B].总压101.325kPa ,物质的量分数31===C B A x x x [C].总压303.975kPa ,31===C B A x x x [D].总压405.300kPa ,41==B A x x ,21=C x 3、298K 的理想气体化学反应AB=A+B ,当温度不变,降低总压时,反应的转化率( A )[A].增大 [B].减小 [C].不变 [D].不能确定4、已知气相反应)()(3)(126266g H C g H g H C =+在373K 时的143.192-⋅-=∆mol kJ H mr θ,当反应达平衡时,可采用下列哪组条件,使平衡向右移动( C )[A].升温与加压 [B].升温与减压[C].降温与加压 [D].降温与减压5、化学反应的平衡状态随下列因素当中的哪一个面改变? ( A )[A].体系组成 [B].标准态 [C].浓度标度[D].化学反应式中的计量系数νB6、在相同条件下有反应式(1)C B A 2=+,(θ1,m r G ∆);(2) C B A =+2121,(θ2,m r G ∆)则对应于(1),(2)两式的标准摩尔吉不斯函数变化以及平衡常数之间的关系为:( B )[A].θθ2,1,2m r m r G G ∆=∆,θθ21K K =[B].θθ2,1,2m r m r G G ∆=∆,221)(θθK K =[C].θθ2,1,m r m r G G ∆=∆,221)(θθK K =[D].θθ2,1,m r m r G G ∆=∆,θθ21K K = 7、反应)()()()(222g H g CO g O H g CO +=+,在600℃、100 kPa 下达到平衡后,将压力增大到5000kPa ,这时各气体的逸度系数为09.12=CO γ,10.12=H γ,23.1=CO γ,77.02=O H γ。
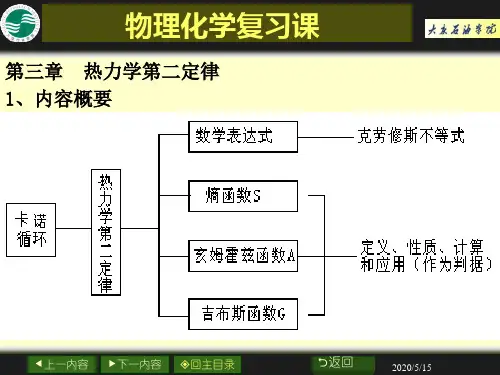
第三章化学势一.基本要求1.了解混合物得特点,熟悉多组分系统各种组成得表示法。
2.掌握偏摩尔量得定义与偏摩尔量得加与公式及其应用。
3.掌握化学势得狭义定义,知道化学势在相变与化学变化中得应用。
4.掌握理想气体化学势得表示式,了解气体标准态得含义。
5.掌握Roult定律与Henry定律得含义及用处,了解它们得适用条件与不同之处。
6.了解理想液态混合物得通性及化学势得表示方法,了解理想稀溶液中各组分化学势得表示法。
7.了解相对活度得概念,知道如何描述溶剂得非理想程度,与如何描述溶质在用不同浓度表示时得非理想程度。
8.掌握稀溶液得依数性,会利用依数性来计算未知物得摩尔质量。
二.把握学习要点得建议混合物就是多组分系统得一种特殊形式,各组分平等共存,服从同一个经验规律(即Rault定律),所以处理起来比较简单。
一般就是先掌握对混合物得处理方法,然后再扩展到对溶剂与溶质得处理方法。
先就是对理想状态,然后扩展到对非理想得状态。
偏摩尔量得定义与化学势得定义有相似之处,都就是热力学得容量性质在一定得条件下,对任一物质B得物质得量得偏微分。
但两者有本质得区别,主要体现在“一定得条件下”,即偏微分得下标上,这一点初学者很容易混淆,所以在学习时一定要注意它们得区别。
偏摩尔量得下标就是等温、等压与保持除B以外得其她组成不变()。
化学势得下标就是保持热力学函数得两个特征变量与保持除B 以外得其她组成不变。
唯独偏摩尔Gibbs自由能与狭义化学势就是一回事,因为Gibbs自由能得特征变量就是,偏摩尔量得下标与化学势定义式得下标刚好相同。
多组分系统得热力学基本公式,比以前恒定组成封闭系统得基本公式,在最后多了一项,这项表示某个组成B得物质得量发生改变时所引起得相应热力学函数值得改变。
最后一项中化学势就是常数,说明得改变并不就是随意得,在数量一定得系统中只发生了得变化,或在数量很大得系统中改变了1 mol,这样才能维持不变。
单组分理想气体得化学势就是温度与压力得函数,即。
化学势习题及答案化学势习题及答案化学势是描述化学系统中组分的自由能变化的重要物理量。
在化学反应中,化学势的变化决定了反应的方向和速率。
因此,理解和掌握化学势的概念和计算方法对于化学学习和研究具有重要意义。
本文将介绍一些化学势的习题,并给出详细的解答。
1. 习题一:已知一化学反应的化学势变化为ΔG = -20 kJ/mol,求该反应的平衡常数K。
解答:根据化学势与平衡常数的关系,有ΔG = -RTlnK,其中ΔG为化学势变化,R为气体常数,T为温度,K为平衡常数。
将已知的数值代入,得到-20 = -8.314*T*lnK。
解方程可得lnK = 2.409,进一步计算可得K ≈ 11.14。
2. 习题二:已知一化学反应的平衡常数K = 2.5×10^3,求该反应的化学势变化ΔG。
解答:根据化学势与平衡常数的关系,有ΔG = -RTlnK。
将已知的数值代入,得到ΔG = -8.314*T*ln(2.5×10^3)。
考虑到温度T未知,无法直接计算出ΔG的具体数值,但可以通过该公式判断化学势变化的方向。
当K大于1时,lnK为正,ΔG为负,表示反应向右进行;当K小于1时,lnK为负,ΔG为正,表示反应向左进行。
3. 习题三:已知一化学反应的化学势变化为ΔG = -15 kJ/mol,温度为298 K,求该反应的标准反应焓变ΔH和标准反应熵变ΔS。
解答:根据热力学基本关系ΔG = ΔH - TΔS,其中ΔG为化学势变化,ΔH为标准反应焓变,ΔS为标准反应熵变,T为温度。
将已知的数值代入,得到-15 =ΔH - 298ΔS。
由此方程可以看出,无法直接计算出ΔH和ΔS的具体数值,但可以通过该方程判断ΔH和ΔS的相对大小。
如果ΔH的绝对值远大于T乘以ΔS 的绝对值,那么ΔG的绝对值也会远大于0,表示该反应是放热的;反之,如果ΔH的绝对值远小于T乘以ΔS的绝对值,那么ΔG的绝对值也会远小于0,表示该反应是吸热的。
物理化学化学势物理化学化学势是物理化学中的一个重要概念,它描述了物质在平衡状态下的化学势与温度、压力和其他物质化学势之间的关系。
化学势被广泛应用于化学、生物学和工程领域,如化学反应平衡的计算、相变过程的模拟和材料性能的预测等。
在物理化学中,化学势被定义为在一定温度和压力下,物质在无限稀释的条件下所具有的化学势。
它反映了物质在平衡状态下与其他物质之间的相互作用,以及物质在系统中的自由能变化。
计算化学势需要考虑到物质的性质和环境条件。
对于理想气体,化学势与温度和压力成正比,可以用公式表示为:μi=μi0+RTlnπi。
其中,μi表示物质i的化学势,μi0表示物质i的标准化学势,R表示气体常数,T表示温度,πi表示物质i的分压。
在实际应用中,化学势的计算还需要考虑物质的性质和状态。
例如,在凝聚态物质中,化学势与物质的浓度和活度有关,可以用活度系数来描述。
对于复杂反应体系,化学势的计算需要考虑到各种反应的平衡常数和反应速率等。
化学势在化学和生物学中有广泛的应用。
例如,通过计算化学势可以确定化学反应的平衡常数和反应速率,进而预测化学反应的结果。
在生物学中,化学势可以用来描述生物体内的代谢过程和物质传输过程。
总之,物理化学化学势是描述物质在平衡状态下自由能变化的重要概念。
通过计算化学势可以深入理解物质的性质和行为,为实际应用提供重要的理论依据。
物理化学化学势练习题物理化学化学势练习题一、选择题1、在下列哪个条件下,两种物质的化学势相等? A. 在不同温度和压力下 B. 在相同温度和压力下 C. 在相同温度和不同的压力下 D. 在不同温度和不同的压力下2、以下哪种情况可能会导致化学势发生变化? A. 加入一种新的物质 B. 改变温度 C. 改变压力 D. 以上都是二、填空题1、当一个化学反应达到平衡状态时,____的化学势相等。
2、化学势是____的函数。
3、在一个封闭的系统中,当温度和压力不变时,化学势随物质浓度的变化而变化,这是因为____。
第三章化学势一.基本要求1•了解混合物的特点,熟悉多组分系统各种组成的表示法。
2. 掌握偏摩尔量的定义和偏摩尔量的加和公式及其应用。
3. 掌握化学势的狭义定义,知道化学势在相变和化学变化中的应用。
4. 掌握理想气体化学势的表示式,了解气体标准态的含义。
5. 掌握RoUIt定律和Henry定律的含义及用处,了解它们的适用条件和不同之处。
6. 了解理想液态混合物的通性及化学势的表示方法,了解理想稀溶液中各组分化学势的表示法。
7. 了解相对活度的概念,知道如何描述溶剂的非理想程度,和如何描述溶质在用不同浓度表示时的非理想程度。
8. 掌握稀溶液的依数性,会利用依数性来计算未知物的摩尔质量。
二.把握学习要点的建议混合物是多组分系统的一种特殊形式,各组分平等共存,服从同一个经验规律(即Rault定律),所以处理起来比较简单。
一般是先掌握对混合物的处理方法,然后再扩展到对溶剂和溶质的处理方法。
先是对理想状态,然后扩展到对非理想的状态。
偏摩尔量的定义和化学势的定义有相似之处,都是热力学的容量性质在一定的条件下,对任一物质B的物质的量的偏微分。
但两者有本质的区别,主要体现在“一定的条件下”,即偏微分的下标上,这一点初学者很容易混淆,所以在学习时一定要注意它们的区别。
偏摩尔量的下标是等温、等压和保持除B以外的其他组成不变(CHB )。
化学势的下标是保持热力学函数的两个特征变量和保持除B 以外的其他组成不变。
唯独偏摩尔GibbS自由能与狭义化学势是一回事,因为GibbS自由能的特征变量是T,p ,偏摩尔量的下标与化学势定义式的下标刚好相同。
多组分系统的热力学基本公式,比以前恒定组成封闭系统的基本公式,在最后多了一项,这项表示某个组成B的物质的量发生改变dn B时所引起的相应热力学函数值的改变。
最后一项中化学势J B是常数,说明dn B的改变并不是随意的,在数量一定的系统中只发生了dn B的变化,或在数量很大的系统中改变了1 mol, 这样才能维持JB不变。
单组分理想气体的化学势是温度和压力的函数,即Λ(T, P^ ∙l(T) RTln P。
等式右边的第一项」(T),是当P=P时的化学势,P它仅是温度的函数,这个状态就是气体的标准态,即气体的压力等于标准压力时而还能作为理想气体处理的那个状态。
第二项是 RT In卫,P是理想气体的实P际压力。
记住了这个化学势的表示式,其余气体的化学势表示式只要在这基础上略作修改即可。
例如,混合理想气体中B组分的化学势,只要将压力P改为B 物质的分压P B即可;如果是非理想气体,则将压力 P改为逸度P也就行了。
掌握化学势的表示式,是因为今后在导出化学反应等温式、标准平衡常数的定义式等都要用到化学势的表示式,这样才能完成热力学的判断化学变化的方向和限度的任务。
稀溶液与混合物不同,有溶剂和溶质之分。
溶剂服从Rault定律,由此可以计算溶剂的分压和由于非挥发性溶质的加入使溶剂蒸气压降低的分数,溶剂蒸气压的降低分数与溶质的摩尔分数成正比。
正由于溶剂蒸气压降低这个原因,才出现了溶液凝固点降低、沸点升高和渗透现象等一系列依数性质。
在稀溶液中表示溶质的化学势时,当溶质用不同浓度表示时,要选择不同的标准态,而且这些标准态都是假想的,初学时对这个问题会产生疑问。
其实对这个问题不必过于强调,通常不会去计算标准态的化学势,而是选择了共同的标准态以后,在求热力学函数的变量时,可以将这些相同的标准态销掉,标准态仅仅是共同的参考状态而已。
需要搞清楚的是:在稀溶液中,溶剂和溶质的化学势的表示式是不同的,它们的标准态也是不同的,要分别进行计算。
溶质的化学势在用不同浓度表示时,化学势的表示式是不同的,所选择的标准态也是不同的,但是,最后得到的化学势的数值是相同的,化学势的数值不会因为选择的标准态不同而不同。
在稀溶液中,产生依数性的本质是由于非挥发性溶质的加入,减少了溶剂分子占据的表面,降低了溶剂的蒸汽压。
依数性只与粒子的数量有关,而与粒子的性质无关。
测定凝固点下降值、沸点升高值或渗透压等,主要用来计算溶质的摩尔质量。
而有一点需要弄清楚的是:凝固点和沸点仍是指溶液中溶剂的凝固点和沸点,析出的固体是纯溶剂的固体(如冰,其中不含溶质),蒸气也是纯溶剂的蒸气,只有当溶剂的蒸气压等于大气压力时,溶液才会沸腾。
对于非理想的溶液,只要用相对活度来代替相应的浓度,则化学势的表示式基本保持不变。
由于绝对活度用得较少,所以本教材只引入了相对活度的概念。
如果溶质是非电解质,当活度因子趋向于1时,活度与浓度在数值上相同。
但是, 如果溶质是电解质,就是活度因子都趋向于1,而活度与浓度在数值上也不可能相同,这就为今后学习电解质溶液的活度留一个伏笔。
三.思考题参考答案1. 偏摩尔量与摩尔量有什么异同?答:对于单组分系统,只有摩尔量,而没有偏摩尔量。
或者说,在单组分系统中,偏摩尔量就等于摩尔量。
只有对多组分系统,物质的量也成为系统的变量,当某物质的量发生改变时,也会引起系统的容量性质的改变,这时才引入了偏摩尔量的概念。
系统总的容量性质要用偏摩尔量的加和公式计算,而不能用纯的物质的摩尔量乘以物质的量来计算。
2. 什么是化学势?与偏摩尔量有什么区别?答:化学势的广义定义是:保持某热力学函数的两个特征变量和除B以外的其他组分不变时,该热力学函数对B物质的量n B求偏微分。
通常所说的化学势是指它的狭意定义,即偏摩尔GibbS自由能,即在等温、等压下,保持除B以外的其它物质组成不变时,GibbS自由能随B物质的量的改变的变化率称为化学势。
用公式表示为:Bτ, p,c n B)偏摩尔量是指,在等温、等压条件下,保持除B以外的其余组分不变,系统的广度性质X随组分B的物质的量n B的变化率,称为物质B的某种广度性质X 的偏摩尔量,用X B表示。
也可以看作在一个等温、等压、保持组成不变的多组分系统中,当n B =1 mol时,物质B所具有的广度性质X B,偏摩尔量的定义式为defX BQ B丿τ, p,n c(C 弄)化学势与偏摩尔量的定义不同,偏微分的下标也不同。
但有一个例外,即GibbS自由能的偏摩尔量和化学势是一回事,狭意的化学势就是偏摩尔GibbS自由能。
3. ROUlt定律和Henry定律的表示式和适用条件分别是什么?答:Roult定律的表示式为:P A = P A X A。
式中P A为纯溶剂的蒸气压,P A为溶液中溶剂的蒸气压,X A为溶剂的摩尔分数。
该公式用来计算溶剂的蒸气压P A。
适用条件为:定温、稀溶液、非挥发性溶质,后来推广到液态混合物。
Henry 定律的表示式为:P B= k x,B xk m,B m B= k c,B c B。
式中kχ,B,k m,B 和k c,B分别是物质B用不同浓度表示时的Henry系数,Henry系数与温度、压力、溶质和溶剂的性质有关。
适用条件为:定温、稀溶液、气体溶质,溶解分子在气相和液相有相同的分子状态。
对于液态混合物,Henry定律与Roult定律是等效的,Henry系数就等于纯溶剂的饱和蒸气压。
4. 什么是稀溶液的依数性?稀溶液有哪些依数性?答:稀溶液依数性是指在溶剂的种类和数量固定后,这些性质只取决于所含溶质粒子的数目,而与溶质的本性无关。
稀溶液中由于溶剂的蒸气压降低,因而导致如下依数性质:(1)凝固点下降;(2)沸点升高;(3)渗透压。
5. 溶液的化学势等于溶液中各组分的化学势之和,这样说对不对?答:不对。
化学势是某组分的偏摩尔GibbS自由能。
溶液中可以分为溶剂的化学势或溶质的化学势,而没有整个溶液的化学势。
6. 对于纯组分,它的化学势就等于其GibbS自由能,这样说对不对?答:不对,至少不完整。
应该说,某个纯组分的化学势就等于其摩尔GibbS 自由能7•在同一稀溶液中,溶质B的浓度可用X B,m∣B和C B表示,则其标准态的选择也就不同,那相应的化学势也不同,这样说对不对?答:不对。
溶质的浓度表示方式不同,则所取的标准态(即那个假想状态)也不同,它们在那个假想状态时的化学势是不相等的。
但是,B物质在该溶液中的化学势只有一个数值,是相同的。
8.二组分理想溶液的总蒸气压,一定大于任一组分的蒸气分压,这样说对不对?答:对。
因为二组分理想溶液的总蒸气压等于两个组分的蒸气压之和。
9•在室温下,物质的量浓度相同的蔗糖溶液与食盐水溶液的渗透压是否相等’答:不相等。
渗透压是溶液依数性的一种反映。
依数性只与粒子的数目有关,而与粒子的性质无关。
食盐水中,NaCl会离解成两个离子,所以物质的量浓度相同的食盐水的渗透压可以是蔗糖溶液渗透压的两倍。
10. 农田中施肥太浓时植物会被烧死。
盐碱地的农作物长势不良,甚至枯萎, 试解释其原因?答:这是由于H2O(I)在庄稼的细胞内和土壤中的化学势不等,发生渗透造成的。
当土壤中肥料或盐类的浓度大于植物细胞内的浓度时,H2O(I)在植物细胞中的化学势比在土壤中的要高,水就要通过细胞壁向土壤中渗透,所以植物就会枯萎,甚至烧死。
11. 液态物质混合时,若形成液态混合物,这时有哪些主要的混合性质?答:混合时体积不变,总体积等于各个纯液态物质体积的加和;焓值不变;混合熵增加;混合GibbS自由能下降,即:L miX V =0, 1- mix H =0, L miX S >0, L miX G <012. 北方人冬天吃冻梨前,将冻梨放入凉水中浸泡,过一段时间后冻梨内部解冻了,但表面结了一层薄冰。
试解释原因?答:凉水温度比冻梨温度高,可使冻梨解冻。
冻梨含有糖分,故冻梨内部的凝固点低于水的冰点。
当冻梨内部解冻时,要吸收热量,而解冻后的冻梨内部温度仍略低于水的冰点,所以冻梨内部解冻了,而冻梨表面上仍凝结一层薄冰。
四•概念题参考答案1. 2 mol A物质和3 mol B物质在等温、等压下,混合形成理想液态混合物,-:.:1 3 3. 2 4 0.5 6 6.62 0. 5 kPa 9 9. 9 3 kPa该系统中A 和B 的偏摩尔体积分别为1.79 ×0-5 m 3mol -1, 2.15 ×0-5 m 3mol 则混合物的总体积为 5 3 (A) 9.67 ×0- m -4 3 (C) 1.003 ×0 m 答:(C)。
运用偏摩尔量的加和公式V = n V+ nV 答:(A )。
根据偏摩尔量定义,凡是容量性质才有偏摩尔量,而且一定要符 合等温、等压、除B 以外的其他组成不变时,某容量性质随物质 B 的物质的量 的变化率,才能称为偏摩尔量,只有(A )符合。
3.下列偏微分中,不是化学势的是 ( )答:(B )。
化学势的广义定义是,在保持某热力学函数相应的两个特征变量 和除B 以外的其他组分不变的情况下,该热力学函数对∏B 求偏微分称为化学势 焓的两个特征变量是S l P ,所以(B )是偏摩尔量,而不是化学势4.已知373 K 时,液体A 的饱和蒸气压为133.24 kPa,液体B 的饱和蒸气 压为66.62 kPa=设A 和B 形成理想液态混合物,当 A 在溶液中的摩尔分数为0.5时,在气相中A 的摩尔分数y A 等于( ) 12/3用Roult 定律算出总蒸气压,再把 P = P A X A P B X ( ) 5 3 (B) 9.85 ×0-m 5 3(D) 8.95 ×0- m 2. =2 1. 79 3 2. 1 53 130 m 1. 0 03 1 0 mF 列偏微分中,能称为偏摩尔量的是Cn B .T,p,n c (C 尹) (B) -n B S,p,n c (C_-B)(C ) :GJ n Bp,V,n C (^B) (D).S n B T ,H ,n C (^B) (B )IE n B .片,p,n c (C≠B)(C)(D) CA IF n B 力,V,∏C (C 尹)(A) (C) 答:(C)<(B ) 1/2 (D ) 1/3 A 的蒸气压除以总蒸气压。