重要有机物之间的相互转化(精选)
- 格式:ppt
- 大小:871.00 KB
- 文档页数:10
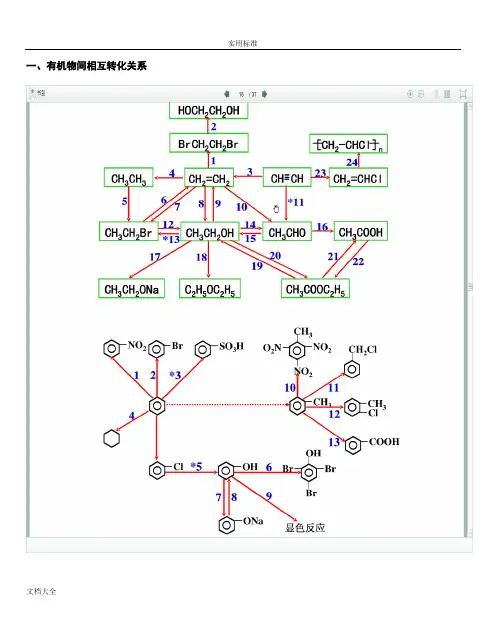
一、有机物间相互转化关系二、能与溴水发生化学反应而使溴水褪色或变色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等)⑷ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑸ 天然橡胶(聚异戊二烯)2、无机物:⑴ -2价的S (硫化氢及硫化物)⑵ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑶ + 2价的Fe6FeSO 4 + 3Br 2 = 2Fe 2(SO 4)3 + 2FeBr 36FeCl 2 + 3Br 2 = 4FeCl 3 + 2FeBr 32FeI 2 + 3Br 2 = 2FeBr 3 + 2I 2⑷ Zn 、Mg 等单质 如 ⑸ -1价的I (氢碘酸及碘化物)变色 ⑹ NaOH 等强碱、Na 2CO 3和AgNO 3等盐 Br 2 + H 2O = HBr + HBrO2HBr + Na 2CO 3 = 2NaBr + CO 2↑+ H 2O HBrO + Na 2CO 3 = NaBrO + NaHCO 3三、能萃取溴而使溴水褪色的物质上层变无色的(ρ>1):卤代烃(CCl 4、氯仿、溴苯等)、CS 2等;下层变无色的(ρ<1):直馏汽油、煤焦油、苯及苯的同系物、低级酯、液态环烷烃、液态饱和烃(如己烷等)等 四、能使酸性高锰酸钾溶液褪色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等) ⑷ 醇类物质(乙醇等)⑸ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑹ 天然橡胶(聚异戊二烯) ⑺ 苯的同系物变色 Mg + Br 2 === MgBr 2 (其中亦有Mg 与H +、Mg 与HBrO 的反应)△2、无机物:⑴ 氢卤酸及卤化物(氢溴酸、氢碘酸、浓盐酸、溴化物、碘化物) ⑵ + 2价的Fe (亚铁盐及氢氧化亚铁) ⑶ -2价的S (硫化氢及硫化物)⑷ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑸ 双氧水(H 2O 2)五、常见的各类有机物的官能团,结构特点及主要化学性质(1) 烷烃A) 官能团:无 ;通式:C n H 2n +2;代表物:CH 4B) 结构特点:键角为109°28′,空间正四面体分子。


酸醇醛三者转化关系1. 引言在化学领域,酸、醇和醛是三种重要的有机化合物。
它们拥有不同的分子结构和化学性质,但也存在一定的转化关系。
本文将深入探讨酸、醇和醛之间的相互转化关系,以及这些转化在有机合成和生物化学中的应用。
2. 酸、醇和醛的基本概念2.1 酸酸是指具有产生氢离子(H+)的能力的物质。
它可以根据酸的强弱分为强酸和弱酸。
强酸可以完全解离生成H+离子,而弱酸只能部分解离。
2.2 醇醇是一类含有羟基(-OH)的有机化合物。
它可以根据羟基的位置分为一元醇、二元醇和多元醇。
醇的命名通常以烷基名词结尾,如乙醇、甲醇等。
2.3 醛醛是一类含有羰基(C=O)的有机化合物。
它的羰基结构在碳链上是以两个单键连接两个其他原子或基团。
醛的命名通常以醛作为后缀,如甲醛、丙醛等。
3. 酸、醇和醛的相互转化关系酸、醇和醛之间存在着相互转化的关系,这些转化在有机合成和生物化学中起着重要作用。
3.1 酸转化为醇酸可以通过还原反应转化为醇。
常见的酸还原反应包括氢化反应、金属还原反应和催化还原反应。
这些反应中,还原剂可以是氢气、金属或催化剂等。
3.1.1 氢化反应氢化反应是将酸转化为醇的常见方法。
在氢化反应中,酸与氢气在催化剂的作用下发生反应,生成相应的醇。
催化剂通常是铂、钯、铑等贵金属。
氢化反应的机理: 1. 酸与催化剂中的氢气吸附在表面上。
2. 酸的羰基与氢气发生氢化反应,生成醇。
3. 醇从催化剂表面脱附。
3.1.2 金属还原反应金属还原反应是将酸转化为醇的另一种方法。
在金属还原反应中,酸与金属发生反应,生成相应的醇。
常用的金属还原剂包括锂铝氢化物(LiAlH4)和甲基镁卤化物(Grignard试剂)等。
金属还原反应的机理: 1. 酸与金属发生反应,生成金属酸盐。
2. 金属酸盐与水反应,生成相应的醇。
3.1.3 催化还原反应催化还原反应是将酸转化为醇的另一种常见方法。
在催化还原反应中,酸与催化剂发生反应,生成相应的醇。


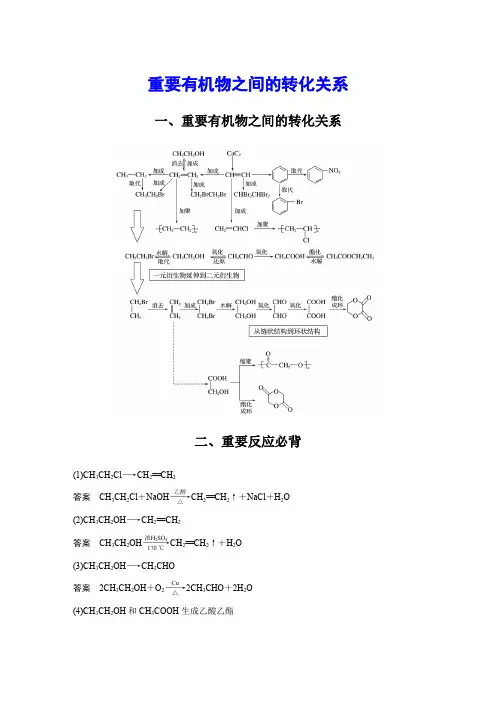
重要有机物之间的转化关系一、重要有机物之间的转化关系二、重要反应必背(1)CH 3CH 2Cl ―→CH 2==CH 2答案 CH 3CH 2Cl +NaOH ――→乙醇△CH 2==CH 2↑+NaCl +H 2O (2)CH 3CH 2OH ―→CH 2==CH 2答案 CH 3CH 2OH ―――→浓H 2SO 4170 ℃CH 2==CH 2↑+H 2O (3)CH 3CH 2OH ―→CH 3CHO答案 2CH 3CH 2OH +O 2――→Cu △2CH 3CHO +2H 2O (4)CH 3CH 2OH 和CH 3COOH 生成乙酸乙酯答案 CH 3COOH +CH 3CH 2OH浓H 2SO 4△CH 3COOC 2H 5+H 2O (5)OHC —CHO ―→HOOC —COOH答案 OHC —CHO +O 2――→催化剂△HOOC —COOH (6)乙二醇和乙二酸生成聚酯答案 n HOCH 2—CH 2OH +n HOOC —COOH 一定条件+2n H 2O(7)乙醛和银氨溶液的反应答案 CH 3CHO +2Ag(NH 3)2OH ―→△CH 3COONH 4+2Ag ↓+3NH 3+H 2O(8)乙醛和新制Cu(OH)2悬浊液的反应答案 CH 3CHO +2Cu(OH)2―→△CH 3COOH +Cu 2O ↓+2H 2O (9)答案 +2NaOH ――→醇△+2NaCl +2H 2O (10)答案 +Br 2――→FeBr 3+HBr (11)和饱和溴水的反应答案 +3Br 2―→↓+3HBr(12)和溴蒸气(光照)的反应答案 +Br 2―→光+HBr(13) 和HCHO 的反应答案 n +n HCHO ―→H ++n H 2O(14)酯在碱性条件的水解(以乙酸乙酯在NaOH 溶液中为例)答案 CH 3COOC 2H 5+NaOH ――→△CH 3COONa +C 2H 5OH (15)和NaOH 的反应答案 +2NaOH ――→△CH 3COONa ++H 2O三、有机物的检验辨析1.卤代烃中卤素的检验取样,滴入NaOH 溶液,加热至分层现象消失,冷却后加入稀硝酸酸化,再滴入AgNO 3溶液,观察沉淀的颜色,确定是何种卤素。

重要有机物之间的相互转化汇报人:日期:contents •脂肪烃的转化•脂环烃的转化•芳香烃的转化•卤代烃的转化•有机化合物的氧化还原反应•有机化合物的官能团转换目录脂肪烃的转化03烷基化反应01裂解反应02脱氢反应氧化反应聚合反应氧化反应聚合反应加氢反应脂环烃的转化环扩大环缩小环烷烃的加成030201环氧化环烯烃可以通过催化氧化或化学氧化反应,转化为环氧化物。
环加成环烯烃可以与炔烃、烯烃等发生Diels-Alder反应或 ene 反应,生成新的环状化合物。
开环反应在酸或碱催化下,环烯烃可以开环转化为链状烃。
1 2 3环加成末端加成开环反应芳香烃的转化氧化反应磺化反应硝化反应苯的转化磺化反应烷基化反应氧化反应氧化反应磺化反应烷基化反应卤代烃的转化氧化反应还原反应水解反应消去反应01加成反应02氧化反应03多卤代烃的转化裂解反应多卤代烃在无氧或缺氧的条件下,可发生裂解反应,生成多个小分子卤代烃或烯烃。
聚合反应多卤代烃可在催化剂的作用下,发生聚合反应,生成高分子化合物。
有机化合物的氧化还原反应氧化反应醇的氧化酮的氧化01羧酸的还原02醛的还原03酮的还原还原反应既有氧化又有还原的反应烯烃的环氧化烯烃的氢化有机化合物的官能团转换醇到醚通过醇和卤代烃发生取代反应得到醚。
醇到醛通过醇和醛发生氧化反应得到醛。
醇到羧酸通过醇和羧酸发生酯化反应得到羧酸。
030201醛到醇醛到酮酮到羧酸羧酸到酯羧酸到酰胺羧酸到酮感谢观看。
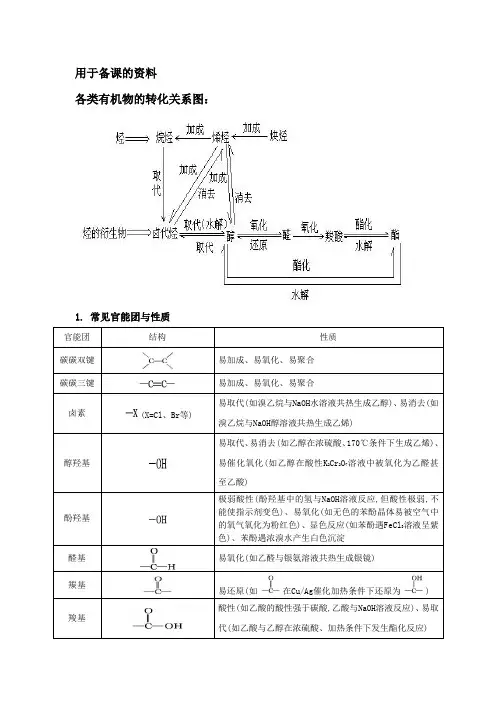
用于备课的资料各类有机物的转化关系图:1. 常见官能团与性质官能团结构性质碳碳双键易加成、易氧化、易聚合碳碳三键易加成、易氧化、易聚合卤素(X=Cl、Br等)易取代(如溴乙烷与NaOH水溶液共热生成乙醇)、易消去(如溴乙烷与NaOH醇溶液共热生成乙烯)醇羟基易取代、易消去(如乙醇在浓硫酸、170℃条件下生成乙烯)、易催化氧化(如乙醇在酸性K2Cr2O7溶液中被氧化为乙醛甚至乙酸)酚羟基极弱酸性(酚羟基中的氢与NaOH溶液反应,但酸性极弱,不能使指示剂变色)、易氧化(如无色的苯酚晶体易被空气中的氧气氧化为粉红色)、显色反应(如苯酚遇FeCl3溶液呈紫色)、苯酚遇浓溴水产生白色沉淀醛基易氧化(如乙醛与银氨溶液共热生成银镜)羰基易还原(如在Cu/Ag催化加热条件下还原为) 羧基酸性(如乙酸的酸性强于碳酸,乙酸与NaOH溶液反应)、易取代(如乙酸与乙醇在浓硫酸、加热条件下发生酯化反应)酯基易水解(如乙酸乙酯在稀硫酸、加热条件下发生酸性水解,乙酸乙酯在NaOH溶液、加热条件下发生碱性水解)烷氧基如环氧乙烷在酸催化下与水一起加热生成乙二醇硝基还原(如酸性条件下,硝基苯在铁粉催化下还原为苯胺)2. 有机反应类型与重要的有机反应反应类型重要的有机反应取代反应烷烃的卤代:CH4+Cl2CH3Cl+HCl烯烃的卤代:卤代烃的水解:CH3CH2Br+NaOH CH3CH2OH+NaBr皂化反应:+3NaOH3C17H35COONa+酯化反应:+C2H5OH+H2O 糖类的水解:122211C H O蔗糖+H2O6126C H O果糖+6126C H O葡萄糖二肽的水解:+H2O取代反应苯环上的卤代:+Cl2+HCl苯环上的硝化:++H2O苯环上的磺化:++H2O(续表) 反应类型重要的有机反应加成反应烯烃的加成:+HCl炔烃的加成:+H2O苯环的加氢:+3H2消去反应醇分子内脱水生成烯烃:C2H5OH+H2O卤代烃脱HX生成烯烃:CH3CH2Br+NaOH+NaBr+H2O加聚反应单烯烃的加聚:n共轭二烯烃的加聚:(此外,需要记住丁苯橡胶、氯丁橡胶的单体)缩聚反应二元醇与二元酸之间的缩聚:n+nHOCH2CH2OH+2nH2O 羟基酸之间的缩聚:+nH2O缩聚反应氨基酸之间的缩聚:苯酚与HCHO的缩聚:n+nHCHO+nH2O氧化催化氧化:2CH3CH2OH+O22CH3CHO+2H2O反应醛基与银氨溶液的反应:CH3CHO+2[Ag(NH3)2]OH CH3COONH4+2Ag↓+3NH3+H2O(注意配平)醛基与新制氢氧化铜的反应:CH3CHO+2Cu(OH)2+NaOH CH3COONa+Cu2O↓+3H2O醛基加氢:CH3CHO+H2CH3CH2OH还原反应硝基还原为氨基:。


最新苏教版选修五《醛 羧酸》(第3课时重要有机物之间的相互转化)教案1.掌握有机化学反应的主要类型的原理及应用,2.3.在掌握各类有机物的性质、反应类型、相互转化的基础上,初步学习设计合理的有机合成路线。
人类运用有机化学手段合成出许许多多的物质,合成有机化合物需要考虑哪些问题呢?①CH3CH3+Br2−→−光CH3CH2Br+HBr②CH2==CH2+H2−−→−催化剂CH3CH3CH ≡CH+2H2−−→−催化剂CH3CH3④CH ≡CH+H2−−→−催化剂CH2==CH2⑤CH3CH2Br+NaOH CH2===CH2↑+NaBr+H2O⑥CH3CH2Br+NaOHCH3CH2OH+NaBr⑦CH3CH2OH+HBr CH3CH2Br+H2O⑧CH3CH2OHCH2==CH2↑+H2O⑨2CH3CH2OH+O22CH3CHO+2H2O⑩CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O○11 CH3CHO+2Cu (OH )2Cu2O ↓+CH3COOH+2H2O若由乙醇制备乙二酸乙二酯(),提示:乙醇−−→−消去乙烯−−→−加成1,2-二溴乙烷−−→−水解乙二醇−−→−氧化乙二醛−−→−氧化乙二酸课堂师生互动知识点11.(1)CH3CH3+Cl2−−→−光照HCl+CH3CH2Cl(还有其他的卤代烃)(还有其他的氯代苯甲烷)CH2==CH —CH3+Cl2−−−−→−600℃~500℃CH2==CH —CH2Cl+HCl(2)CH2==CHCH3+Br2−→−CH2Br —CHBrCH3CH2==CHCH3+HBr −→−CH3—CHBrCH3CH ≡CH+HCl −−→−催化剂CH2==CHCl (3)R —OH+HX R —X+H2O2.(1CH2==CH2+H2OCH3CH2—OHCH3CH2—Br+H2O −−→−NaOHCH3CH2—OH+HBrCH3CHO+H2CH3CH2—OHCH3COCH3+H2CH3COOCH2CH3+H2O CH3COOH+CH3CH2—OH(2①酚钠盐溶液中通入CO2②苯的卤代物水解生成苯酚,3. (1)①醇的消去反应引入CH3CH2OH CH2==CH2↑+H2O②卤代烃的消去反应引入。
一、有机物间相互转化关系二、能与溴水发生化学反应而使溴水褪色或变色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等)⑷ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑸ 天然橡胶(聚异戊二烯)2、无机物:⑴ -2价的S (硫化氢及硫化物)⑵ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑶ + 2价的64 + 32 = 22(4)3 + 2362 + 32 = 43 + 2322 + 32 = 23 + 2I 2⑷ 、等单质 如⑸ -1价的I (氢碘酸及碘化物)变色 ⑹ 等强碱、23和3等盐 2 + H 2O = +2 + 23 = 2 + 2↑+ H 2O + 23 = + 3三、能萃取溴而使溴水褪色的物质上层变无色的(ρ>1):卤代烃(4、氯仿、溴苯等)、2等;下层变无色的(ρ<1):直馏汽油、煤焦油、苯及苯的同系物、低级酯、液态环烷烃、液态饱和烃(如己烷等)等 四、能使酸性高锰酸钾溶液褪色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等) ⑷ 醇类物质(乙醇等)⑸ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑹ 天然橡胶(聚异戊二烯) ⑺ 苯的同系物变色 + 2 2 (其中亦有与、与的反应) △2、无机物:⑴ 氢卤酸及卤化物(氢溴酸、氢碘酸、浓盐酸、溴化物、碘化物) ⑵ + 2价的(亚铁盐及氢氧化亚铁) ⑶ -2价的S (硫化氢及硫化物)⑷ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑸ 双氧水(H 2O 2)五、常见的各类有机物的官能团,结构特点及主要化学性质(1) 烷烃A) 官能团:无 ;通式:22;代表物:4B) 结构特点:键角为109°28′,空间正四面体分子。