(完整版)高中化学计算题
- 格式:doc
- 大小:63.52 KB
- 文档页数:14

高中化学计算题学霸总结(含答案)高中化学计算题学霸总结(含答案)阳光老师:祝你学业有成一、计算题(本大题共30小题,共240.0分)1.把铁、铝混合物溶于盐酸中,反应后盐酸的浓度变为,溶液体积变化忽略不计。
求反应中消耗HCl的物质的量和该混合物中铝、铁的物质的量。
答案】消耗HCl的物质的量:设Al、Fe的物质的量分别为x、y。
2Al + 6HCl → 2AlCl3 + 3H2↑Fe + 2HCl → FeCl2 + H2↑根据反应方程式,消耗HCl的物质的量为2x + y。
该混合物中铝、铁的物质的量:根据题意,铝、铁混合物中铝、铁的质量比为2:3,设铝、铁的质量分别为m1、m2,则有:m1/m2 = 2/3m1 + m2 = 100g解得m1 = 40g,m2 = 60g铝、铁的相对原子质量分别为27和56,所以它们的物质的量分别为x = 1.48mol,y = 1.07mol。
解析】本题考查物质的量的计算,难度不大,解题的关键是对物质的量公式的熟练应用。
2.在由Na2CO3和NaHCO3组成的混合物中加入足量盐酸充分反应后,收集CO2的质量分数。
不考虑溶解,试计算原混合物中Na2CO3的质量分数。
答案】原混合物中Na2CO3的质量分数为。
设Na2CO3的物质的量为x,NaHCO3的物质的量为y。
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2ONaHCO3 + HCl → NaCl + CO2↑ + H2O根据反应方程式,CO2的物质的量为x + y。
CO2的质量分数为:答:原混合物中Na2CO3的质量分数为。
解析】本题考查质量分数的计算,掌握物质的性质和质量分数的计算方法是解答该题的关键,试题较容易。
3.计算质量比为51:32:34的C6H5OH、CH3OH、C2H5OH,其物质的量之比为______,它们所含氢原子数之比为______,所含质子数之比为______。
有含为,则C6H5OH 的摩尔质量为______,R的相对原子质量为______。

高三化学计算试题及答案一、选择题(每题3分,共30分)1. 下列物质中,属于纯净物的是()。
A. 矿泉水B. 蒸馏水C. 空气D. 粗盐答案:B2. 根据化学方程式2H2 + O2 → 2H2O,2g氢气完全燃烧生成水的质量是()。
A. 18gB. 16gC. 36gD. 12g答案:B3. 元素周期表中,位于第三周期第ⅢA族的元素是()。
A. 钠B. 铝C. 硅D. 磷答案:B4. 根据化学反应式CaCO3 → CaO + CO2↑,下列说法正确的是()。
A. 该反应是置换反应B. 该反应是分解反应C. 该反应是化合反应D. 该反应是复分解反应答案:B5. 根据化学方程式2H2O → 2H2↑ + O2↑,下列说法正确的是()。
A. 该反应是放热反应B. 该反应是吸热反应C. 该反应是中和反应D. 该反应是氧化还原反应答案:B6. 根据化学方程式2H2 + O2 → 2H2O,下列说法正确的是()。
A. 氢气是氧化剂B. 氧气是还原剂C. 氢气是还原剂D. 氧气是氧化剂答案:D7. 根据化学方程式2H2S + 3O2 → 2SO2 + 2H2O,下列说法正确的是()。
A. 该反应中硫元素被氧化B. 该反应中硫元素被还原C. 该反应中氧元素被氧化D. 该反应中氧元素被还原答案:A8. 根据化学方程式4P + 5O2 → 2P2O5,下列说法正确的是()。
A. 该反应中磷元素被氧化B. 该反应中磷元素被还原C. 该反应中氧元素被氧化D. 该反应中氧元素被还原答案:A9. 根据化学方程式2Mg + O2 → 2MgO,下列说法正确的是()。
A. 镁是还原剂B. 氧气是氧化剂C. 镁是氧化剂D. 氧气是还原剂答案:B10. 根据化学方程式2Al + 6HCl → 2AlCl3 + 3H2↑,下列说法正确的是()。
A. 铝是还原剂B. 盐酸是氧化剂C. 铝是氧化剂D. 盐酸是还原剂答案:A二、填空题(每题4分,共20分)1. 根据化学方程式C6H12O6 + 6O2 → 6CO2 + 6H2O,葡萄糖完全氧化生成二氧化碳和水,每消耗1mol葡萄糖,需要消耗______ mol氧气。

11.相对分子质量为M 的某物质在室温下的溶解度为S g ,此时测得饱和溶液的密度为ρg ·cm -3,则该饱和溶液的物质的量浓度是A .110-⋅L mol S M ρB .1)100(1000-⋅+L mol S M S ρ C .110-⋅L mol M S ρ D .11000)100(-⋅+L mol S S M ρ2.将标准状况下的a L HCl (气)溶于1000g 水中,得到的盐酸密度为b g/cm 3,则该盐酸的物质的量浓度是A .L mol a /4.22B .L mol ab /22400C .L mol aab /5.3622400+ D .L mol a ab /5.36224001000+ 3.NA 为阿伏加德罗常数,下列关于0.2mol/L K2SO4溶液的正确说法是A .500mL 溶液中所含K +、SO 42-总数为0.3N AB .500mL 溶液中含有0.1N A 个K +离子C .1L 溶液中K +离子浓度是0.2mol/LD .2L 溶液中SO 42-离子浓度是0.4mol/L4.某Al 2(SO 4)3溶液V mL 中含a g Al 3+,取出V/4 mL 溶液稀释成4V mL 后,SO 42-的物质的量浓度为A .125/54V mol ·L -1B .125a/36V mol ·L -1C .125a/18V mol ·L -1D .125a/V mol ·L -15.将4gNaOH 溶解在10mL 水中,稀至1L 后取出10mL ,其物质的量浓度是A . 1mol/L B. 0.1mol/L C. 0.01mol/L D. 10mol/L6.下列各溶液中,Na +浓度最大的是A. 0.8L0.4mol/L 的NaOH 溶液B. 0.2L0.15mol/L 的Na 3PO 4溶液C. 1L0.3mol/L 的NaCl 溶液 D . 4L0.5mol/L 的NaCl 溶液7.已知20g 密度为ρg/mL 的硝酸钙溶液中含有1gCa 2+,则NO 3-的物质的量浓度为A. ρ/400mol/LB. 20/ρmol/L C . 2.5ρmol/L D. 1.25ρmol/L8.溶质的质量分数为14%的KOH 溶液,经加热蒸发去100g 水后,质量分数变成228%,体积为80mL ,则此时溶液的物质的量浓度为A. 5mol/LB. 6mol/L C . 6.25mol/L D. 6.75mol/L 9.将12mol/L 的盐酸(ρ=1.19g/cm 3)50mL 稀释成6mol/L 的盐酸(ρ=1.10g/cm 3),需加水的体积为A . 50mL B. 50.5mL C. 55mL D. 59.5mL 10.相对分子质量为M 的某物质在室温下的溶解度为S g/100g 水,此时测得饱和溶液的密度为d g/cm 3,则该饱和溶液的物质的量浓度是A. sd M 10mol/L B . )100(1000S M Sd+mol/L C. M Sd 10mol/L D. SdS M 1000)100(+mol/L 11.将5mol/L 的Mg (NO 3)2溶液a mL 稀释至b mL ,稀释后溶液中NO 3-的物质的量浓度为A .b a 5mol/LB .b a 10mol/LC .a b 5mol/LD .ba mol/L 12.将标准状况下,将VL A 气体(摩尔质量为Mg/mol )溶于0.1L 水中,所得溶液密度为ρg/cm 3,则此溶液的物质的量浓度(mol/L )为A .)2240(+MV V ρB .)2240(100+MV V ρC .ρ)1.0(4.22+V MV D .100V ρM (MV+2240) 13.常温下,将150mL 22% NaNO 3溶液加100g 蒸馏水后,溶液中溶质的质量分数变为14%。

高中化学计算题学霸总结(含答案)阳光老师:祝你学业有成2一、计算题(本大题共30小题,共240.0分)1.把1.1 "铁、铝混合物溶于200 InL 5 mol•厶T盐酸中,反应后盐酸的浓度变为4.6mo∕∙L-,(溶液体积变化忽略不计)。
求:(1)反应中消耗HCl的物质的量。
⑵该混合物中铝、铁的物质的量。
【答案】(1)消耗Hel的物质的量:0.2 厶X 5 TnoI ∙ Lr X— 0.2 L X 4.6 TnOl∙ L-1 = 0.08 Tnol:⑵设Al、FC的物质的量分别为x、y°2AI + GHCl = 2 AlCl i+ 3H2↑2 6X 3xFe + 2 H Cl = FeCl2 + H2 T1 2y 2y27 g ・ InOr l× τ + 56 g ・ mol」× y= 1.1 g{解得:X = 0.02 mol, V = O Ol ^OI O3© + 2y = 0.08 Inol【解析】【分析】本题考查物质的量的讣算,难度不大,解题的关键是对物质的量公式的熟练应用。
2.在14.8 0由Na2CO3和NaHCch组成的混合物中加入足量盐酸充分反应后•收集到CO26.6 g(不考虑溶解),试计算原混合物中NaHc(h的质量分数。
【答案】6.6gC02的物质的量为: 丽話 =()∙15md , 设Na 2CO 3的物质的量为X, NaHCO 3的物质的量为y, 由方程式 N"2CO3 + 2 H Cl = 2NaCl + CO 2 ↑ +H 2O, NaHCO i + HCI = NaCl + C6 ↑ +H 2O 可知,X + y = 0.15, 106 + 8 电/ = 14.8,解得:X = QΛmol > V = 0∙05mo∕»NaHCo3的质量分数为:笛U 4X log% ≈ 28.4%I zLo答:原混合物中NaHCO 3的质量分数为28.4%。

高中化学计算试题及答案一、选择题1. 已知某化合物A的摩尔质量为40g/mol,若将1.2g的化合物A溶于水中,形成溶液的体积为100mL,求该溶液的摩尔浓度。
A. 0.3 mol/LB. 0.6 mol/LC. 1.2 mol/LD. 2.4 mol/L2. 某化学反应的速率常数k=0.05 s^-1,如果反应物的初始浓度为0.01 mol/L,求10秒后反应物的浓度。
A. 0.005 mol/LB. 0.01 mol/LB. 0.015 mol/LD. 0.025 mol/L二、计算题1. 某化学实验室需要制备0.1 mol/L的硫酸溶液100mL,已知实验室有98%的浓硫酸,其密度为1.84 g/cm³。
求需要多少毫升的浓硫酸。
2. 某工厂排放的废水中含有0.05 mol/L的硫酸,若要将废水中的硫酸中和至pH值为7,需要加入多少摩尔的氢氧化钠(NaOH),假设废水体积为1000L。
三、解答题1. 某化学反应的平衡常数Kc=10^-4,反应为:N2(g) + 3H2(g) ⇌2NH3(g)。
若初始时N2的浓度为0.1 mol/L,H2的浓度为0.3 mol/L,求平衡时NH3的浓度。
2. 某溶液中含有0.02 mol/L的HCl和0.02 mol/L的NaOH,求混合后溶液的pH值。
答案一、选择题1. 答案:B解析:首先计算化合物A的摩尔数,n = m/M = 1.2g / 40g/mol = 0.03 mol。
然后计算摩尔浓度,c = n/V = 0.03 mol / 0.1 L = 0.3 mol/L。
2. 答案:A解析:根据一阶反应的浓度公式,c = c0 * e^(-kt),其中c0为初始浓度,c为10秒后的浓度,k为速率常数,t为时间。
代入数值,c = 0.01 * e^(-0.05*10) ≈ 0.005 mol/L。
二、计算题1. 答案:需要8.16 mL的浓硫酸。

计算题高中化学试卷学校:___________姓名:___________班级:___________考号:___________一、计算题1.常温下,将20.0g 质量分数为14.0%的3KNO 溶液跟30.0g 质量分数为24.0%的3KNO 溶液混合,得到密度为1.153g cm -⋅的混合溶液。
计算: (1)混合后溶液中溶质的质量分数。
(2)混合后溶液中溶质的物质的量浓度。
(3)在1000g 水中需溶解多少摩尔3KNO 才能使其浓度恰好与上述混合后溶液的浓度相等? 2.称取有机物A 6.0g ,在足量氧气中充分燃烧,并使产物依次缓慢通过浓硫酸、碱石灰,两者分别增重7.2g 和13.2g 。
已知有机物A 气态时的密度是相同条件下氢气密度的30倍。
请计算:(1)有机物A 的分子式 。
(2)另取A 6.0g ,跟足量的金属钠反应生成1.12L 氢气(标准状况),A 可能的结构简式为 。
3.把0.4mol X 气体和0.6mol Y 气体混合于2L 的恒容密闭容器中,使它们发生如下反应:4X(g)+5Y(g)nZ(g)+6W(g),2min 末生成0.3mol W,若测知以Z 的浓度变化表示的反应速率为0.05mol/(L·min),试计算:1.前2min 内用X 的浓度变化表示的平均反应速率为__________2.2min 末时Y 的浓度为__________3.化学反应方程式中n=__________4.2min 末,恢复到反应前温度,体系内压强是反应前压强的__________倍4.某兴趣小组用盐酸溶解法测定镀锌铁皮锌层厚度,分别取A 、B 、C 三块镀锌铁皮(均截自同一块规则的镀锌铁皮)进行实验,实验数据记录如下:镀锌铁皮长度/cm 宽度/cm 反应前固体质量/g 反应后固体质量/g A 5.00 4.00 4.360 4.212 B 5.10 4.00 4.447 4.295 C4.905.104.4384.330写出简要计算过程:_______________。

高考化学计算公式及例题(一)有关化学式的计算1.通过化学式,根据组成物质的各元素的原子量,直接计算分子量。
2.已知标准状况下气体的密度,求气体的式量:M=22.4ρ。
3.根据相对密度求式量:M=M ˊD 。
⎪⎪⎭⎫ ⎝⎛'=ρρD 4.混合物的平均分子量: ++⋅==%%)(Bb A M a M M 混合物物质的量总数克物质的总质量 5.相对原子质量①原子的相对原子质量=121126⨯原子的质量一个一个原子的质量CA 1、A 2表示同位素相对原子质量,a 1%、a 2%表示原子的摩尔分数 ②元素近似相对原子质量: ++=%%2211a A a A A(二) 溶液计算1、V N N MV m V n c A === 1000C Mρω= 2、稀释过程中溶质不变:C 1V 1=C 2V 2。
3、同溶质的稀溶液相互混合:C 混=21221V V V C CV ++ (忽略混合时溶液体积变化不计) 4、溶质的质量分数。
①%100%100%⨯+=⨯=剂质质液质m m m m m a ②%100100%⨯+=S S a (饱和溶液,S 代表溶质该条件下的溶解度) ③混合:m 1a 1%+m 2a 2%=(m 1+m 2)a%混④稀释:m 1a 1%=m 2a 2%5、有关pH 值的计算:酸算H +,碱算OH —Ⅰ. pH= —lg[H +] C(H +)=10-pHⅡ. K W =[H +][OH —]=10-14(25℃时)×N A ÷N A× ÷22.4 L/ mol 22.4 L/ mol气体的体积 (标准状况下)6、图中的公式:1. A n N = 2. m n M = 3. m V n V = 4. n n V=。

高中化学计算题学霸总结(含答案)阳光老师:祝你学业有成2题号一总分得分一、计算题(本大题共30小题,共240.0分)1.把铁、铝混合物溶于盐酸中,反应后盐酸的浓度变为溶液体积变化忽略不计。
求:反应中消耗HCl的物质的量。
该混合物中铝、铁的物质的量。
【答案】消耗HCl的物质的量:;设Al、Fe的物质的量分别为x、y。
2Al2 6x 3xFe1 2y 2y,解得:,。
【解析】【分析】本题考查物质的量的计算,难度不大,解题的关键是对物质的量公式的熟练应用。
2.在由和组成的混合物中加入足量盐酸充分反应后,收集到不考虑溶解,试计算原混合物中的质量分数。
【答案】的物质的量为:,设的物质的量为x,的物质的量为y,由方程式,可知,,,解得:,,的质量分数为:答:原混合物中的质量分数为。
【解析】【分析】本题考查质量分数的计算,掌握物质的性质和质量分数的计算方法是解答该题的关键,试题较容易。
【解答】的物质的量为:,设的物质的量为x,的物质的量为y,由方程式,可知,,,解得:,,的质量分数为:答:原混合物中的质量分数为。
3.计算质量比为51:32:34的、、,其物质的量之比为______,它们所含氢原子数之比为______,所含质子数之比为______。
有含为,则的摩尔质量为______,R的相对原子质量为______。
在,固体完全分解生成、、,若所得混合气体对的相对密度为d,则用含m、d的代数式表示混合气体的物质的量为______;用含m、d的代数式表示的摩尔质量为______。
某化学兴趣小组对“农夫山泉”矿泉水进行检测时,发现该矿泉水中含有,则该矿泉水中的物质的量浓度为______。
【答案】:2:1;9:8:2;15:10:9;;32;;;。
【解析】【分析】本题考查物质的量的计算,题目难度不大,明确物质的量与其它物理量之间的关系即可解答,注意掌握摩尔质量与相对分子量的关系,试题计算量较大,充分考查了学生的分析能力及化学计算能力。

化学高中计算题化学高中计算题第一篇化学题尤其是选择题中所涉及的计算,所要考查的是化学学问,而不是运算技能,所以当中的计算的量应当是较小的,通常都不需计出准确值,可结合题目中的条件对运算结果的数值进行估计,符合要求的便可选取。
[例4]已知某盐在不同温度下的溶解度如下表,若把质量分数为22%的该盐溶液由50℃渐渐冷却,则开始析出晶体的温度范围是温度(℃)01020XX40溶解度(克/100克水)A.0-10℃B.10-20℃C.20-30℃D.30-40℃此题考查的是溶液结晶与溶质溶解度及溶液饱和度的关系。
溶液析出晶体,意味着溶液的浓度超出了当前温度下其饱和溶液的浓度,依据溶解度的定义,[溶解度/(溶解度+100克水)]×100%=饱和溶液的质量分数,假如将各个温度下的溶解度数值代入,比较其饱和溶液质量分数与22%的大小,可得出结果,但运算量太大,不符合选择题的特点。
从表上可知,该盐溶解度随温度上升而增大,可以反过来将22%的溶液当成某温度时的饱和溶液,只要温度低于该温度,就会析出晶体。
代入[溶解度/(溶解度+100克水)]×100%=22%,可得:溶解度×78=100×22,即溶解度=2200/78,除法运算麻烦,运用估算,应介于25与30之间,此溶解度只能在30-40℃中,应选D。
化学高中计算题第二篇已知一个有机物的分子式,依据题目的要求去计算相关的量例犹如分异构体,反应物或生成物的结构,反应方程式的系数比等,常常要用到结构比较法,其关键是要对有机物的结构特点了解透彻,将相关的官能团的位置,性质娴熟把握,代入对应的条件中进行确定。
[例8]分子式为C12H12的烃,结构式为,若萘环上的二溴代物有9种同分异构体,则萘环上四溴代物的同分异构体数目有〔〕A.9种B.10种C.11种D.12种此题是求萘环上四溴代物的同分异构体数目,不需考虑官能团异构和碳链异构,只求官能团的位置异构,如按通常做法,将四个溴原子逐个代入萘环上的氢的位置,便可数出同分异构体的数目,但由于数量多,结构比较十分困难,很易错数,漏数.抓住题目所给条件--二溴代物有9种,分析所给有机物峁固氐?不难看出,萘环上只有六个氢原子可以被溴取代,也就是说,每取代四个氢原子,就确定剩下两个氢原子未取代,依据"二溴代物有9种"这一提示,即萘环上只取两个氢原子的不同组合有9种,即意味着取四个氢原子进行取代的不同组合就有9种,所以根本不需逐个代,快速推知萘环上四溴代物的同分异构体就有9种. 化学高中计算题第三篇这种方法最适合定性地求解混合物的组成,即只求出混合物的可能成分,不用考虑各组分的含量。

高中化学计算试题及答案一、选择题(每题3分,共30分)1. 下列物质中,属于纯净物的是()A. 空气B. 矿泉水C. 蒸馏水D. 石油2. 根据质量守恒定律,化学反应前后()A. 元素种类不变B. 原子种类不变C. 原子数目不变D. 原子质量不变3. 金属钠在空气中反应生成的产物是()A. 氧化钠B. 过氧化钠C. 氢氧化钠D. 碳酸钠4. 将二氧化碳通入澄清石灰水中,观察到的现象是()A. 溶液变浑浊B. 溶液变澄清C. 溶液颜色变深D. 无明显变化5. 根据化学方程式计算,若1mol氧气完全反应,需要消耗氢气的物质的量是()A. 1molB. 2molC. 4molD. 8mol6. 根据酸碱中和反应的原理,下列物质中能与盐酸发生中和反应的是()A. 碳酸钠B. 氢氧化钠C. 氯化钠D. 硫酸钠7. 根据摩尔质量的定义,1mol氢气的质量是()A. 1gB. 2gC. 16gD. 32g8. 根据原子结构的知识,下列元素中属于金属元素的是()A. 碳B. 氧C. 钠D. 氯9. 根据化学平衡的原理,下列条件中能促使化学平衡向正反应方向移动的是()A. 增加反应物浓度B. 减少生成物浓度C. 增加催化剂D. 降低温度10. 根据氧化还原反应的原理,下列反应中属于氧化反应的是()A. 铁与盐酸反应B. 氢气与氧气反应C. 碳与二氧化碳反应D. 钠与水反应二、填空题(每题4分,共20分)1. 根据化学方程式2H2 + O2 → 2H2O,若氧气的体积是10L,则反应消耗的氢气的体积是______。
2. 根据化学方程式CaO + H2O → Ca(OH)2,若氢氧化钙的质量是74g,则反应消耗的氧化钙的质量是______。
3. 根据摩尔浓度的定义,若溶液中溶质的物质的量是0.1mol,溶液的体积是250mL,则该溶液的摩尔浓度是______。
4. 根据化学方程式2Na + 2H2O → 2NaOH + H2,若生成氢气0.1mol,则反应消耗的钠的质量是______。
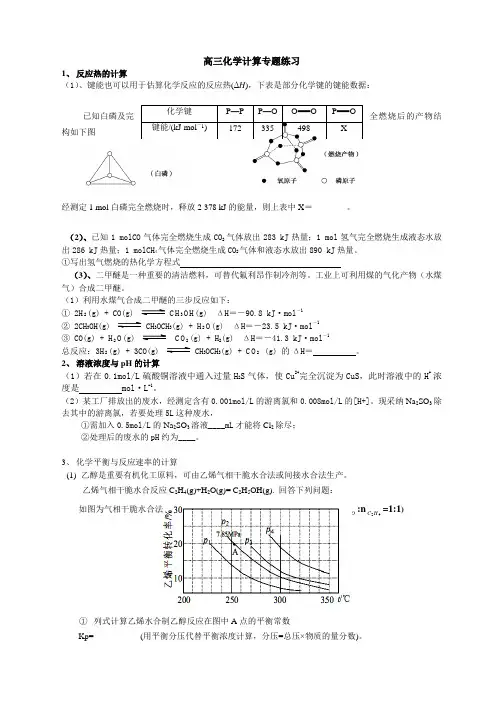
高三化学计算专题练习1、 反应热的计算 (1)、键能也可以用于估算化学反应的反应热(ΔH ),下表是部分化学键的键能数据:已知白磷及完全燃烧后的产物结构如下图经测定1 mol 白磷完全燃烧时,释放2 378 kJ 的能量,则上表中X =________。
(2)、已知1 molCO 气体完全燃烧生成CO 2 气体放出283 kJ 热量;1 mol 氢气完全燃烧生成液态水放出286 kJ 热量;1 molCH 4气体完全燃烧生成CO 2气体和液态水放出890 kJ 热量。
①写出氢气燃烧的热化学方程式 (3)、二甲醚是一种重要的清洁燃料,可替代氟利昂作制冷剂等。
工业上可利用煤的气化产物(水煤气)合成二甲醚。
(1)利用水煤气合成二甲醚的三步反应如下:① 2H 2(g) + CO(g) C H 3O H (g) ΔH =-90.8 kJ·mol -1② 2CH 3OH(g) CH 3OCH 3(g) + H 2O (g) ΔH =-23.5 kJ·mol -1③ CO(g) + H 2O (g) C O 2(g) + H 2(g) ΔH =-41.3 kJ·mol -1总反应:3H 2(g) + 3CO(g) CH 3OCH 3(g) + C O 2 (g) 的ΔH = 。
2、 溶液浓度与pH 的计算(1)若在0.1mol/L 硫酸铜溶液中通入过量H 2S 气体,使Cu 2+完全沉淀为CuS ,此时溶液中的H +浓度是 mol·L -1。
(2)某工厂排放出的废水,经测定含有0.001mol/L 的游离氯和0.008mol/L 的[H+]。
现采纳Na 2SO 3除去其中的游离氯,若要处理5L 这种废水,①需加入0.5mol/L 的Na 2SO 3溶液____mL 才能将Cl 2除尽; ②处理后的废水的pH 约为____。
3、 化学平衡与反应速率的计算(1) 乙醇是重要有机化工原料,可由乙烯气相干脆水合法或间接水合法生产。
简单的化学计算1.取1.19gK2CO3和KHCO3的混合物溶于水配成25mL溶液,往溶液中加入25mLBa(OH)2溶液恰好使生成的白色沉淀的量最多。
反应后溶液的c(OH-)=0.3mol/L(混合溶液体积为50mL)。
试计算:(1)反应后溶液中n(OH-)= mol。
(2)原混合物中n(K2CO3):n(KHCO3)= 。
2.取一定质量的Na2CO3和NaHCO3的混合物溶于水配成25mL溶液,往溶液中加入25mLHCl溶液恰好完全反应生成标准状况下672mL气体。
反应后溶液的c(Cl-)=0.8mol/L(混合溶液体积为50mL)。
试计算:(1)反应后溶液中n(Cl-)= mol。
(2)原混合物中n(Na2CO3):n(NaHCO3)= 。
3.向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入2.0 mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。
回答下列问题:(1)原NaOH溶液的物质的量浓度为;(2)题中通入CO2后所得溶液的溶质成分为,若将所得溶质在低温低压条件下蒸干,所得固体物质(不带结晶水)的质量为g4.为确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度盐酸30.0 mL,充分反应,产生CO2的体积(已折算成标准状况下的体积,不考虑CO2在水中的溶解)如下表:(1) 样品中物质的量之比n(Na2CO3):n(NaHCO3)=_________。
(2) 盐酸的物质的量浓度c(HCl)=______________。
5.Cl2与NaOH溶液反应可生成NaCl、NaClO和NaClO3(Cl-和ClO-)的比值与反应的温度有关,用24g NaOH配成的250 mL溶液,与Cl2恰好完全反应(忽略Cl2与水的反应、盐类的水解及溶液体积变化):(1)NaOH溶液的物质的量浓度________mol·L-1。
高一化学计算题解析1、有一份气体样品的质量是14.2 g ,体积是4.48 L (标准状况下),该气体的摩尔质量是( D )A .28.4B .28.4 g / molC .71D .71 g / mol 2、20 ℃时,KCl 的溶解度为34 g ,若忽略固体溶解引起的溶液体积变化,则在该温度下,所配KCl 溶液中KCl 的物质的量浓度不可能是( D )A .2 mol /LB .3 mol /LC .4 mol /LD .5 mol /L3、有一真空瓶质量为m 1,该瓶充入空气后质量为m 2。
在相同状况下,若改为充入某气体A 时,总质量为m 3。
则A 的相对分子质量是( C )A .2912m m B .2913m m C .291213m m m m -- D .291312m m m m -- 4、300 mL 某浓度的NaOH 溶液中含有60 g 溶质。
现欲配制1 mol /L NaOH 溶液,应取原溶液与蒸馏水的体积比约为( A )A .1∶4B .1∶5C .2∶1D .2∶35、下列溶液中的氯离子浓度与50 mL 1 mol /L 的AlCl 3溶液中氯离子浓度相等的是( B )A .150 mL 1 mol /L 的NaClB .75 mL 3 mol /L 的NH 4ClC .150 mL 2 mol /L 的KClD .75 mL 2 mol /L 的CaCl 26、某10% NaOH 溶液,加热蒸发掉100 g 水后得到80 mL 20%的溶液,则该20% NaOH 溶液的物质的量浓度为( A )A .6.25 mol /LB .12.5 mol /LC .7 mol /LD .7.5 mol /L7、要配制物质的量浓度约为2 mol /L NaOH 溶液100 mL ,下面的操作中,正确的是 ( D )A .称取8 g NaOH 固体,放入250 mL 烧杯中,用100 mL 量筒量取100 mL 蒸馏水,加入烧杯中,同时不断搅拌至固体溶解B .称取8 g NaOH 固体,放入100 mL 量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100 mLC .称取8 g NaOH 固体,放入100 mL 容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀D .用100 mL 量筒量取40 mL 5 mol /L NaOH 溶液,倒入250 mL 烧杯中,再用同一量筒量取60 mL 蒸馏水,不断搅拌下,慢慢倒入烧杯中8、现有m g 某气体,它由双原子分子构成,它的摩尔质量为M g / mol 。
高中化学有机试题——计算专题(答案加讲解)1、在乙醛、乙酸乙酯组成的混合物中,氢元素占总质量的1/11,则氧元素的质量应占总质量的()A.1011B.415C.411D.452、一定量的甲烷燃烧后得到的产物是CO、CO2、H2O(g)、此混合物质量为49.6g,当其缓缓通过足量的无水氯化钙时,气体质量减少25.2g,则混合气体中CO 的质量为( )A.24.4g B.13.2g C.12.5g D.11.2g3、两种气态烃组成的混合物0.1mol完全燃烧得0.16mol二氧化碳和3.6克水。
下列说法正确的是 ( )A.一定有甲烷 B.一定是甲烷和乙烯C.可能有乙烷 D.一定有乙炔4、甲醛、乙酸和丙醛组成的混合物中,氧元素的质量分数是37%,则碳元素的质量分数为(A) 27% (B) 28% (C) 54% (D) 无法计算5、下列各组混合物中,无论以何种比例混合,取n mol使之充分燃烧,耗氧量为定值的是()A.C2H2、C2H4O B.C2H4、C3H6C.C2H4、C2H6O D.C6H12O6、C2H4O2解题时可设有机物化学式为Cx HyOz。
则每摩尔燃烧时耗氧量为(x +4y—2z)。
由此可知:Cn H2n和CnH(2n+2)O、CnH(2n-2)和CnH2nO两物质不论以何种比例混和时,只要总物质的量一定,完全燃烧时耗氧量为定值,A选项对C 2H2和C2H4O分别完全燃烧时,其每mol耗O22.5mol,而C2H4和C2H6O分别完全燃烧时,其每mol耗O23mol,C选项对;故选A、C。
高一化学计算试题及答案一、选择题(每题3分,共30分)1. 下列物质中,属于纯净物的是:A. 空气B. 矿泉水C. 蒸馏水D. 盐水2. 化学反应中,能量变化的表现形式有:A. 热能B. 光能C. 电能D. 所有以上形式3. 根据摩尔质量的定义,下列说法正确的是:A. 摩尔质量的单位是克/摩尔B. 摩尔质量的单位是千克/摩尔C. 摩尔质量的数值上等于其相对原子质量D. 摩尔质量与相对原子质量的数值相等,但单位不同4. 质量守恒定律适用于:A. 化学变化B. 物理变化C. 所有变化D. 只有化学反应5. 下列物质中,属于化合物的是:A. 氧气C. 二氧化碳D. 氢气6. 在一定条件下,下列物质中能发生化学反应的是:A. 铁与氧气B. 铁与水C. 铁与铜D. 铁与金7. 根据化学方程式的书写规则,下列说法正确的是:A. 化学方程式必须标明反应条件B. 化学方程式中反应物和生成物的系数必须相等C. 化学方程式中反应物和生成物的原子总数必须相等D. 所有以上说法8. 根据氧化还原反应的定义,下列说法正确的是:A. 氧化还原反应中一定有元素的化合价变化B. 氧化还原反应中一定有电子的转移C. 氧化还原反应中一定有元素的氧化态变化D. 所有以上说法9. 根据酸碱中和反应的定义,下列说法正确的是:A. 酸碱中和反应生成盐和水B. 酸碱中和反应中酸和碱的摩尔比必须为1:1C. 酸碱中和反应中酸和碱的体积比必须为1:1D. 酸碱中和反应中酸和碱的浓度必须相等10. 下列物质中,属于强电解质的是:A. 醋酸B. 碳酸氢钠D. 氨水二、填空题(每题5分,共20分)1. 根据阿伏伽德罗定律,1摩尔任何气体在标准状况下的体积为_________L。
2. 在化学反应中,如果反应物的摩尔比为1:2,则生成物的摩尔比为________。
3. 根据化学平衡的定义,当正反应和逆反应的速率相等时,反应达到________状态。
4. 根据电离理论,当溶液中的阳离子全部是氢离子时,该溶液是________。
高中化学计算题【1】C8H16经多步裂化,最后完全转化为C4H8、C3H6、C3H6、C2H4、C2H6、CH4五种气体的混合物。
该混合物的平均相对分子质量可能是()A.28B.30C.38D.40【2】将硫酸钾、硫酸铝、硫酸铝钾三种盐混合溶于硫酸酸化的水中,测得c(SO42-)=0.105mol/L、c(Al3+)=0.055mol/L,溶液的pH=2.0(假设溶液中H2SO4完全电离为H+和SO42-),则c(K+)为()A.0.045mol/LB.0.035mol/LC.0.055mol/LD.0.040mol/L【3】某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物,当参加反应的单质与被还原硝酸的物质的量之比为2:1时,还原产物是()A.NO2B.NOC.N2OD.N2【4】将1.92g铜粉与一定量浓硝酸反应,当铜粉完全作用时收集到1.12L(标准状况)。
则所消耗硝酸的物质的量是()A.0.12molB.0.11molC.0.09molD.0.08mol【5】由NaH2PO4脱水形成聚磷酸盐Na200H2P200O601,共脱去水分子的数目为()A.198个B.199个C.200个D.201个【6】由锌、铁、铝、镁四种金属中的两种组成的混合物10g,与足量的盐酸反应产生的氢气在标准状况下为11.2L,则混合物中一定含有的金属是()A.锌B.铁C.铝D.镁【7】铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为()A.9.02g B.8.51g C.8.26g D.7.04g 【8】两种气态烃组成的混合气体0.1mol,完全燃烧得0.16molCO2和3.6g水,下列说法正确的是:混合气体中()A.一定有甲烷B.一定是甲烷和乙烯C.一定没有乙烷D.一定有乙炔【9】第ⅡA族元素R的单质及其相应氧化物的混合物12g,加足量水经完全反应后蒸干,得固体16g,试推测该元素可能为()A.MgB.CaC.SrD.Ba【10】将可能混有下列物质的硫酸铵样品13.2g,在加热条件下与过量氢氧化钠溶液反应,可收集到气体4.3L(标准状况),则该样品内不可能含有的物质是()A.碳酸氢铵和硝酸铵B.碳酸铵和氯化铵C.氯化铵和碳酸氢铵D.氯化铵和硝酸铵【11】在一个密闭容器中,用等物质的量的A和B发生反应:A(g)+2B(g) 2C(g)。
专题四:中学化学计算题常见方法及策略二. 知识要点及例题:(一)化学计算中的转化策略1. 由陌生转化为熟悉。
在解题过程中,当接触到一个难以解决的陌生问题时,要以已有知识为依据,将所要求解的问题与已有知识进行比较、联系,异中求同,同中求异,将陌生转化为熟悉,再利用旧知识,解决新问题。
[例1] 现有25℃的硫酸铜饱和溶液300克,加热蒸发掉80克水后,再冷却到原来的温度,求析出CuSO4·5H2O多少克(已知25℃时,CuSO4的溶解度为20克)。
[例2] 溶质质量分数为3x%和x%的两种硫酸等体积混合后,混合液中溶质的质量分数是()A. 2x%B. 大于2x%C. 小于2x%D. 无法计算2. 由局部转化为整体。
复杂的化学问题,往往是由几个小问题组合而成,若将这些小问题孤立起来,逐个分析解决,不但耗时费力,且易出错。
如能抓住实质,把所求问题转化为某一整体状态进行研究,则可简化思维程序,收到事半功倍之效。
[例3] 有一包FeSO4和Fe2(SO4)3的固体混合物,已测得含铁元素的质量分数为31%,则混合物中硫元素的质量分数是____。
[例4] 有一放置在空气中的KOH固体,经测定,其中含 KOH 84.9%,KHCO35.1%,K2CO32.38%,H2O 7.62%。
将此样品若干克投入 98克10%的盐酸中,待反应完全后,再需加入20克10%的KOH溶液方能恰好中和。
求蒸发中和后的溶液可得固体多少克。
3. 由复杂转化为简单著名数学家华罗庚教授曾经说过:“把一个较复杂的问题‘退’成最简单、最原始的问题,把这最简单、最原始的问题想通了,想透了……”然后各个击破,复杂问题也就迎刃而解,不攻自破了。
华罗庚教授所说的“退”,就是“转化”,这种“退”中求进的思维策略常被用于解决复杂的化学问题。
[例5] 向1000克未知溶质质量分数的硫酸铜溶液中加入一定量的氢氧化钠溶液,过滤、干燥后得到蓝色固体19.6克。
在所得滤液中加入过量铁粉,充分反应后,再加入足量盐酸,最后得到6.4克固体,求原溶液中硫酸铜的质量分数。
4. 由隐含转化为显露。
有些题目从表面看来似缺条件而无法求解,实际上解题条件就隐含在语言叙述、化学现象、化学原理之中。
解答此类题目的关键,是充分挖掘题中的隐含条件,化隐为显,架设由未知到已知的“桥梁”。
[例6] 将镁粉和碳酸镁的混合物置于氧气中灼烧,直至质量不再改变为止。
经测定,灼烧后所得固体质量与原混合物质量相同,求原混合物中镁粉和碳酸镁的质量比。
5. 由文字转化为图示。
有些化学计算题,叙述冗长,信息点多,一时难以理顺各种关系。
若能将文字信息转化为图示信息,则可使题意简明清晰,过程具体形象,从而发现解题的途径。
[例7] 把47克氧化铜与炭的混合物充分加热后冷却。
已知反应中炭已消耗完,剩余固体的质量为36克。
向此固体中加入100克4.9%的稀硫酸恰好完全反应,过滤后,将滤液蒸发掉46克水,再冷却到t℃时,溶液恰好饱和(无晶体析出)。
求:(1)原混合物中含多少克炭;(2)t℃时,CuSO4在水中的溶解度。
(二)化学计算中的常用解题方法和技巧1. 守恒法[例8] 某种含有MgBr2和MgO的混合物,经分析测得Mg元素的质量分数为38.4%,求溴(Br)元素的质量分数。
[例9] 将44.4克碱式碳酸铜粉末加热一段时间,经测定铜元素的质量占试管内的80℅.试求(1)求此时试管中氧化铜的质量?(2)若将试管内的剩余固体全部溶于100克盐酸溶液,求所得溶液中溶质的质量分数[例10] 有氮气、一氧化碳和二氧化碳的混合气体12g,其中碳元素的质量分数为30%,使该混合气体通过足量的灼热氧化铜充分反应后,再将气体通入过量的石灰水中,能得到白色沉淀()A. 10gB. 15gC. 30gD. 20g2. 巧设数据法[例11] 将w克由NaHCO3和NH4HCO3组成的混合物充分加热,排出气体后质量变为w/2克,求混合物中NaHCO3和NH4HCO3的质量比。
3. 极值法[例12] 取3.5克某二价金属的单质投入50克溶质质量分数为18.25%的稀盐酸中,反应结束后,金属仍有剩余;若2.5克该金属投入与上述相同质量、相同质量分数的稀盐酸中,等反应结束后,加入该金属还可以反应。
该金属的相对原子质量为()A. 24B. 40C. 56D. 654. 十字交叉法[例13] 取100克胆矾,需加入多少克水才能配成溶质质量分数为40%的硫酸铜溶液?[例14] 向100g 8%的NaOH溶液中通入CO2气体,所得溶液经小心蒸干后,所得固体的质量为13.7g,则通入CO2气体的质量。
5. 估算法有些选择题涉及计算,像这类计算题大多不用计算出确切的数值,只要大约估算一下,再依据题目中的条件,就可得出答案,这样不但不会出现计算失误,也为解决后面的问题争取了大量的时间。
[例15] 将13.2克可能混有下列物质的(NH4)2SO4样品,在加热的条件下,与过量的NaOH 反应,可收集到4.3升NH3(密度为17克/22.4升),则样品中不可能含有的物质是()A. NH4HCO3、NH4NO3B.(NH4)2CO3、NH4NO3C. NH4HCO3、NH4ClD. NH4Cl、(NH4)2CO3[例16] 将4.9克氯酸钾与1.62克二氧化锰混合后,放入试管中加热,充分反应后,试管中剩余固体物质的质量约是:A. 1.62克B. 2.98克C. 4.60克D. 6.52克6. 差量法[例17] 4.0克+2价金属的氧化物与足量的稀盐酸反应后,完全转化为氯化物,测得氯化物的质量为9.5克,通过计算指出该金属的名称。
[例18] 某有机化合物含有碳、氢、氧三种元素,其相对分子质量为32。
取该有机物6.4克,将其充分燃烧后的产物通入足量的石灰水被完全吸收,经过滤,得到20克沉淀物,滤液的质量比原石灰水减少了4克。
求:(1)原6.4克有机物中所含氧元素的质量为多少?(2)通过计算确定该有机物的化学式。
【模拟试题】1. 在温度不变的情况下,向一定量的硫酸铜溶液中加入25克胆矾(CuSO 4·5H 2O )或蒸发掉55克水均可得到饱和溶液,求该温度时硫酸铜的溶解度。
2. 在化合物X 2Y 和YZ 2中,Y 的质量分数分别为40%和50%,则在化合物X 2YZ 3中,Y 的质量分数是多少?3. 已知某混合物由Na 2S 、Na 2SO 3、Na 2SO 4三种物质组成。
经测定,其中钠元素的质量分数为m ,求混合物中氧元素的质量分数。
4. 在托盘天平的两边各放置一只烧杯,烧杯内分别盛有质量相等的同种盐酸(盐酸均过量)调节天平至平衡。
现向左边烧杯中投入纯锌7.8克,若要使反应后天平仍保持平衡,右边的烧杯中应加入多少克碳酸钙固体?5. 机动车尾气排放的氮的氧化物是城市污染源之一,其中有一种含氮约为46.7%,它是( )A. N 2OB. NO 2C. NOD. N 2O 56. 将质量分数为P%的硫酸与等体积的水混合后得到质量分数为q%的硫酸,则下列关于P 、q 的关系式正确的是( )A. q <p <2qB. p <2qC. p=2qD. p ≥2q7. 实验室用氢气还原氧化铜m 克,当大部分固体变红时停止加热,冷却后称得残留固体质量为n 克,共用去氢气w 克。
则被还原得氧化铜的质量为( )A. 40w 克B. 80n/64克C. 5(m -n )克D. m 克8. X 、Y 元素的原子量之比为2:1,由两元素形成的化合物中,X 、Y 元素的质量比为2:3,其中X 元素的化合价为+a ,则化合物中Y 元素的化合价为( )A. B. C. D.9. 将一些氧化铜粉末加入到100克14℅的硫酸溶液中微热至氧化铜全部溶解,再向该蓝色溶液中加入铁粉20克,充分反应后过滤仍得到干燥固体物质20克,求(1)原加入的氧化铜粉末的质量是多少?(2)最后得到的溶液中溶质的质量分数?10. 某溶液中含有Na +,Mg 2+,SO 42-三种离子,设Na +个数为n Na +, Mg 2+个数为n Mg 2+,SO 42-个数为n SO 42-,下列关系式正确的是( )A. n Na + + n Mg 2+ = nSO 42-B. 2n Na + = nSO 42--n Mg 2+C. n Mg 2+ = n Na + + nSO 42-D. nSO 42- = 1/2n Na + + n Mg 2+11. 已知乙醇在O 2不足时燃烧得到CO 、CO 2 和H 2O 。
今有23克乙醇与定量的O 2点燃后发生如下反应:XC 2H 5OH+8O 2=YCO 2+ZCO+9H 2O ,反应后生成H 2O 质量为27克。
求:(1)系数的值;(2)反应生成CO 的质量。
12. 氢氧化铜与一定质量的稀硫酸恰好完全反应,所得溶液中溶质的质量分数为16%,则稀硫酸中溶质的质量分数为多少?13. 托盘天平左、右两盘的烧杯中各盛有100g9.8%的稀硫酸,天平平衡。
在左盘烧杯里放入5.6gFe 片,右盘里放入一定量的其他物质,充分反应后,天平仍然保持平衡,则右盘2/a -3/a -2/3a -3/2a -放入的物质可能是()A. 5.4gCuO粉末B. 5.6gCu片C. 5.6gMg条D. 5.6gZn片14. 一定质量的氧化镁刚好与10倍质量的稀硫酸反应,则该稀硫酸的溶质的质量分数是。
15. 某5.6g不纯的铁片(含有下列一种金属)与足量的稀盐酸反应。
放出0.21g氢气,则铁片中含有的金属杂质可能是()A. ZnB. AgC. AlD. Cu16. 有80克稀硝酸溶液,取其中一半,跟100克的氢氧化钾溶液恰好完全反应,取另一半稀硝酸跟50克氢氧化钠溶液恰好完全反应,将溶液蒸发掉56克水后,所得溶液中溶质质量分数为25%。
求氢氧化钾溶液的溶质质量分数?17. 将质量分数为P%的硫酸与等体积的水混合后得到质量分数为q%的硫酸,则下列关于P、q的关系式正确的是()A. q<p<2qB. p<2qC. p=2qD. p≥2q18. 以知X和Y两种物质混合后能发生反应,设X物质的相对分子质量为A x,Y物质的相对分子质量为A y,当X和Y 按质量比A x:A y反应后,溶液的pH〉7,如果X和Y按质量比为2A x :A y,则反应后的pH=7,X、Y应是下列物质中的()A. NaCl和Ba(OH)2B. HCl和Ba(OH)2C. HCl和NaOHD. NaOH和H2SO419. 向一定质量的用氢氧化钡与氢氧化钠固体配成的混合溶液中加入足量的纯碱溶液,经充分反应后,将生成的沉淀过滤、干燥,称得沉淀的质量与配制混合液的固体总质量相等,则配制的混合溶液所用的氢氧化钡与氢氧化钠的质量比为_________【试题答案】1.解析:设想将原来的不饱和硫酸铜溶液分解成两部分(化复杂为简单):一部分是饱和溶液,另一部分是55克水,而在这55克水中若溶解25克胆矾(内含16克CuSO 4和9克H 2O ),则也恰好成为该温度时的硫酸铜饱和溶液。