甲苯、苯胺、苯甲酸三组分混合物的分离提纯及鉴定
- 格式:doc
- 大小:152.50 KB
- 文档页数:4

甲苯、苯胺、苯甲酸三组分混合物的分离纯化实验方案三种物质的性质简表如下:生成盐;苯胺显弱碱性,可与强酸反应生成盐;而甲苯不能与酸碱作用。
另一方面,离子化合物易溶于水而不易溶于有机溶剂,可以利用这种性质来进行三组分的分离。
一、先分离酸1. 分离苯甲酸取10g混合液置于100 ml 烧杯中,滴加2mol/L NaOH溶液,用pH试纸测定,滴至pH约为10左右,期间不断搅拌,使反应充分进行。
滴定完成后将烧杯中的溶液转移至100mL分液漏斗中,静置分层。
上层为有机相,含有甲苯和苯胺;下层为水相,含有苯甲酸钠和过量NaOH的混合液。
将两层分离。
2. 分离苯胺和甲苯将上步分离出的有机层(含甲苯和苯胺)接入100mL烧杯中,滴加2mol/L HCl溶液,用pH 试纸测定,滴至pH约为3左右,期间不断搅拌,使反应充分进行。
滴定完成后将烧杯中的溶液转移至100mL分液漏斗中,静置分层。
上层有机相为甲苯,下层水相为苯胺盐酸盐及过量HCl的混合液。
将两层分离。
3. 重结晶纯化苯甲酸取以上分离得到的苯甲酸钠和过量NaOH的混合液,滴加2mol/L HCl至pH=3,期间不断搅拌使苯甲酸充分沉淀。
抽滤,得苯甲酸粗品。
苯甲酸在水中的溶解度随着温度升高而改变且常温下和100℃时溶解度有较大的差(如下表),因此可用重结晶法除杂纯化。
将粗品置于250mL烧杯中,加热并加入水至刚好溶解,趁热过滤,冷却,结晶,抽滤得苯甲酸精品,晾干称重。
4. 蒸馏纯化苯胺苯胺在空气中易被氧化,因此分离后应快速进行纯化。
向上述得到的苯胺盐酸盐及过量HCl 的混合液滴加2mol/L NaOH溶液至pH=10,反应后转移到至分液漏斗中,静置分层。
下层的水相为NaCl和过量的NaOH溶液,上层的有机相为苯胺。
分出的苯胺装入100mL烧杯中,加1.5 g粒状NaOH干燥半小时,蒸馏(蒸馏装置需烘干),收集180~184℃馏分(蒸馏时加少量锌粉防止氧化),得到纯苯胺,称重。


一、实验目的1、掌握苯胺、苯甲酸分离的基本原理和方法。
2、掌握萃取、蒸馏、重结晶等基本操作。
3、学习有机化学设计实验设计方案的拟定方法。
二、实验原理1、相似相容原理:有机物一般易溶于有机物中,而无机物一般易溶于无机物中或者说极性分子一般易溶于极性分子组成的溶剂中,而非极性分子一般易溶于非极性分子组成的溶剂中。
2、重结晶原理:利用溶剂对被提纯物质及杂质在不同温度下的溶解度不同,使被提纯物质从过饱和溶液中析出,而进行的分离,提纯的目的。
3、蒸馏的原理(即含义):利用液体混合物中各组分沸点的差别,使液体混合物部分汽化并随之使蒸气部分冷凝,从而实现其所含组分的分离。
4、苯甲酸可与碱反应生成盐:C6H5COOH+NaOH→C6H5COONa+H2O苯甲酸盐可与酸反应生成苯甲酸:C6H5COONa+HCl→C6H5COOH+NaCl三四、仪器和试剂试剂:NaOH稀溶液,HCl稀溶液,纯苯胺,苯甲酸,锌粉,颗粒状NaOH。
仪器:分液漏斗,烧杯,PH试纸,玻璃棒,圆底烧瓶,冷凝管,酒精灯,量筒,普通漏斗,布氏漏斗,抽滤瓶,温度计等。
五、实验装置图六、操作步骤取混合液滴加稀NaOH 将液体移到分液漏斗1、碱化───────────→2、分离──────────→溶液至PH=10,并搅拌中静置分层,分液取上层溶液滴加稀盐酸至抽滤,洗涤3、酸化────────────→4、抽滤─────→PH=3不断搅拌使苯甲酸沉淀干燥1)加热溶解 2)趁热过滤5、重结晶───────────────→3)冷却结晶 4)抽滤干燥取下层溶液加 1)加沸石,加锌粉6、干燥────────→7、蒸馏─────────→颗粒状NaOH干燥 2)收集178℃馏分七、数据处理八、注意事项1、在萃取过程中,震荡分液漏斗时,一定要注意放气,否则压力过大引起安全事故。
2、重结晶过程中,加热溶解前须加止暴剂,以防止爆沸;在加热过程中须不断搅拌,防止液体飞溅;切不可在沸腾的溶液中加入活性炭,以免引起暴沸。

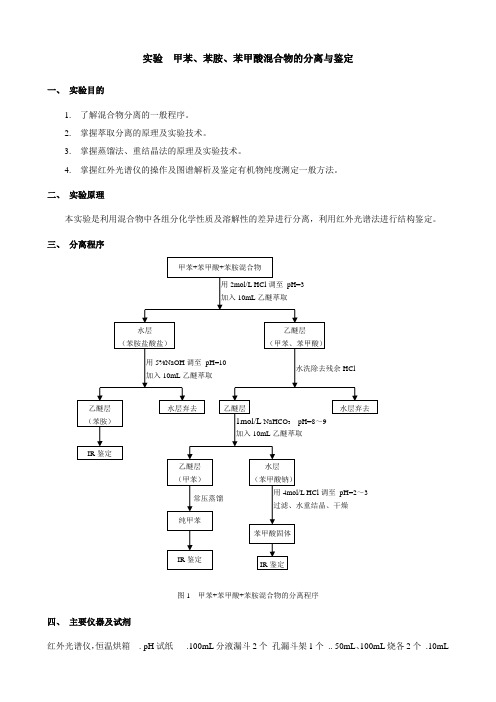
实验 甲苯、苯胺、苯甲酸混合物的分离与鉴定一、 实验目的1. 了解混合物分离的一般程序。
2. 掌握萃取分离的原理及实验技术。
3. 掌握蒸馏法、重结晶法的原理及实验技术。
4. 掌握红外光谱仪的操作及图谱解析及鉴定有机物纯度测定一般方法。
二、 实验原理本实验是利用混合物中各组分化学性质及溶解性的差异进行分离,利用红外光谱法进行结构鉴定。
三、 分离程序图1 甲苯+苯甲酸+苯胺混合物的分离程序四、 主要仪器及试剂红外光谱仪,恒温烘箱 . pH 试纸 .100mL 分液漏斗2个 孔漏斗架1个 .. 50mL 、100mL 烧各2个 .10mL1mol/L NaHCO 3 pH=8~9加入10mL 乙醚萃取 用4mol/L HCl 调至 pH=2~3过滤、水重结晶、干燥 水层 (苯胺盐酸盐) 乙醚层(甲苯、苯甲酸)用2mol/L HCl 调至pH=3 加入10mL乙醚萃取 IR 鉴定用5%NaOH 调至 pH=10加入10mL 乙醚萃取乙醚层 (苯胺) 水层 (苯甲酸钠) IR 鉴定 乙醚层 水层弃去 水洗除去残余HClIR 鉴定水层弃去乙醚层 (甲苯) 苯甲酸固体 甲苯+苯甲酸+苯胺混合物常压蒸馏纯甲苯移液管2个. 玻璃棒1个.直径5cm漏斗1个. 2mol/L、4mol/L HCl各保存于250mL滴瓶中. 5% NaOH保存于250mL滴瓶中. 1mol/L NaHCO3保存于250mL滴瓶中. 甲苯+苯甲酸+苯胺混合物. 蒸馏装置1套 . 滤纸 .干燥器1个. 25ml蒸馏瓶3个五、实验步骤1. 取5mL甲苯+苯甲酸+苯胺混合物于100ml分液漏斗中,加入2mol/L HCl至pH=3,充分摇动,此时苯胺与HCl反应生成易溶于水的苯胺盐酸盐。
加入10mL乙醚萃取(5~8))min,静置,分离水层和醚层。
2. 于水层中加入5%NaOH至pH=10,充分摇动,此时苯胺游离出来,再加入10mL乙醚萃取(5~8) min,静置,分离水层和醚层。

甲苯、苯胺、苯甲酸三组分混合物的分离提纯及鉴定甲苯、苯胺、苯甲酸三组分混合物是一种常见的有机化合物混合物,它们在化学反应和工业生产中有广泛应用。
对这种混合物进行分离和提纯,可以为化学研究和生产提供有力的支持。
本文将介绍如何对甲苯、苯胺、苯甲酸三组分混合物进行分离提纯及鉴定。
一、分离方法甲苯、苯胺、苯甲酸三组分混合物的分离,可以通过三种方法来实现:蒸馏法、萃取法和结晶法。
1、蒸馏法蒸馏法是将混合物加热,使其沸腾,然后通过蒸馏收集不同沸点的组分。
在甲苯、苯胺、苯甲酸三组分混合物中,甲苯和苯甲酸的沸点相近,都在200℃左右,而苯胺的沸点较低,只有182℃。
因此,可以通过对混合物进行加热和冷凝,使其按照沸点逐个分离。
具体操作步骤如下:(1)在蒸馏瓶中加入混合物,加入足够的石英沙作为沙浴,并接上冷凝管。
(2)用热水浴将混合物加热至沸腾,将冷凝管与三个接收瓶相连,分别收集甲苯、苯胺和苯甲酸。
(3)收集到的各组分需要进行进一步的提纯和鉴别,如下文所述。
2、萃取法萃取法是利用溶液中组分的互相溶解性不同,在不同的溶剂中萃取分离出不同的组分。
对甲苯、苯胺、苯甲酸三组分混合物,可以使用盐酸和氢氧化钠溶液进行酸碱萃取分离。
(1)在一定比例的盐酸溶液中加入混合物,搅拌均匀,待三组分被完全转化为其盐时,过滤除去不溶物,收集溶液。
3、结晶法结晶法是利用溶液中物质的溶解度差异,通过一定条件下的结晶得到纯净的晶体。
对甲苯、苯胺、苯甲酸三组分混合物,可以采用逐步降温结晶法分离。
(1)将混合物溶于适宜的溶剂中,加热至溶解,过滤除去不溶物,收集溶液。
(2)缓慢降温,使溶液中某一种组分结晶析出,收集结晶固体。
(3)用其他溶剂或溶剂的混合物,高温加热溶解收集的结晶固体,再进行逐步降温得到另一种组分的结晶固体。
(4)重复以上步骤,直至得到三种纯净的组分结晶,进行进一步纯化和鉴别。
二、提纯方法得到不同组分的混合溶液或三种结晶固体后,需要进一步对其进行精细化提纯。
苯、甲苯、乙苯混合物的分离与定量分析一.实验目的1.了解气相色谱仪的基本结构及操作步骤。
2.掌握气相色谱法分离多组分混合物的方法。
3.练习用归一化法定量测定混合物中各组分的含量二.实验原理1.气相色谱:气相色谱法是指用气体作为流动相的色谱法,主要是利用物质的沸点、极性及吸附性质的差异来实现混合物的分离。
待分析样品在汽化室汽化后被惰性气体(即载气:氮气)带入色谱柱,柱内含有固定相(邻苯二甲酸二壬酯)。
由于样品中各组分的沸点、极性或吸附性能不同,每种组分都倾向于在流动相和固定相之间形成分配或吸附平衡。
气相色谱主要由五部分组成:气路系统、进样系统、分离系统、温控系统、检测记录系统。
其中的分离系统和检测系统是仪器的核心。
(1-载气钢瓶;2-减压阀;3-净化干燥管;4-针形阀;5-流量计;6-压力表;7-进样口;8-色谱柱;9-热导检测器;10-放大器;11-温度控制器;12-记录仪)苯、甲苯、乙苯的沸点依次增高,所以汽化时苯先达到沸点汽化,甲苯、乙苯再依次汽化,故苯的保留时间最短,甲苯、乙苯的保留时间依次增长,故可以通过保留时间对混合物进行定性分析。
根据三者峰面积的不同则可以进行定量分析。
2.归一化法:若试样中含有n 个组分,且各组分均能洗出色谱峰,则其中某个组分的质量可按下式计算:三.实验仪器与试剂 Agilent Technologies 6890N 气相色谱仪热导池检测器微量注射器(1μL )苯(分析纯)甲苯(分析纯)乙苯(分析纯)丙酮(色谱纯)四.实验步骤1.取10支点样管,分别放两份丙酮、苯、甲苯、乙苯。
按照体积比苯:甲苯:乙苯=1:1:1配制两份混合液并摇匀。
(一份用于洗涤进样器,一份用于进样,防止污染试剂)2.自右向左打开仪器。
○1开气瓶时,先开减压阀,再开总阀,最后将减压阀调制0.5MPa 。
100)(100%1''21⨯⋅⋅=⨯+++=∑=n i i i i i ni i A f A f m m m m c○2开气相色谱仪,自检4-5min。
苯甲酸的分离提纯方法(一)苯甲酸的分离提纯方法1. 介绍•苯甲酸,化学式C6H5COOH,是一种常见的有机酸,常用于制药、染料和防腐剂的生产。
•分离提纯苯甲酸的目的是去除杂质,获得高纯度的苯甲酸。
2. 结晶法•结晶法是最常用的苯甲酸分离提纯方法之一。
•原理:利用苯甲酸在溶液中的溶解度随温度变化而变化,使溶解度较低的苯甲酸结晶出来。
•步骤:1.将苯甲酸与溶剂(如水、醇类)混合,加热搅拌使苯甲酸完全溶解。
2.缓慢冷却溶液,使苯甲酸结晶析出。
3.用过滤器或离心机将苯甲酸结晶物分离出来。
4.将分离得到的苯甲酸结晶物进行干燥,即可得到纯净的苯甲酸。
3. 蒸馏法•蒸馏法是另一种常用的苯甲酸分离提纯方法。
•原理:利用苯甲酸与溶剂之间的沸点差异,将苯甲酸从溶剂中分离出来。
•步骤:1.将含有苯甲酸的溶液加入至蒸馏瓶中,并加热。
2.控制蒸馏瓶中的温度,使溶剂汽化,苯甲酸随之蒸馏出来,通过冷凝管进入收集瓶。
3.收集瓶中的苯甲酸液体冷却后,即可得到纯净的苯甲酸。
4. 溶剂萃取法•溶剂萃取法是一种常用的苯甲酸分离提纯方法,尤其适用于含有非极性杂质的体系。
•原理:利用苯甲酸与溶剂在溶液中的不同溶解度,使苯甲酸从溶液中转移到溶剂中。
•步骤:1.将含有苯甲酸的溶液与溶剂混合。
2.充分搅拌溶液和溶剂,使苯甲酸转移到溶剂中。
3.静置一段时间,待溶剂和溶液分层。
4.用分液漏斗或离心机将溶剂层分离出来。
5.将分离得到的溶剂层进行干燥,即可得到纯净的苯甲酸。
5. 结论•苯甲酸的分离提纯方法有:结晶法、蒸馏法和溶剂萃取法。
•在选择具体的分离提纯方法时,需根据实际情况和需求综合考虑。
•正确应用这些方法可以获得高纯度的苯甲酸,提高产品质量和市场竞争力。
6. 结晶法的优点和缺点6.1 优点•结晶法相对简单易操作,不需要复杂的设备。
•结晶法适用于溶解度随温度变化较大的物质,尤其适用于分离提纯晶体化合物。
•结晶法得到的产物纯度较高,可达到工业要求。
苯甲酸,甲苯,苯胺的分离的实验报告周则杨2013301040110一、实验目的1. 了解甲苯、苯胺、苯甲酸的酸碱性和物理性质;2. 掌握萃取、干燥、蒸馏、重结晶等基本操作和仪器的使用;3. 掌握有机混合物分离提纯及鉴定的一般原则和方法;4. 掌握红外光谱仪的操作及图谱解析及质谱测定。
二、实验原理由三种物质的酸碱性各异,可设计酸碱反应法分离:常温下苯甲酸显弱酸性,可与强碱反应生成盐;苯胺显弱碱性,可与强酸反应生成盐;而甲苯不能与酸碱作用。
另一方面,离子化合物易溶于水而不易溶于有机溶剂,可以利用这种性质来进行三组分的分离。
三种物质得到分离后,可根据各自的物理性质(包括沸点和溶解性质等),利用蒸馏法、重结晶等操作来分别进行分离纯化;最后测分离纯化后苯甲酸的熔点,测定甲苯和苯胺的红外光谱,以及分别测定甲苯、苯胺和苯甲酸的质谱。
三、主要试剂及产物的物理常数四、实验装置图五、实验步骤 碱法1 分离苯甲酸称取 13.31g 混合液置于100 ml 烧杯中,加入6 mol/L N a OH 至pH=10, 搅拌,使反应充分,转移至50ml 分液漏斗中,静置分层。
上层为有机相,含有甲苯和苯胺;下层为水相,含有苯甲酸钠盐和过量的NaOH 混合液。
2 重结晶纯化苯甲酸按上述将水相放出,向其中加入6 mol/L HCl 至pH=3,抽滤得苯甲酸粗品。
温度/℃ 25 50 95溶解度/g 0.17 0.95 6.8由此可知通过重结晶可以较好地去除杂质,达到纯化的目的。
将粗品加入250ml 烧杯中,加入100ml水,加热至完全溶解,趁热过滤,冷却,结晶,再抽滤得纯苯甲酸,晾干,称重,得到苯甲酸1.51g。
3 分离苯胺和甲苯将第一步分离出的有机层(含甲苯和苯胺)接入100 ml 小烧杯中,加入6 mol/L HCl 至pH=3,充分反应后置于100 ml 分液漏斗中,静置分层。
上层有机相为甲苯,下层水相为苯胺的盐酸盐。
4 纯化苯胺由于苯胺易被氧化,先分离纯化苯胺。
甲苯、苯胺、苯甲酸三组分混合物的分离及鉴定实验方案
柏东生2012301040080
一、实验目的
1. 了解甲苯、苯胺、苯甲酸的酸碱性和物理性质;
2. 掌握萃取、干燥、蒸馏、重结晶、折射率的测定等基本操作和仪器的使用;
3. 掌握有机混合物分离提纯及鉴定的一般原则和方法。
二、实验原理
所给三种物质的酸碱性存在差别,可设通过酸碱反应法分离:常温下苯甲酸显弱酸性,可与强碱反应生成盐;苯胺显弱碱性,可与强酸反应生成盐;而甲苯不能与酸碱作用。
另一方面,离子化合物易溶于水而不易溶于有机溶剂,可以利用这种性质来进行三组分的分离。
三种物质得到分离后,可根据各自的物理性质(包括沸点和溶解性质等),利用蒸馏法、重结晶等操作来分别进行分离纯化;最后测分离纯化后三种样品的熔点或折光率来鉴定样品成分。
MSDS:
甲苯(C6H5CH3),无色澄清液体,易燃,苯样气味,有强折光性。
它的熔点为–95℃,沸点110.8℃,密度0.866g/cm3,折光率1.4967。
甲苯极微溶于水,能与乙醇、乙醚、丙酮、氯仿、二硫化碳和冰乙酸等混溶。
苯胺(C6H5NH2),无色透明油状液体,弱碱性,在光照或高温下易被氧化变黑,加热至370℃分解。
它的熔点为-6.3℃,沸点184℃,密度 1.02 g/cm3,折光率1.5863。
常温下苯胺稍溶于水,易溶于乙醇、苯、乙醚、氯仿等有机溶剂;但随着温度的升高而增大,当温度高于167.5℃时,苯胺与水能以任意比例互溶。
苯甲酸(C6H5COOH),无色、无味的针状或片状晶体,弱酸性,具有苯或甲醛的气味。
它的熔点为122.13℃,沸点249℃,密度1.2659 g/cm3,在100℃时迅速升华。
苯甲酸微溶于水,易溶于乙醇、乙醚等有机溶剂。
三、实验仪器及试剂
材料:甲苯、苯胺及苯甲酸三组分混合物10g
仪器:100mL烧杯3只、250mL烧杯1只、100mL分液漏斗1个、100mL 圆底烧瓶1个、100mL量筒、普通漏斗、布氏漏斗、抽滤瓶、直形冷凝管、温度计、接液管、pH试纸、电热套、熔点测定仪、折光仪等。
试剂:2mol/L 盐酸、2mol/L NaOH溶液、无水NaOH固体、无水MgSO4固体等。
四、实验步骤
(一)分离
1. 分离苯甲酸
取10g混合液置于100 ml 烧杯中,滴加2mol/L NaOH溶液,用pH试纸测定,滴至pH约为10左右,期间不断搅拌,使反应充分进行。
滴定完成后将烧杯中的溶液转移至100mL分液漏斗中,静置分层。
上层为有机相,含有甲苯和苯胺;下层为水相,含有苯甲酸钠和过量NaOH的混合液。
将两层分离。
2. 分离苯胺和甲苯
将上步分离出的有机层(含甲苯和苯胺)接入100mL烧杯中,滴加2mol/L HCl 溶液,用pH试纸测定,滴至pH约为3左右,期间不断搅拌,使反应充分进行。
滴定完成后将烧杯中的溶液转移至100mL分液漏斗中,静置分层。
上层有机相为甲苯,下层水相为苯胺盐酸盐及过量HCl的混合液。
将两层分离。
(二)纯化
1. 重结晶纯化苯甲酸
取(一)中分离得到的苯甲酸钠和过量NaOH的混合液,滴加2mol/L HCl 至pH=3,期间不断搅拌使苯甲酸充分沉淀。
抽滤,得苯甲酸粗品。
将粗品置于100mL烧杯中,加适量水加热至沸形成近饱和溶液,趁热过滤,冷却,结晶,抽滤得苯甲酸精品,晾干称重。
2. 蒸馏纯化苯胺
苯胺在空气中易被氧化,因此分离后应快速进行纯化。
在(一)中得到的苯胺盐酸盐及过量HCl的混合液滴加2mol/L NaOH溶液至pH=10。
反应后转移到至分液漏斗中,静置分层。
下层的水相为NaCl和过量的NaOH 溶液,上层的有机相为苯胺。
分出的苯胺装入100mL烧杯中,加适量无水NaOH固体干燥半小时,蒸馏(蒸馏装置需烘干),收集180~184℃馏分(蒸馏时加少量锌粉防止氧化),得到纯苯胺,称重。
3. 蒸馏纯化甲苯
在(一)中得到的甲苯中加入2g无水MgSO4固体,干燥半小时后过滤。
蒸馏滤液(蒸馏装置需烘干),收集109~111℃馏分,得纯甲苯,称重。
五、注意事项
1. 甲苯遇热、明火、氧化剂等易爆炸,蒸气能与空气形成爆炸性混合物,爆炸极限1.2%~7.0%(体积)。
低毒,半数致死量(大鼠,经口)5000mg/kg。
有刺激性。
高浓度气体有麻醉性。
2. 苯胺有毒、遇热、明火、氧化剂等易爆炸。
3. 苯甲酸易燃,蒸气有很强的刺激性,吸入后易引起咳嗽。
甲苯红外光谱图
苯胺红外光谱图
苯甲酸红外光谱图。