电极电势的能斯特方程PPT幻灯片
- 格式:ppt
- 大小:587.00 KB
- 文档页数:26




电极电势课件1、电极电势的产生——双电层理论德国化学家能斯特提出了双电层理论解释电极电势的产生的原因。
当金属放入溶液中时,一方面金属晶体中处于热运动的金属离子在极性水分子的作用下,离开金属表面进入溶液。
金属性质愈活泼,这种趋势就愈大;另一方面溶液中的金属离子,由于受到金属表面电子的吸引,而在金属表面沉积,溶液中金属离子的浓度愈大,这种趋势也愈大。
在一定浓度的溶液中达到平衡后,在金属和溶液两相界面上形成了一个带相反电荷的双电层(electrondoublelayer),双电层的厚度虽然很小(约为10-8厘米数量级),但却在金属和溶液之间产生了电势差。
通常人们就把产生在金属和盐溶液之间的双电层间的电势差称为金属的电极电势,并以此描述电极得失电子能力的相对强弱。
电极电势以符号EMn+/M表示,单位为V(伏)。
如锌的电极电势以EZn2+/Zn表示,铜的电极电势以ECu2+/Cu 表示。
电极电势的大小主要取决于电极的本性,并受温度、介质和离子浓度等因素的影响。
2、标准电极电势为了获得各种电极的电极电势数值,通常以某种电极的电极电势作标准与其它各待测电极组成电池,通过测定电池的电动势,而确定各种不同电极的相对电极电势E值。
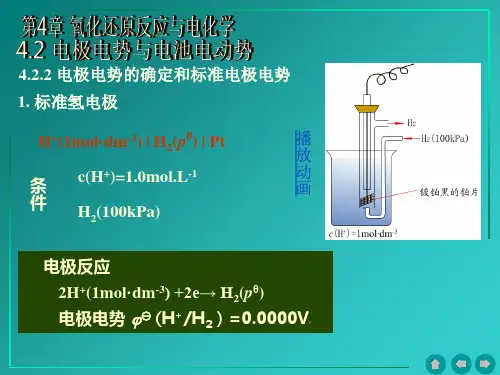
20xx年国际纯粹化学与应用化学联合会的建议,采用标准氢电极作为标准电极,并人为地规定标准氢电极的电极电势为零。
标准氢电极电极符号:Pt|H2(101.3kPa)|H+(1mol.L-1)电极反应:2H++2e=H2EφH+/H2=0V右上角的符号“φ”代表标准态。
标准态要求电极处于标准压力下,组成电极的固体或液体物质都是纯净物质;气体物质其分压为101.325kPa;组成电对的有关离子的浓度为1mol.L-1。
通常测定的温度为298K。
(2)标准电极电势用标准氢电极和待测电极在标准状态下组成电池,测得该电池的电动势值,并通过直流电压表确定电池的正负极,即可根据E 池=E-E计算各种电极的标准电极电势的相对数值。


电极电势课件判断氧化还原反应的方向1.根据Eφ值,判断标准状况下氧化还原反应进行的方向。
通常条件下,氧化还原反应总是由较强的氧化剂与还原剂向着生成较弱的氧化剂和还原剂方向进行。
从电极电势的数值来看,当氧化剂电对的电势大于还原剂电对的电势时,反应才可以进行。
反应以“高电势的氧化型氧化低电势的还原型的方向进行。
在判断氧化还原反应能否自发进行时,通常指的是正向反应。
2.根据电池电动势Eφ池值,判断氧化还原反应进行方向。
任何一个氧化还原反应,原则上都可以设计成原电池。
利用原电池的电动势可以判断氧化还原反应进行的方向。
由氧化还原反应组成的原电池,在标准状态下,如果电池的标准电动势>0,则电池反应能自发进行;如果电池的标准电动势<0,则电池反应不能自发进行。
在非标准状态下,则用该状态下的电动势来判断。
从原电池的电动势与电极电势之间的关系来看,只有>时,氧化还原反应才能自发地向正反应方向进行。
也就是说,氧化剂所在电对的电极电势必须大于还原剂所在电对的电极电势,才能满足E>0的条件。
从热力学讲电池电动势是电池反应进行的推动力。
当由氧化还原反应构成的电池的电动势Eφ池大于零时,则此氧化还原反应就能自发进行。
因此,电池电动势也是判断氧化还原反应能否进行的判据。
电池通过氧化还原反应产生电能,体系的自由能降低。
在恒温恒压下,自由能的降低值等于电池可能作出的最大有用电功:-△G=W电=QE=nFE池即△G=-nFE池在标准状态下,上式可写成:△Gφ=-nFEφ池当Eφ池为正值时,△Gφ为负值,在标准状态下氧化还原反应正向自发进行;当Eφ池为负值时,△Gφ为正值,在标准状态下反应正向非自发进行,逆向反应自发进行。
E或Eφ愈是较大的正值,氧化还原反应正向自发进行的倾向愈大。
E池或Eφ池愈是较大的负值,逆向反应自发进行的倾向愈大。
[例2]试判断反应Br+2Fe2Fe+2Br在标准状态下进行的方向。
解:查表知:Fe+eFe=+0.771VBr+2e2Br=+1.066V由反应式可知:Br是氧化剂,Fe是还原剂。




能斯特方程计算电极电势
能斯特方程(Nernst equation)是描述电化学反应中电极电势与物质浓度之间关系的方程。
它是由德国化学家沃尔弗冈·能斯特于19世纪末提出的,被认为是电化学基础理论的重要组成部分。
能斯特方程广泛应用于电化学实验和工业生产中,用于计算电极电势的变化。
E = E° - (RT/nF) ln(Q)
在这个方程中,E是电极电势,E°是标准电极电势,R是气体常数,T是温度,n是电子转移的摩尔数,F是法拉第常数,Q是反应物浓度的比值。
能斯特方程的应用范围很广。
它可以用来计算电池的电势差,以及电解过程中物质浓度对电极电势的影响。
在电池的设计和优化过程中,能斯特方程可以帮助确定最佳的反应条件,以提高电池的效能。
在环境监测和化学分析中,能斯特方程可以用来计算溶液中各种物质的浓度。
除了上述标准条件下的能斯特方程,还存在一些修正的能斯特方程,用于考虑非标准条件下的电极电势计算。
例如,考虑溶液的pH值、温度变化或电解质浓度差异等因素。
总之,能斯特方程是电化学领域中重要的计算公式,用于描述电极电势与物质浓度之间的关系。
通过能斯特方程,我们可以了解电化学反应的热力学特征,并为实验和工业应用提供指导。