库尔提斯重排反应
- 格式:doc
- 大小:695.50 KB
- 文档页数:13

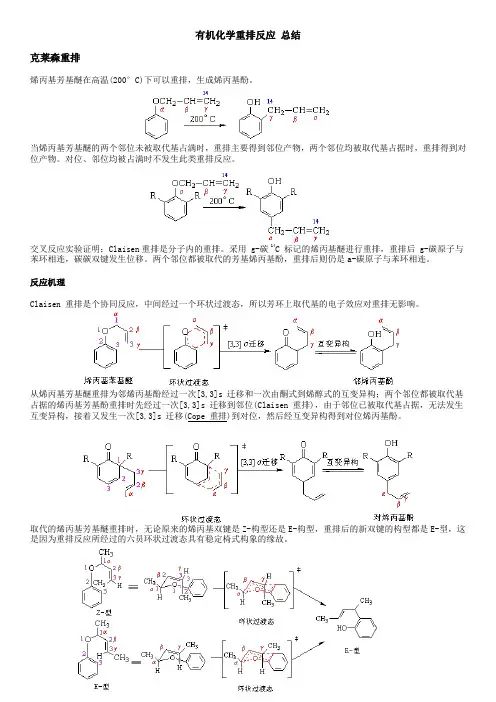
有机化学重排反应总结克莱森重排烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。
当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。
对位、邻位均被占满时不发生此类重排反应。
交叉反应实验证明:Claisen重排是分子内的重排。
采用 g-碳 14C 标记的烯丙基醚进行重排,重排后 g-碳原子与苯环相连,碳碳双键发生位移。
两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯环相连。
反应机理Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。
从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移和一次由酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。
取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E-构型,重排后的新双键的构型都是E-型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。
Claisen 重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连的结构,就有可能发生Claisen 重排。
2.Beckmann贝克曼重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:3.Bamberger,E.重排苯基羟胺〔N-羟基苯胺〕和稀硫酸一起加热发生重排成对-氨基苯酚:在H2SO4-C2H5OH(或CH3OH)中重排生成对-乙氧基〔或甲氧基〕苯胺:其他芳基羟胺,它的环上的o-p位上未被取代者会起类似的重排。


重排反应总结1、什么叫重排反应?一般地,在进攻试剂作用或者介质的影响下,有机分子发生原子或原子团的转移和电子云密度重新分布,或者重键位置改变,环的扩大或缩小,碳骨架发生了改变等等,这样的反应称为重排反应。
简单的理解:重排反应是指反应中烃基或氢原子或别的取代基从分子中的一个原子迁移到该分子中的另一个原子上的变化。
(指分子内重排)2、重排的分类按反应机理 ,重排反应可分为:基团迁移重排反应和周环反应中的重排。
基团迁移重排反应 即反应物分子中的一个基团在分子范围内从某位置迁移到另一位置的反应。
常见的迁移基团是烃基。
基团迁移重排反应又包括缺电子重排(亲核重排),富电子重排(亲电重排)和自由基重排.。
周环反应中的重排包括电环反应、σ键迁移。
也可按照不同的标准,分成分子内重排和分子间重排,光学活性改变和不改变的重排反应等等。
本讲义把重排分为以下几类:a.从碳原子到碳原子的重排 b.从碳原子到杂原子的重排 c.从杂原子到碳原子的重排 d.其它重排一、从碳原子到碳原子的重排反应1、Wangner-Meerwein 重排(瓦格纳尔—米尔外英重排,简称瓦—米重排)两个相邻原子之间发生的重排叫1,2重排,也叫Wangner-Meerwein 重排。
如:醇或卤代烃在酸催化下进行亲核取代或消除反应时,烯烃进行亲电加成时发生的重排。
例如:a.亲电加成时发生的重排如果反应液中同时存在两种或是两种以上的亲核试剂,则通过中间体碳正离子,能够生成混合加成产物。
R 2C R 3R 1C OHR 4R 5R 2C R 3R 1CR 4R 5R 1CR 2C R 3R4R 5R1CR 2CR 3R 4R 5OH H +(-H O)重排H O(-H +)b.醇进行亲核取代和消除时的重排亲核取代时,除大多数伯醇难以形成正碳离子而按S N 2反应外,仲醇或叔醇反应常伴随着重排产物的产生。
(S N 1)消去时(S N 1):c.卤代烃进行亲核取代和消除时的重排亲核取代按S N 1机理反应时伴随着碳正离子的重排 消去时注意:有碳正离子形成时,就有可能伴随着重排反应 形成C +的方式总结: (a)卤代烃 (AgNO 3醇溶液) (b)含-NH 2,重氮化放氮气(c)-OH ,加 H + (失H 2O),烯烃加H +基团迁移顺序:对迁移顺序的理解:迁移基团的电子云密度越大越容易迁移(但具体情况下,要具体分析)(CH 3)3C-CH 2Cl(CH 3)32Ag (AgNO 3(CH 3)3C-CH 2N 2Cl-N 2(CH 3)3C-CH 2(CH 3)3C-CH 3NH 2NaNO 2△(CH 3)3C-CH 2OH (CH 3)3C-CH 2=CH 2(CH 3)32(CH 3)33H +2H +ClR 3C-R 2CH-RCH 3-CH 3-H->>>>>>OCH 3>反应举例:2、Pinacol (频哪醇)重排(邻二醇重排)当起始物的脱水产物能产生两种不同的正离子时,总是生成更稳定的正碳离子为主,有不同迁移基团时,按迁移的难易程度进行。
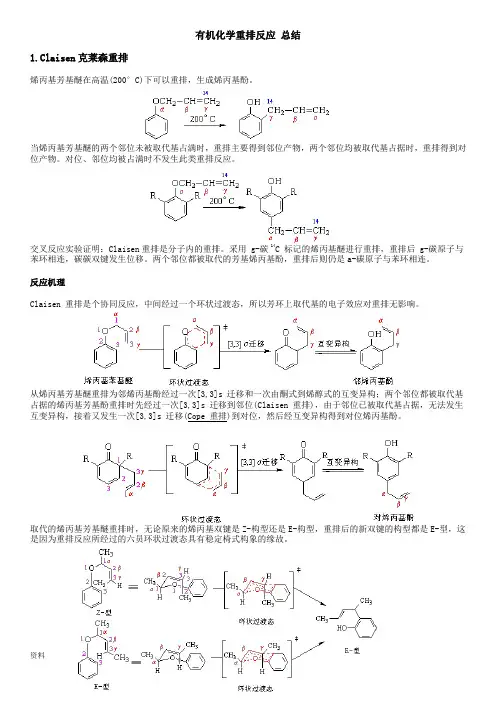
有机化学重排反应总结1.Claisen克莱森重排烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。
当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。
对位、邻位均被占满时不发生此类重排反应。
交叉反应实验证明:Claisen重排是分子内的重排。
采用 g-碳 14C 标记的烯丙基醚进行重排,重排后 g-碳原子与苯环相连,碳碳双键发生位移。
两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯环相连。
反应机理Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。
从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移和一次由酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。
取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E-构型,重排后的新双键的构型都是E-型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。
反应实例Claisen 重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连的结构,就有可能发生Claisen 重排。
2.Beckmann贝克曼重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例3.Bamberger,E.重排苯基羟胺(N-羟基苯胺)和稀硫酸一起加热发生重排成对-氨基苯酚:在H2SO4-C2H5OH(或CH3OH)中重排生成对-乙氧基(或甲氧基)苯胺:其他芳基羟胺,它的环上的o-p位上未被取代者会起类似的重排。
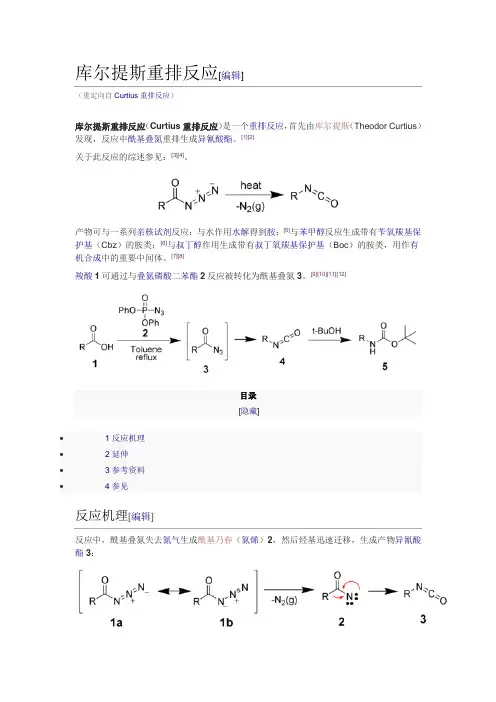
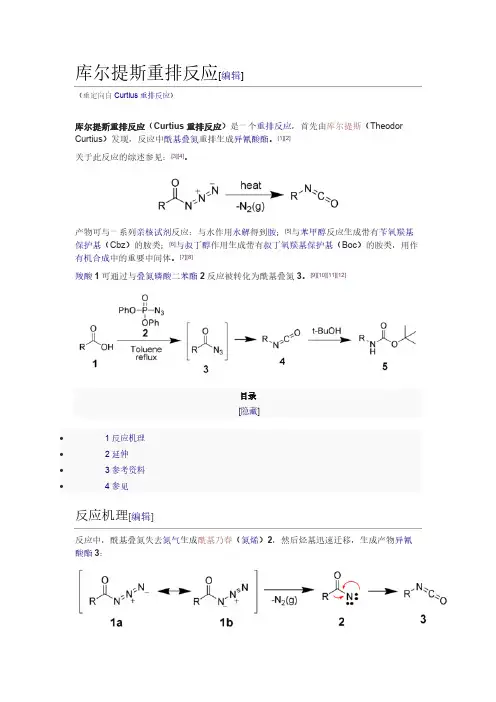
库尔提斯重排反应[编辑](重定向自Curtius重排反应)库尔提斯重排反应(Curtius重排反应)是一个重排反应,首先由库尔提斯(Theodor Curtius)发现,反应中酰基叠氮重排生成异氰酸酯。
[1][2]关于此反应的综述参见:[3][4]。
产物可与一系列亲核试剂反应:与水作用水解得到胺;[5]与苯甲醇反应生成带有苄氧羰基保护基(Cbz)的胺类;[6]与叔丁醇作用生成带有叔丁氧羰基保护基(Boc)的胺类,用作有机合成中的重要中间体。
[7][8]羧酸1可通过与叠氮磷酸二苯酯2反应被转化为酰基叠氮3。
[9][10][11][12]目录[隐藏]∙ 1 反应机理∙ 2 延伸∙ 3 参考资料∙ 4 参见反应机理[编辑]反应中,酰基叠氮失去氮气生成酰基乃春(氮烯)2,然后烃基迅速迁移,生成产物异氰酸酯3:延伸[编辑]在Curtius重排反应的基础上,Darapasky递降反应(A. Darapsky, 1936)以α-氰基酯为原料,通过重排反应生成氨基酸。
[13]参考资料[编辑]1. ^ Curtius, T. Ber.1890, 23, 3023.2. ^ Curtius, T. J. Prakt. Chem.1894, 50, 275.3. ^ Smith, P. A. S. Org. React.1946, 3, 337-449. (Review)4. ^ Scriven, E. F.; Turnbull, K.; Chem. Rev.1988, 88, 297-368. Review5. ^ Kaiser, C.; Weinstock, J. Organic Syntheses, Coll. Vol. 6, p.910 (1988); Vol. 51,p.48 (1971).Article6. ^ Ende, D. J. a.; DeVries, K. M.; Clifford, P. J.; Brenek, S. J. Org. Proc. Res.Dev.1998, 2, 382-392.7. ^ Lebel, H.; Leogane, O.; Org. Lett.2005, 7(19),4107-4110. doi:10.1021/ol051428b8. ^ Shioiri, T.; Yamada, S. Organic Syntheses, Coll. Vol. 7, p.206 (1990); Vol. 62,p.187 (1984).Article9. ^ Shioiri, T.; Ninomiya, K.; Yamada, S. J. Am. Chem. Soc.1972, 94,6203-6205.doi:10.1021/ja00772a05210. ^ Ninomiya, K.; Shioiri, T.; Yamada, S. Tetrahedron1974, 30, 2151-2157.11. ^ Wolff, O.; Waldvogel, S. R. Synthesis2004, 1303-1305.12. ^ Jessup, P. J.; Petty, C. B.; Roos, J.; Overman, L. E. Organic Syntheses, Coll.Vol. 6, p.95 (1988); Vol. 59, p.1 (1979). Article13. ^/reactions/RXN051.htm(重定向自贝克曼重排)贝克曼重排反应(Beckmann rearrangement)是一个由酸催化的重排反应,反应物肟在酸的催化作用下重排为酰胺。
![异氰酸酯中间态的重排反应[研究知识]](https://uimg.taocdn.com/73501269b90d6c85ec3ac69f.webp)


有机重排反应详尽总结重排反应(rearrangement reaction)是分子的碳骨架发生重排生成结构异构体的化学反应,是有机反应中的一大类。
重排反应通常涉及取代基由一个原子转移到同一个分子中的另一个原子上的过程,现将有机重排反应进行一个详尽的总结。
(1)Amadori重排反应酸或碱催化下醛糖的N-糖苷(糖胺,glycosylamines)异构化生成1-胺基-1-脱氧酮糖的反应被称为Amadori重排反应。
此反应的底物和产物都称为“Amadori化合物”。
各种Lewis酸都已应用于此反应:CuCl2 , MgCl2 , HgBr2 , CdCl2 , AlCl3 , SnCl4 , etc。
此反应中只需催化量的酸就可以催化胺和醛糖反应,进而重排。
伯胺,仲胺,脂肪胺或芳香胺都可以发生此反应。
糖胺类化合物会发生复杂的美拉德反应(食物在烹饪或储藏过程中糖,胺,氨基酸和蛋白质等进行重排和降解)。
此反应中生成的黑色产物是由于发生了此类非酶褐变反应。
(2)Baker-Venkataraman重排贝克-文卡塔拉曼重排反应(Baker-Venkataraman重排)是2-乙酰氧基苯乙酮衍生物在碱作为催化剂之下生成1,3-二酮的反应。
这个反应常用于制造色酮和黄酮类化合物。
(3)Bamberger RearrangementN-芳基羟胺在强酸水溶液作用下重排为氨基苯酚的反应。
(4)Beckmann Rearrangement贝克曼重排反应(Beckman rearrangement)指醛肟或酮肟在酸催化下生成N-取代酰胺的亲核重排反应,反应中起催化作用的酸常用五氯化磷。
此反应是由德国化学家恩斯特·奥托·贝克曼发现并由此得名。
(5)Brook RearrangementC-Si→O-Si的离子性重排反应,从羟基硅烷到硅醚的转化。
Brook 重排反应的推动力是产物中键能较高的 Si-O 键的生成。
Curtius重排酰基叠氮加热进行1,2-C-N迁移并放出氮气,生成异氰酸酯的反应被称为Curtius重排。
反应中原位生成的异氰酸酯和各种亲核试剂反应,可以得到氨基甲酸酯,脲等各种N-酰基衍生物。
也可以直接水解得到伯胺。
酰氯被转化为酰基叠氮,其加热重排脱去一分子氮气后得到相应的异氰酸酯,异氰酸酯水解或和其他亲核试剂反应得到胺及相应的衍生物。
早期的合成方法都是将酸转变为相应的酰氯,再生成酰基叠氮。
后来Shiori(JACS,1972,94,6203)等人报道了DPPA和羧酸在室温下很温和的生成酰基叠氮,可一锅法合成胺。
若直接用过量的醇或直接用醇做溶剂可得到相应的胺的衍生物。
如用苄醇可一步得到Cbz保护的胺; 用叔丁醇可一步得到Boc保护的胺。
反应机理热重排机理:光照条件下也可以重排,酰基叠氮在光照条件下先生成氮宾,而后重排为异氰酸酯:反应实例相关文献1. Curtius, T. Ber. 1890, 23, 3033-3041. Theodor Curtius (1857-1928) was born in Duisburg, Germany. He studied music before switching to chemistry under Bunsen, Kolbe, and von Baeyer before succeeding Victor Meyer as a Professor of Chemistry at Heidelberg. He discovered diazoacetic ester, hydrazine, pyrazoline derivatives, and many nitrogen-heterocycles. Curtius also sang in concerts and composed music.【Theodor Curtius (1857-1928)生于德国杜伊斯堡。
柯提斯重排反应条件
柯提斯重排反应是有机化学中的一种重要反应,通常用于环烷烃环的转化。
该反应可以使环烷烃环的结构发生变化,同时还可以生成具有不同功能团的有机物。
柯提斯重排反应的条件十分重要,为了使反应有效进行,我们需要掌握一些基本的反应条件。
1. 反应物
柯提斯重排反应的反应物通常是环烷烃环。
这些化合物通常具有较高的环张力,需要在一定条件下进行转化。
2. 溶剂
反应的溶剂对柯提斯重排反应的成败至关重要。
通常使用氯化氢、氯化铝等强酸性溶剂来促进反应的进行。
这些溶剂可以使环烷烃环的环张力降低,从而使反应更容易进行。
3. 温度
柯提斯重排反应的温度也是非常重要的,一般来说,反应的温度很高,通常在
150~200℃之间。
高温可以使反应物分子更加活跃,增加反应的速率。
4. 其他添加剂
柯提斯重排反应有时需要添加其他的试剂来增强反应的效果。
例如,苯酚可以被添加到反应中来清除卤素气体产生的影响。
总之,柯提斯重排反应涉及到诸多条件,需要合理的选择和配合,才能实现反应的有效进行。
研究前人在本领域的成果是非常必要的,可以为我们选择和优化反应条件提供帮助。
库尔提斯重排反应[编辑](重定向自Curtius重排反应)库尔提斯重排反应(Curtius重排反应)是一个重排反应,首先由库尔提斯(Theodor Curtius)发现,反应中酰基叠氮重排生成异氰酸酯。
[1][2]关于此反应的综述参见:[3][4]。
产物可与一系列亲核试剂反应:与水作用水解得到胺;[5]与苯甲醇反应生成带有苄氧羰基保护基(Cbz)的胺类;[6]与叔丁醇作用生成带有叔丁氧羰基保护基(Boc)的胺类,用作有机合成中的重要中间体。
[7][8]羧酸1可通过与叠氮磷酸二苯酯2反应被转化为酰基叠氮3。
[9][10][11][12]目录[隐藏]∙ 1 反应机理∙ 2 延伸∙ 3 参考资料∙ 4 参见反应机理[编辑]反应中,酰基叠氮失去氮气生成酰基乃春(氮烯)2,然后烃基迅速迁移,生成产物异氰酸酯3:延伸[编辑]在Curtius重排反应的基础上,Darapasky递降反应(A. Darapsky, 1936)以α-氰基酯为原料,通过重排反应生成氨基酸。
[13]参考资料[编辑]1. ^ Curtius, T. Ber.1890, 23, 3023.2. ^ Curtius, T. J. Prakt. Chem.1894, 50, 275.3. ^ Smith, P. A. S. Org. React.1946, 3, 337-449. (Review)4. ^ Scriven, E. F.; Turnbull, K.; Chem. Rev.1988, 88, 297-368. Review5. ^ Kaiser, C.; Weinstock, J. Organic Syntheses, Coll. Vol. 6, p.910 (1988); Vol. 51,p.48 (1971).Article6. ^ Ende, D. J. a.; DeVries, K. M.; Clifford, P. J.; Brenek, S. J. Org. Proc. Res.Dev.1998, 2, 382-392.7. ^ Lebel, H.; Leogane, O.; Org. Lett.2005, 7(19),4107-4110. doi:10.1021/ol051428b8. ^ Shioiri, T.; Yamada, S. Organic Syntheses, Coll. Vol. 7, p.206 (1990); Vol. 62,p.187 (1984).Article9. ^ Shioiri, T.; Ninomiya, K.; Yamada, S. J. Am. Chem. Soc.1972, 94,6203-6205.doi:10.1021/ja00772a05210. ^ Ninomiya, K.; Shioiri, T.; Yamada, S. Tetrahedron1974, 30, 2151-2157.11. ^ Wolff, O.; Waldvogel, S. R. Synthesis2004, 1303-1305.12. ^ Jessup, P. J.; Petty, C. B.; Roos, J.; Overman, L. E. Organic Syntheses, Coll.Vol. 6, p.95 (1988); Vol. 59, p.1 (1979). Article13. ^/reactions/RXN051.htm(重定向自贝克曼重排)贝克曼重排反应(Beckmann rearrangement)是一个由酸催化的重排反应,反应物肟在酸的催化作用下重排为酰胺。
若起始物为环肟,产物则为内酰胺。
此反应是由德国化学家恩斯特·奥托·贝克曼发现并由此得名[1][2][3]。
试例反应[4]的反应物为环己酮并生成己内酰胺。
因为己内酰胺是制造尼龙6的重要原料,所以此反应也是贝克曼重排的一个很重要的应用。
贝克曼溶剂被广泛用来催化重排反应,其实际成分为乙酸,盐酸和乙酸酐。
也可以其他种类的酸催化,例如硫酸和多磷酸。
在实际工业制造酰胺的流程中,通常使用的是硫酸,因为用氨进行中和处理后可以得到硫酸铵,后者是一种重要的化肥,能为土壤提供氮和硫。
目录[隐藏]∙ 1 反应机理∙ 2 氰尿酰氯辅助贝克曼反应∙ 3 异常贝克曼重排反应∙ 4 参见∙ 5 外部链接∙ 6 参考文献根据推测,贝克曼重排的反应机理首先是烷基的迁移并推走羟基形成腈基基团,接下来该中间体被水解,形成产物酰胺。
反应式如下:在一个研究中[5],研究者使用电脑模拟丙酮肟在贝克曼溶剂中的重排反应,并考虑到了溶剂分子和取代物的影响。
模拟表明,有三个乙酸分子和一个质子(以氧鎓的形式存在)参与了反应。
形成亚胺中间体后(σ配合物),甲基通过协同反应迁徙到氮上,并推走羟基。
羟基中氧原子受到三个乙酸分子的稳定。
接下来,一分子水进攻亲电的碳原子,其中一个氢原子被一个乙酸接收,生成的中间体为N-甲基乙酰氨酸,其中氧原子为四配位。
最后异构化形成稳定的产物酰胺。
当计算对象是一个水合氢离子和六分子水的时候,结果相同。
但是当移动基团为苯基的时候,例如在苯乙酮肟的重排反应中,反应更倾向于生成三元π-配合物。
此配合物在对H3O+(H2O)6的研究中没有发现。
在环己酮肟的例子中,因为要释放环张力,所以有了第三种反应机理。
它是通过一步协同反应步骤直接生成质子化的己内酰胺,而没有π-配合物或σ-配合物中间体。
氰尿酰氯和氯化锌形成助催化剂可以催化贝克曼反应。
例如:环十二酮能被平稳地转化为对定的内酰胺,后者是生产尼龙12的单体。
[6]此反应的反应机理是以循环型催化为基础的,在循环中,氰尿酰氯通过亲核芳香取代活化羟基。
通过Meisenheimer络合物中间体,最终生成产物。
α-二酮、α-酮酸、α-叔烃基酮(反式)、α-二烷基氨基酮、α-羟基酮和β-酮醚生成的肟在路易斯酸或质子酸的作用下断裂为腈及相应的官能团化合物。
这个反应称为“异常贝克曼重排”,又称非正常贝克曼重排;二级贝克曼重排;贝克曼断裂反应等。
例如,如下α-叔烃基酮肟生成腈鎓离子后,叔碳-碳键断裂,一部分生成腈,另一部分转变为碳正离子,碳正离子被二乙氨基三氟化硫(DAST)捕获,生成相应的氟代烃。
[7]∙Curtius重排∙Dakin反应∙Schmidt反应∙Stieglitz重排反应∙反应机理: gif动画1. ^ E. Beckmann. Zur Kenntniss der Isonitrosoverbindungen. Ber. 1886, 19:988–993.doi:10.1002/cber.188601901222.2. ^ L. G. Donaruma, W. Z. Heldt. The Beckmann rearrangement.. Org. React. 1960, 11:1–156.(综述)3. ^ R. E. Gawley. The Beckmann reactions: rearrangement, elimination-additions,fragmentations, and rearrangement-cyclizations.. Org. React. 1988, 35: 14–24.(综述)4. ^ J. C. Eck, C. S. Marvel. ε-BENZOYLAMINOCAPROIC ACID. Organic Syntheses,Coll. 1943, 2: 76.5. ^ S. Yamabe, N. Tsuchida, S. Yamazaki. Is the Beckmann Rearrangement aConcerted or Stepwise Reaction? A Computational Study. J. Org. Chem. 2005, 70:10638 – 10644. doi:10.1021/jo0508346.6. ^ Y. Furuya, K. Ishihara, H. Yamamoto. [Cyanuric Chloride as a Mild and ActiveBeckmann Rearrangement Catalyst. J. Am. Chem. Soc. 2005, 127: 11240–11241. doi:10.1021/ja053441x S0002-7863(05)03441-4请检查|doi=值(帮助).7. ^ Kirihara, Masayuki; Niimi, Kanako; Momose, Takefumi. Fluorinative -cleavage ofcyclic ketoximes with diethylaminosulfur trifluoride: an efficient synthesis of fluorinated carbonitriles. Chemical Communications. 1997, 6: 599–达金反应(Dakin反应)是酚醛或酚酮与过氧化氢在氢氧化钠作用下反应生成二酚与羧酸的反应。
[1][2][3]由亨利·达金于1909年首先发现。
以水杨醛为例,它与过氧化氢在碱液中反应,生成的产物是邻苯二酚:反应机理[编辑]反应与BV氧化重排反应类似,但过氧试剂不是过氧酸,而是过氧化氢。
它的一个可能的机理如下。
对醛进行加成,然后苯基迁移,重排,甲酸酯水解,酸化生成二酚。
施密特反应(Schmidt反应)是一个有机重排反应,原料在叠氮酸作用下,放出氮气,发生烷基迁移生成新的C-N键。
[1]以羧酸作原料时,经由异氰酸酯中间体,产物为少一个碳的胺:以酮作原料时,产物为相同碳数的酰胺:醛也可发生反应,反应后得到同碳数的腈,不放出二氧化碳。
反应由卡尔·弗里德里希·施密特(1887-1971)在1924年发现,[2]一般采用质子酸(如硫酸、多聚磷酸、三氯乙酸)或路易斯酸催化,用于合成新的有机化合物,如2-奎宁环酮。
如果原料在酸中稳定,则这个反应产率很高,高于同类型的霍夫曼重排反应、Lossen重排反应及Curtius重排反应。
使用的羧酸可以是一元或二元直链脂肪羧酸、脂环族羧酸或芳香族羧酸。
叠氮酸及酰基叠氮均是易爆且有毒的化合物,使用时需注意安全。
目录∙ 1 反应机理∙ 2 烷基叠氮化物作原料∙ 3 参考资料∙ 4 外部链接∙ 5 参见反应机理[编辑]以羧酸作原料时,首先羟基质子化,水离去,生成酰基阳离子1。
1与叠氮酸加成,生成质子化的酰基叠氮2。
2发生重排,烷基R迁移至C-N键另一端,氮气离去。