溶液的质量分数计算
- 格式:doc
- 大小:79.00 KB
- 文档页数:10

有关溶液中溶质质量分数的计算姓名一、计算类型:1、关于溶质质量分数概念的计算。
2、溶液质量、体积、溶质质量间的换算。
3、溶液稀释(或浓缩)、混合的计算.4、化学方程式与溶质质量分数的综合计算.二、主要内容:1、理解溶质质量分数的数学表达式:溶质质量溶质质量溶质质量分数=== —--——×100 %=== —————————×100%溶液质量溶质质量+溶剂质量溶质质量=== -———-—---—×100%溶液体积×溶液密度溶液稀释或浓缩:溶液中溶质质量保持不变。
(稀释: 用水稀释; 浓缩:蒸发溶剂)⑴、M浓× P浓% ======== M稀× P稀%⑵、V浓þ浓P浓% ======== V稀þ稀P稀%其中: M-溶液质量 V—溶液体积þ—溶液密度P%—-溶液中溶质质量分数⑶、稀释时加水或浓缩时蒸去水的质量(ΔM水)为稀溶液与浓溶液的质量之差。
即:ΔM水 === M稀— M浓2、同种溶质、不同质量分数的溶液混合时,量间的关系为:M浓× P浓% + M稀× P稀% ==== ( M浓 + M稀)×P混%4、化学反应后生成物溶液中溶质质量分数的计算.反应后生成物溶液中溶质质量溶质质量分数=== —-————————————×100%生成物溶液质量反应后生成物溶液中溶质质量=== —-—-——-————————--————--——×100%反应前各物质质量总和- 生成气体质量- 生成沉淀质量所得溶液的质量=反应前溶液的质量+反应掉的固体或气体质量- 生成气体或生成沉淀质量第一类型:练习、①、有食盐溶液100克,其中水96克,求食盐溶液中食盐的质量分数?②、 200克氯化钠溶液中含氯化钠10克,求溶液中氯化钠的质量分数?③计算在80克质量分数为15%的NaNO3溶液里含有NaNO3多少克。

溶液浓度溶液的质量浓度计算方法浓度是溶液中溶质的含量相对于溶剂的数量的度量,用来描述溶液的稀释或浓缩程度。
其中,质量浓度是最常用的一种浓度表示方法,它表示单位体积溶液中溶质的质量。
本文将介绍两种计算质量浓度的方法:质量分数和质量体积比。
一、质量分数的计算方法质量分数表示单位溶液中溶质所占质量的比例。
计算公式如下:质量分数 = (溶质质量 / 溶液质量) × 100%例如,某溶液中含有100g的溶质A,溶液的总质量为500g,那么溶质A的质量分数可以通过以下计算得出:质量分数 = (100g / 500g) × 100% = 20%二、质量体积比的计算方法质量体积比表示单位溶液中溶质的质量与溶剂的体积之比。
计算公式如下:质量体积比 = (溶质质量 / 溶剂体积)例如,某溶液中含有80g的溶质B,溶剂的体积为100mL,那么溶质B的质量体积比可以通过以下计算得出:质量体积比 = (80g / 100mL) = 0.8 g/mL需要注意的是,质量体积比的单位通常是g/mL或g/L,具体选择取决于溶剂的体积单位。
通过质量分数和质量体积比的计算方法,我们可以准确地描述溶液中溶质的含量,从而更好地了解溶液的浓度情况。
在实际实验或工业生产过程中,掌握这些计算方法对于浓度的调控和计量非常重要。
例如,在医药领域中,药物的浓度常常需要被严格控制,以确保治疗效果和安全性。
医生或化学工程师们可以使用质量分数或质量体积比的计算方法来评估药物的浓度,并根据需要进行调整。
这不仅可以确保药物的疗效,还可以避免潜在的毒副作用。
总结起来,质量分数和质量体积比是计算溶液浓度的两种常用方法。
通过这些方法,我们能够精确地描述溶液中溶质的含量,并且能够在实验或者工业生产中更好地控制和调节溶液的浓度。
这些计算方法对于化学、生物、医药等领域都具有重要的实际应用价值。
在进行浓度计算时,我们应该根据实际情况选择合适的计算方法,以保证结果的准确性和可靠性。

溶液中溶质质量分数的综合计算一、知识回顾:溶液中溶质质量分数的计算公式:溶质质量分数= × 100%二、反应后溶液质量分数的核心例题例1:取碳酸钠样品11g(含少量氯化钠)于试管中,向溶液中加入114.4g稀盐酸,固体全部溶解。
已知生成二氧化碳4.4g,求反应后溶液的质量分数?例2:将一定质量的碳酸钠粉末溶于400g水中配制成溶液,取1/4该溶液,向其中加入20%的氯化钙溶液至不再产生沉淀(反应方程式为CaCl2 + Na2CO3 ==CaCO3↓+ 2NaCl),得到白色沉淀20g,试计算碳酸钠粉末的总质量及恰好完全反应时所得溶液中溶质的质量分数。
(最后结果保留一位小数)三、认识表格请找出以下题目中,表格中的递变规律和突变点,及标明反应物过量例3、某化工厂生产的纯碱产品(含有少量氯化钠)的包装袋上注明:碳酸钠≥96%。
为了测定该产品中碳酸钠的质量分数是否属实,向4个分别盛有浓度相同、质量均为100 g稀盐酸的烧杯中,分别放入不同质量的纯碱产品,充分反应后,称量烧杯中剩余物的质量,实验数据如下表:例4、现有Cu与另一种金属(可能是Mg、Fe、Zn中的一种)形成的粉末。
现欲测定其组成,进行如下实验:取该粉末16g放入烧杯,将溶质质量分数为14%的稀硫酸280.0g分4次加入该烧杯中,充分反应后,测得剩余的固体质量数据记录如下:四、挑战中考题(2012中考)炼钢厂用含SO2的废气制备CuSO4。
生产中,向混有CuO粉末的CuSO4溶液中通入废气,反应为:2CuO+2SO2+O2====2CuSO4。
欲制得溶质的质量分数为20%的CuSO4溶液。
用足量CuO粉末和5000g 5%的CuSO4溶液处理废气。
若每升废气中含有1.25 g SO2,且SO2被完全吸收,可处理废气多少升?所称量的物质实验1 实验2 实验3 实验4加入纯碱产品质量/g 2.8 5.6 11.2 14烧杯中剩余物质量/g 101.7 103.4 106.8 109.6次数 1 2 3 4加入稀硫酸质量/g 70.0 70.0 70.0 70.0剩余固体质量/g 13.6 11.2 8.8 8.4溶液中溶质质量分数计算的一般方法:1、找到,利用()2、利用基本公式,求解反应后溶液中溶质质量分数溶质:溶液:加入()跑出()3、图像、表格。

溶液中溶质质量分数的计算溶液是由溶剂和溶质组成的混合物,其中溶质是溶解在溶剂中的物质。
溶液中溶质的质量分数是指溶质在溶液中所占的质量与溶液总质量的比值,通常以百分数表示。
溶液中的溶质质量分数计算方法十分简单,只需将溶质的质量与溶液总质量相除,再乘以100即可。
数学表达式为:溶质质量分数 = (溶质质量 / 溶液总质量) × 100例如,如果将5克的盐溶解在100克的水中,那么溶液的总质量就是5克盐 + 100克水 = 105克。
然后,将溶质的质量(5克)除以溶液总质量(105克),再乘以100,得到质量分数为:溶质质量分数 = (5克 / 105克) × 100 ≈ 4.76%这表示盐在该溶液中的质量占比约为4.76%。
溶质质量分数的计算对于许多实际应用非常重要。
比如,在化学实验室中,溶液的质量分数经常用于确定溶液的浓度。
在工业生产中,了解溶液中溶质的质量分数可以帮助工程师调整生产工艺,确保产品的质量稳定性。
对于普通人来说,了解溶质质量分数也有着实际的指导意义。
例如,在家里制作食品和饮料时,控制溶液中某种成分的质量分数可以调整味道或改善口感。
此外,了解溶液中溶质的质量分数也有助于我们理解溶液的性质和反应规律。
需要注意的是,溶质质量分数只能用于溶质与溶剂之间是可溶的情况。
对于不溶于溶剂的溶质来说,质量分数始终为0,因为溶液中没有溶质的质量存在。
总之,溶液中溶质质量分数的计算相对简单,但在实际应用中有着重要的作用。
了解溶质质量分数不仅能够帮助我们控制溶液的浓度和性质,还能指导我们在日常生活中做出更好的选择。


溶液的质量分数计算公式洋葱数学
定义一:
质量分数(mass fraction)是指溶质质量与溶液质量的百分比(溶质B的质量占溶液质量的分数)或。
用符号ω表示。
计算公式为:
上式中ω(B)的量纲为1,也可用百分数表示。
定义二:
质量分数也可以指化合物中各原子相对原子质量(需乘系数)与总式量的比值,即某元素在某物质中所占比例。
例如物质Fe2O3(氧化铁),则Fe的质量分数为:56*2/160*100%=70%元素的质量分数用途广泛,其中在食品包装上的“营养成分”标示等都要用到元素的质量分数。
扩展资料:
质量分数与物质的量浓度之间的关系:
C*M=1000*ρ*ω即物质的量浓度乘以摩尔质量等于1000乘以密度乘以质量分数。
c= (V·ρ·ω/M)/V= V·ρ·ω/MV=1000ρ·ω/M
ω=cM/1000ρ
注意事项
1、溶质的质量分数只表示溶质质量与溶液质量之比,并不代表具体的溶液质量和溶质质量。
2、溶质的质量分数计算式中溶质质量与溶液质量的单位必须统一。
3、若溶质全部溶于水,且不与水发生化学反应,直接利用计算公式进行计算。
计算式中溶质质量是指被溶解的那部分溶质的质量,没有被溶解的那部分溶质质量不能计算在内。
4、若溶质为结晶水合物,溶于水后,其溶质的质量就不包括结晶水的质量。
因为结晶水合物溶于水时,结晶水就转化为溶液中的溶剂,且水的质量有增加。
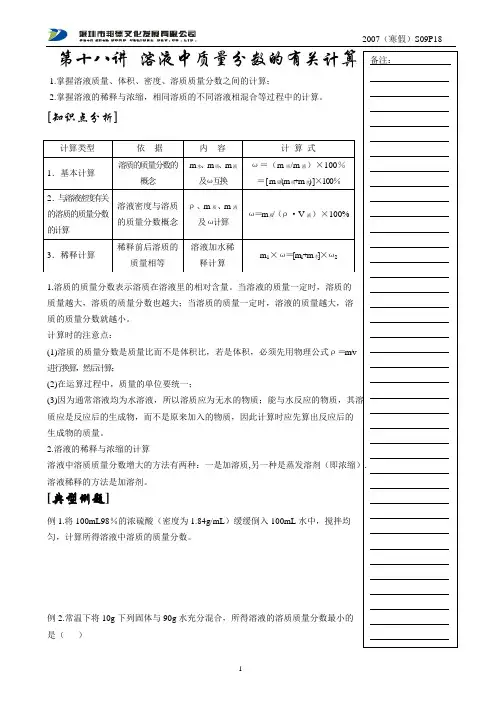
第十八讲 溶液中质量分数的有关计算1.掌握溶液质量、体积、密度、溶质质量分数之间的计算;2.掌握溶液的稀释与浓缩,相同溶质的不同溶液相混合等过程中的计算。
[知识点分析]1.溶质的质量分数表示溶质在溶液里的相对含量。
当溶液的质量一定时,溶质的质量越大,溶质的质量分数也越大;当溶质的质量一定时,溶液的质量越大,溶 质的质量分数就越小。
计算时的注意点:(1)溶质的质量分数是质量比而不是体积比,若是体积,必须先用物理公式ρ=m/v 进行换算,然后计算;(2)在运算过程中,质量的单位要统一;(3)质应是反应后的生成物,而不是原来加入的物质,因此计算时应先算出反应后的 生成物的质量。
2.溶液的稀释与浓缩的计算溶液中溶质质量分数增大的方法有两种:一是加溶质,溶液稀释的方法是加溶剂。
[典型例题]例1.将100mL98%的浓硫酸(密度为1.84g/mL )缓缓倒入100mL 水中,搅拌均 匀,计算所得溶液中溶质的质量分数。
例2.常温下将10g 下列固体与90g 水充分混合,所得溶液的溶质质量分数最小的 是( ) A.胆矾B.氧化钙C.氧化钠D.硝酸钾例3.一定量溶质质量分数为8%的食盐水蒸发掉50g 则原溶液中溶质的质量为例4. 在农业科研上,有时用10%~20%的氯化钠溶液来选种。
现需要30kg16%的氯 化钠溶液。
(1)若用氯化钠固体和水配制上述溶液,需要氯化钠的质量是 kg 水的质量是 kg (2)若用25%的氯化钠溶液和水配制上述溶液,需要 25%的氯化钠溶液的质量是 kg例5. 医疗上常用的生理盐水是质量分数为0.9%(密度约为13g cm /)的氯化钠 溶液。
500mL 的这种生理盐水中含氯化钠_______g ,水_________g 。
若以每分钟 50滴(20滴约为1mL )的速率给病人静脉输液500mL ,约需______分钟输完. 例6. 日常生活中我们要科学地节约用水。
现有一件刚用洗涤剂洗过的衣服, “拧干”后湿衣服上残留的溶液为100g ,其中含洗涤剂的质量分数为1%,则湿衣服上残留的洗涤剂的质量为____________g 。

有关溶液中溶质质量分数的计算一、知识要点1. 溶质的质量分数定义:溶质的质量分数是溶质的质量与溶液的质量之比。
2. 常用计算公式(1)溶质质量分数=溶质质量/溶液质量×100%。
注意:由多种溶质组成的混合溶液中溶质质量分数的计算。
(2)溶液质量与体积之间的换算。
溶液质量(克)=溶液体积(毫升)×溶液密度(克/毫升)。
(3)溶液的稀释:m浓溶液×a%=m浓溶液×b%(a>b)。
其中:m浓溶液=m浓溶液+m水。
若用溶质质量分数不同(a%、b%)的溶液A、B,配制中间溶质质量分数的溶液(c%),则:mA×a%+mB×b%=(mA +mB)×c%。
(4)不同溶液进行反应,涉及反应前后某溶液中溶质质量分数的计算:根据化学方程式进行有关溶液参加反应的计算,参加反应的及反应后生成的都指的是溶液中的溶质,所以必须以溶质的质量列比例式。
二、方法引导1. 明确关系用水稀释浓溶液或同种溶质的溶液混合后,溶质的总质量不变。
2. 掌握公式溶质质量分数=溶质质量/溶液质量×100%。
3. 领会关键判断溶液是否饱和或者判断在发生变化的过程中,溶质和溶剂质量的变化。
4. 切记要点(1)结晶水合物溶解时,准确判断溶质和溶剂的质量,所得溶液中的溶质是结晶水合物中的无水物。
(2)配制溶液时,所加的物质能与水发生化学反应,那么首先应根据化学反应方程式判断溶质(即生成物)和溶质的质量,然后求出溶质的质量分数。
(3)在有关溶质的质量分数与化学方程式的综合计算和溶液总质量的计算过程中,若反应中有沉淀或气体生成,在计算溶液的质量时,应减去生成沉淀或气体的质量。
三、例题解析例1有100g10%的食盐溶液,欲将其质量分数增大到15%,需蒸发掉多少克水或加入多少克食盐。
解析:该题是有关将一定溶质质量分数的溶液通过蒸发溶剂或增加溶质方法使其溶质的质量分数增大。
解:(1)需蒸发掉x克水100×10%=(100- x)×15%得:x=33.3克。

溶液浓度质量分数与摩尔浓度的计算溶液浓度是指溶液中溶质的含量,常用的浓度表示方式包括质量分数和摩尔浓度。
质量分数表示溶质在溶液中的质量与溶液总质量之比,摩尔浓度则表示溶质的摩尔数与溶液体积的比值。
本文将介绍如何计算溶液的浓度,以及两种浓度表示方式的关系。
一、质量分数的计算质量分数是常见的表示溶液浓度的方式之一,为了计算质量分数,我们需要知道溶质的质量和溶液的总质量。
质量分数 = 溶质质量 / 溶液总质量例如,如果有一个溶液中含有20g的盐溶解在100g的水中,我们可以计算质量分数如下:质量分数 = 20g / (20g + 100g) = 0.167所以,这个溶液的质量分数为0.167。
二、摩尔浓度的计算摩尔浓度是以溶质的摩尔数与溶液的体积之比来表示的浓度。
为了计算摩尔浓度,我们需要知道溶质的摩尔数和溶液的体积。
摩尔浓度 = 溶质的摩尔数 / 溶液的体积(升)例如,假设我们有100 mL的溶液中含有0.5 mol的盐,我们可以计算摩尔浓度如下:摩尔浓度 = 0.5 mol / 0.1 L = 5 mol/L所以,这个溶液的摩尔浓度为5 mol/L。
三、质量分数与摩尔浓度之间的转换在某些情况下,我们可能需要将质量分数转换为摩尔浓度,或将摩尔浓度转换为质量分数。
为了进行转换,我们需要知道溶质的摩尔质量。
将质量分数转换为摩尔浓度,可以按照以下公式进行计算:摩尔浓度 = (质量分数 / 溶质的摩尔质量) × (溶液的体积 / 溶液的密度)将摩尔浓度转换为质量分数,可以按照以下公式进行计算:质量分数 = (摩尔浓度 ×溶质的摩尔质量) / (溶液的体积 ×溶液的密度)四、实例分析为了更好地理解质量分数和摩尔浓度的计算方法,我们来看一个实例。
假设我们有500 mL的溶液,其中含有20 g的氯化钠(NaCl)。
首先,我们可以计算氯化钠的质量分数:质量分数 = 20g / (20g + 500g) = 0.038接下来,假设我们知道氯化钠的摩尔质量为58.44 g/mol,并且希望将质量分数转换为摩尔浓度。

化学反应后生成..
溶液中溶质质量分数的计算 一、弄清反应后究竟是什么溶液;找出溶质是什么物质。
二、先求溶质质量:一般根据化学方程式计算。
三、怎样求反应后溶液的质量呢?
方法一:溶液质量=====溶质质量+溶剂质量(水)
若反应生成了水,则反应后溶液中水的质量=====原溶液中的水+生成的水 方法二、用质量守恒定律来求(适用最广) 即:参加反应的各物质质量总和(包含溶液中的水)
====生成的溶液质量(包含生成的水)+生成的气体质量+生成的固体质量 所以:
m 生成溶液==== m 反应前参加的总和 — m 生成的气体和固体
例1、:锌和稀硫酸反应时,
生成溶液的溶质量分数===
硫酸锌的质量要通过化学方程式计算,而硫酸锌溶液的质量有两种求法:
(1)、
m ZnSO4溶液====m ZnSO4 + m 水 (注:m 水==原稀硫酸中的水)
(2)m ZnSO4溶液===m 反应掉的Zn + m 反应的稀.硫酸溶液的总质量...... —m 生成的氢气 例2:大理石与稀盐酸的反应(完全反应)
生成的应是CaCl 2溶液:
所得CaCl 2溶液中溶质质量分数为:
CaCl 2的质量根据化学方程式可算出。
而CaCl 2溶液的算法有两种:
(1)、
m CaCl
2溶液==m CaCl 2 + m 水 (m 水==原稀盐酸中的水+生成的水) (2)m CaCl 2溶液 == m CaCO 3+ m 稀.盐酸(溶液总的质量.......) —m 生成的CO2 (注意:大理石是混合物,杂质不参加反应,也不溶于水,因此,用质量守恒求生成溶液时, 要把杂质减出去,只能用实际应掉的CaCO 3的质量来计算。
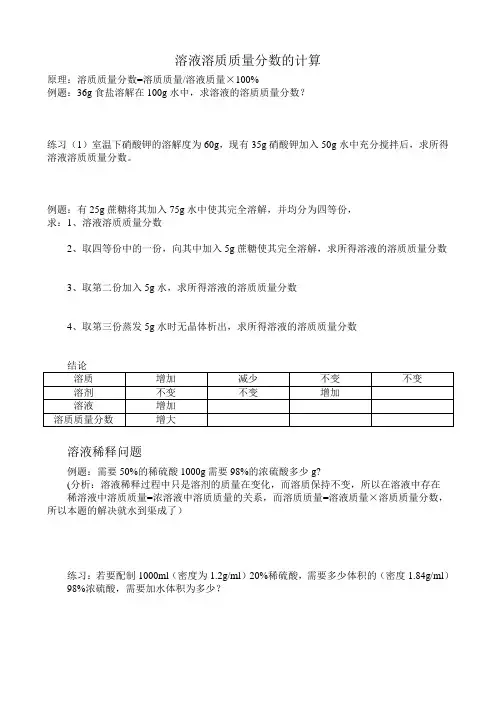
溶液溶质质量分数的计算
原理:溶质质量分数=溶质质量/溶液质量×100%
例题:36g食盐溶解在100g水中,求溶液的溶质质量分数?
练习(1)室温下硝酸钾的溶解度为60g,现有35g硝酸钾加入50g水中充分搅拌后,求所得溶液溶质质量分数。
例题:有25g蔗糖将其加入75g水中使其完全溶解,并均分为四等份,
求:1、溶液溶质质量分数
2、取四等份中的一份,向其中加入5g蔗糖使其完全溶解,求所得溶液的溶质质量分数
3、取第二份加入5g水,求所得溶液的溶质质量分数
4、取第三份蒸发5g水时无晶体析出,求所得溶液的溶质质量分数
溶液稀释问题
例题:需要50%的稀硫酸1000g需要98%的浓硫酸多少g?
(分析:溶液稀释过程中只是溶剂的质量在变化,而溶质保持不变,所以在溶液中存在稀溶液中溶质质量=浓溶液中溶质质量的关系,而溶质质量=溶液质量×溶质质量分数,所以本题的解决就水到渠成了)
练习:若要配制1000ml(密度为1.2g/ml)20%稀硫酸,需要多少体积的(密度1.84g/ml)98%浓硫酸,需要加水体积为多少?
练习:(1)有108克(不纯,且杂志不溶于水)碳酸钠,现与200克未知质量分数的稀盐酸完全反应,反应后称得剩余物质质量为264g.。
求:1、生成二氧化碳质量
2、碳酸钠纯度
3、稀盐酸质量分数
4、最终所得溶液质量分数
(2) 将一块铁片加入200g硫酸铜溶液中,至硫酸铜完全反应后取出铁片,称得铁片质量增加0.8g
求:1、硫酸铜溶液的溶质质量分数
2、反应后所得溶液溶质质量分数。
中考化学质量分数溶液质量分数初三化学溶液质量分数知识点1. 溶液的质量分数公式溶液质量分数=m溶质/m溶液说明:m溶液=m溶质+m溶剂2. 溶液的质量分数计算①若溶质全部溶于水,且不与水发生化学反应,直接利用上述计算公式进行计算。
②若溶质虽不与水反应,但没有全部溶解,则溶质质量只计算溶解部分,未溶解部分不能参与计算。
③若溶质溶于水时与水发生了化学反应,则溶液中的溶质就为反应后的生成物了。
④若溶质为结晶水合物,溶于水后,其溶质的质量就不包括结晶水的质量。
因为结晶水合物溶于水时,结晶水就转化为溶液中的溶剂了。
⑤关于酸、碱、盐溶液间发生1~2个化学反应,求反应后所得溶液——溶质质量分数问题的计算。
首先要明确生成的溶液中溶质是什么,其次再通过化学反应计算溶质质量是多少,(往往溶质质量由几个部分组成)最后分析各量间关系求出溶液总质量,再运用公式计算出反应后溶液中溶质的质量分数。
⑥给定溶液中某种元素的质量分数或溶液中某种离子与水分子的个数比等形式,计算溶质的质量分数。
如某NaCl溶液中,Na+︰H2O(数目)=1︰100,计算NaCl的质量分数。
[方法探讨]对于反应后所得溶液的质量有两种求法:a、溶液组成法溶液质量=溶质质量+溶剂质量,其中溶质一定是溶解的,溶剂水根据不同的题目通常有两种情况:①原溶液中的水,②化学反应新生成的水。
b、质量守恒法溶液质量=m(反应)-m↓-m↑,此法较为简单,其m(反应)代表反应物(或溶液)质量总和,m↓表示不溶固体及生成沉淀的质量,m↑表示生成气体的质量。
⑴质量分数(w) 溶质的质量与溶液的质量之比称为溶质的质量分数。
w=m溶质÷m溶液(×100%)8、质量分数与物质的量浓度之间的关系它们都是用来表示物质(溶质)在溶剂中的浓度大小 ;区别:"物质的量浓度"是指物质的量与体积的比值,单位为mol/L;"溶质质量分数"是指溶质溶解在溶剂中溶质质量与溶液质量的比值,为百分数. 转化公式:C*M=1000*ρ*ω 即量浓度乘以摩尔质量等于1000乘以密度乘以质量分数。
物质的量浓度与质量分数之间的转化关系
•(1)基本公式:
•,c为溶质的物质的量的浓度,单位mol·L-1,ρ为溶液密度,单位为g·cm-3,ω为溶质的质量分数,M为溶质的摩尔质量,单位g·mol-1。
•(2)公式的推导(按溶液体积为V升推导)
•或
•溶质的质量分数:
溶质的质量分数又叫溶液的质量百分比浓度。
一般来说,(对大多数溶液)物质的量浓度越大,溶液的密度越大,质量百分比浓度也越大。
但是,对于氨水、酒精溶液,物质的量浓度越大,密度越小。
溶液的混合定律:
溶质相同、质量分数分别为a%、b%的两溶液混合:
⑴等体积混合
o当溶液的密度大于1mol/mL时,必然是溶液浓度越大,密度越大,(如硫酸、硝酸、盐酸、氢氧化钠等多数溶液)等体积混合后,质量分数
;
o当溶液的密度小于1mol/mL时,必然是溶液浓度越大,密度越小,(如酒精、氨水溶液)等体积混合后,质量分数。
⑵等质量混合
两溶液等质量混合时,(无论ρ>1g/mL还是ρ<1g/mL),则混合后溶液中溶质的质量分数
•溶质的质量分数:
溶液质量分数=×100% 用溶解度表示:
•有关溶液的计算:
溶质的质量分数=•。
化学中的质量分数一、质量分数的定义在化学中,质量分数是指溶液中溶质的质量与溶液总质量之比。
通常以百分数表示,即质量分数=溶质质量/溶液总质量×100%。
二、质量分数的计算方法1. 已知溶质质量和溶液总质量的情况下,利用质量分数的定义可以直接计算质量分数。
例如,某溶液中含有20克的盐溶解在100克的水中,那么盐的质量分数为20克/120克×100%=16.67%。
2. 已知溶液中溶质的摩尔质量和溶质的摩尔数的情况下,可以通过计算溶质的质量,再利用质量分数的定义计算质量分数。
三、质量分数的应用1. 制备溶液:在实验室中,常常需要制备某个质量分数的溶液。
通过控制溶质的质量和溶液总质量,可以得到所需的质量分数。
2. 分离纯度评价:对于某些化合物混合物,可以通过测定其中某个组分的质量分数来评价其纯度。
质量分数越高,说明纯度越高。
3. 质量守恒定律:在化学反应中,质量分数可以用来计算反应物和产物的质量变化。
根据质量守恒定律,反应物的质量分数与产物的质量分数之和应该等于1。
4. 溶解度计算:溶解度是指在一定温度下,单位体积溶剂中最多可以溶解的溶质的质量。
可以通过计算溶质的质量分数来评价其溶解度。
四、质量分数的注意事项1. 质量分数是一个相对指标,需要与其他相关的物质进行比较才能得到更有意义的结果。
2. 质量分数的计算需要准确的质量数据,因此实验中需要进行仔细的称量和计算。
3. 在实际应用中,还需要考虑溶液的体积变化和温度变化对质量分数的影响。
4. 质量分数只是描述溶液中溶质的相对含量,不同溶液中溶质的质量分数不能直接进行比较,需要进行相应的转换。
五、总结质量分数是化学中重要的概念之一,用于描述溶液中溶质的含量。
通过质量分数的计算,可以帮助我们制备所需的溶液、评价化合物的纯度、计算反应物和产物的质量变化以及评价溶解度等。
在实际应用中,需要注意质量分数的相对性、准确性以及其他因素对质量分数的影响。
.. .. . . . . 个性化教学辅导教案 学科: 化 学 任课教师: 授课时间: 2014 年级 初三 性别 教学课题 溶质的质量分数
教学 目标
知识点:溶质的质量分数
考点: 溶质的质量分数的计算 方法: 讲练法 重点 难点 溶质的质量分数计算的灵活运用
课前检查 作业完成情况:优□ 良□ 中□ 差□ 建议__________________________________________
课 堂 教 学 过 程
过 程
知识要点 1、溶质的质量分数:溶质质量与溶液质量之比。公式:
溶质质量分数= × 100%
饱和溶液中溶质的质量分数计算公式: 溶质质量分数=s/s+100
2、配制一定溶质质量分数的溶液 (1)用固体配制: ① 步骤:计算、称量、溶解 ② 仪器:天平、药匙、量筒、滴管、烧杯、玻璃棒 注意: 留意以上各仪器实验中的用途,并且注意天枰、量筒、滴管的使用规则。特别注意这里有玻璃棒,很多物质在加入水后会产生大量的热量,所以用玻璃棒不断搅拌散热。在过滤实验中玻璃棒起到引流的作用。
(2)用浓溶液稀释(稀释前后,溶质的质量不变) ①步骤:计算、量取、稀释 ②仪器:量筒、滴管、烧杯、玻璃棒 注意:浓硫酸的稀释实验是常考点,因为浓硫酸遇到水会产生大量的热容易烧伤皮肤,所以特别要注意稀释顺序。
溶质的质量 溶液的质量 .. ..
. . . . 攻克溶质质量分数计算题的有效方法 核心提示:溶质质量分数的计算在初中化学计算中占有重要地位,虽然溶质质量分数计算题的题型众多,但只要熟练掌握以下解题方法,并找准溶液中溶质和溶液的质量,就可轻而易举的攻克溶质质量分数计算题。
一.溶质守恒法在溶质质量分数计算题中的应用 在溶质质量分数计算中常用的守恒法是根据溶质的质量守恒,守恒法不仅适用于溶液的稀释,还可用于溶液的浓缩、结晶、混合、配制等。
1. 求溶液的稀释 例题:配制溶质质量分数40%的稀硫酸溶液(密度为1.3克/厘米3)100毫升,需溶质质量分数98%的浓硫酸(密度为1.84克/厘米3)多少毫升?水多少毫升?
分析:利用溶液稀释时溶质质量守恒进行计算:设浓硫酸的体积为V毫升。 解:V × 1.84克/厘米3 × 98% = 100毫升 × 1.3克/厘米3 × 40% V = 28.8毫升 稀溶液体积 ≠ 浓溶液体积 + 水的体积 稀溶液质量 = 浓溶液质量 + 水的质量 水的质量 = 稀溶液质量 - 浓溶液质量 = 100毫升 × 1.3克/厘米3 - 28.8毫升 × 1.84克/厘米3 = 77克 水的体积 = 77克 ÷ 1克/毫升 = 77毫升 答案:需溶质质量分数98%的浓硫酸(密度为1.84克/厘米3)28.8毫升,水77毫升。 2. 求溶液的浓缩 例题:要使含水99%的NaCl溶液a克,变为含水量降为98%,应蒸发掉_________克水。 分析:含水99%可转换为溶质质量分数为1%,含水98%即溶质质量分数为2%。因此本题可转换为:要使溶质质量分数为1%的NaCl溶液a克,变为溶质质量分数为2%,应蒸发掉________克水。
解:设应蒸发掉水的质量为x A克 × 1% = (a克 – x) × 2% .. .. . . . . x = a/2 克 答案:应蒸发掉a/2克水 3. 求溶液的混合 例题:已知浓硫酸的密度大于稀硫酸的密度,现将90%的浓硫酸和10%的稀硫酸等体积混合后,溶质的质量分数将( )
A. 大于50%B. 等于50%C. 小于50%D. 都可能 分析:如果去查硫酸的密度再计算较麻烦,考试时也无处可查,本题可用估算法速解。若90%的浓硫酸与10%的稀硫酸等质量混合,则所得混合溶液的溶质质量分数恰好等于50%。现在等体积混合,由于浓硫酸的密度大于稀硫酸的密度,即浓硫酸的质量大于稀硫酸的质量,因此混合溶液的溶质质量分数会大于50%。
答案:A 4. 求溶液的配制 例题:现有24%硝酸钾溶液、2%硝酸钾溶液、硝酸钾固体和水。请选用上述不同物质配制10%硝酸钾溶液,将用量的最简整数比填入下表中相应的位置。
浓度分析:KNO3固体(100%)24%10%2%0%(水)
方案 24%硝酸钾溶液 2%硝酸钾溶液 硝酸钾固体 水 方案1 1 9 方案2 45 4 方案3 5 7 二.过饱和溶液中溶质质量分数的计算
计算在一定温度下溶液中溶质的质量分数时,首先应该判断所给出的溶质是否都已经完全溶解,在过饱和溶液中,溶质的质量分数要用溶解度来计算。
例题:20℃,KNO3的溶解度31.6g,将20g KNO3投入50g水中,充分搅拌后,制成20℃时的溶液,求该.. .. . . . . 溶液的溶质的质量分数。 分析:20℃时,100g水中最多能溶解31.6g KNO3,则50g水中最多只能溶解15.8g KNO3,即20g KNO3
中只有15.8g KNO3溶解,溶液就已饱和,还有4.2g不能溶解,不能看作溶液的组成部分。计算溶液中溶质
的质量分数时,一定要分清溶质,是真正被溶解的物质,当溶质的溶解度给出时,应先进行判断,所得溶液是否饱和,若为饱和溶液,则溶质的质量分数为
答案:溶液中溶质的质量分数 三.使用关系式法求溶质的质量分数 利用分子式和原子量的关系确定溶液中溶质和溶剂的质量关系,计算出溶液的溶质质量分数。 例题:在某乙醇(C2H5OH)溶液中,乙醇分子里所含的氢原子总数与水分子里所含的氢原子总数相等,则此乙醇溶液中溶质的质量分数是( )
A. 5%B. 71%C. 46%D. 33% 解析:根据氢原子数相等,找出乙醇分子与水分子间的关系,进而确定出质量关系。 解:C2H5OH~6H~3H2O 4654
此乙醇溶液中溶质的质量分数为: 答案:C 四.溶质的变化对溶质质量分数的影响 当加入的物质与溶剂发生化学反应时,加入的物质不再是该溶液中的溶质,而生成了新溶质,那么计算时不能用加入物质的质量代入公式求解,而要求出生成的新溶质的质量,再代入公式进行计算。
例题:你认为,在t℃时将5克某纯净物完全溶解在95克水中,所得溶液中溶质的质量分数可能出现哪些情况?试举例说明原因。
解答:由于某纯净物不是具体的某种物质,因此要分不同的情况进行讨论。 所得溶液的溶质质量分数可能出现三种情况: (1)溶质质量分数等于5%,例:5克NaCl或KNO3溶解在95克水中; (2)溶质质量分数大于5%,例:5克Na2O或SO3溶解在95克水中; (3)溶质质量分数小于5%,例:5克CuSO4·5H2O或Na2CO3·10H2O溶解在95克水中。 说明:第2种情况中Na2O或SO3溶解在水中与水化合生成NaOH或H2SO4, .. .. . . . . 化学方程式为:Na2O + H2O = 2NaOH;SO3 + H2O = H2SO4,溶质为NaOH或H2SO4 。 第3种情况中CuSO4·5H2O或Na2CO3·10H2O溶解在水中,溶质为CuSO4或Na2CO3 。
3、常见题型: 例1:含溶质a g,溶剂b g的溶液,溶质的质量分数是( )
分析:这是关于溶质的质量分数的简单计算,计算时根据:溶质的质量/(溶质的质量+溶剂的质量)×100%进行计算即可.
解:溶液中含溶质a g,溶剂b g,溶液的质量=溶质的质量+溶剂的质量=ag+bg,溶质的质量分数为a/(a+b)×100%.
例2:某浓溶液的溶质质量分数为m%,稀溶液的溶质质量分数为n%,混合后溶液的溶质质量分数为A%,则混合前,浓溶液与稀溶液的质量比是( ) A.m:n B.(A-n)/(m-A) C.(m+n)/200 D.(A-n)/(a+m)
分析:设浓溶液的质量分数为x,稀溶液的质量是y,然后根据 溶质质量分数= × 100%来计算混合前,浓溶液与稀溶液的质量比
解:设浓溶液的质量为x,稀溶液的质量是y. 根据质量分数=溶质的质量/ 溶液的质量 ×100%,得 溶质的质量=质量分数×溶液的质量, 所以,浓溶液的溶质的质量=xm%, 稀溶液的溶质的质量=yn%, 则A%=(xm%+yn%)/( x+y) ×100%,则x/ y =(A-n)/( m-A) ; 故选B.
溶质的质量 溶液的质量 .. ..
. . . . 例3:质量分数为10%的盐酸,要使溶质的质量分数增大,可采用的方法是( ) A.增加溶质 B.加热蒸发 C.加入38%的浓盐酸 D.加水、
分析:溶质的质量分数=溶质的质量/溶液的质量×100%,所以要使溶质的质量分数增大,可增加溶质的质量或减少溶剂的质量. 解:A、盐酸溶液的溶质是氯化氢气体,氯化氢气体极易溶于水,所以向10%的盐酸氯化氢气体,就会增加溶质的质量,增大溶质的质量分数.故A正确; B、理论上加热蒸发溶剂,溶剂质量减少,可增大溶质的质量分数,但盐酸溶液在加热的时候会挥发出氯化氢气体,即溶质质量也会减少,所以加热蒸发盐酸溶液溶质的质量分数不一定会增大.故B错误; C、稀盐酸和浓盐酸混合后,溶质的质量分数会比原来稀盐酸的质量分数大,所以质量分数为10%的盐酸中加入38%的浓盐酸,溶质的质量分数会增大.故C正确; D、加水相当于溶液的稀释,溶液中溶剂的质量增大,所以溶质的质量分数减小.故D错误. 故选AC.
例4:向一定溶质质量分数的蔗糖溶液中加入10g蔗糖,完全溶解后,得到溶质质量分数为30%的蔗糖溶液100g.则原蔗糖溶液溶质质量分数约为( ) A.10% B.11% C.20% D.22%
分析:根据题意可知,现有蔗糖溶液与原蔗糖溶液相比较,溶剂的质量没有变化,溶质的质量增加的10g.所以原来溶液的质量就是100g-10g,而现在溶液中溶质的质量减去10g就是原来溶液中溶质的质量.然后根据溶液中溶质质量分数的公式就可以得出答案.
解:有题意可知,原蔗糖溶液的质量为100g-10g=90g.原蔗糖溶液中溶质的质量为100g×30%-10g=20g 原蔗糖溶液中溶质的质量分数为:20g/90g ×100%=22% 故选D.
巩固练习: 一、固体物质未完全溶解型 1、20℃时,将50g NaCl放入100g水中,充分搅拌后所得NaCl溶液的溶质质量分数是(20℃时NaCl的溶解度为36g)