浙江省2019版高考化学大一轮复习专题1化学家眼中的物质世界第一单元物质的组成分类及变化分散系课
- 格式:ppt
- 大小:3.17 MB
- 文档页数:69

(浙江选考)2019版高考化学大一轮复习专题1 化学家眼中的物质世界专项突破练(一)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((浙江选考)2019版高考化学大一轮复习专题1 化学家眼中的物质世界专项突破练(一))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(浙江选考)2019版高考化学大一轮复习专题1 化学家眼中的物质世界专项突破练(一)的全部内容。
专项突破练(一)学考第29题(一)表格分析型1.(2017·杭州市萧山区命题比赛试卷)有一包铁粉和铜粉混合均匀的粉末样品,为确定其组成,某同学将不同质量的该样品分别与40 mL 1 mol·L-1的FeCl3溶液反应,实验结果如下表所示(忽略反应前后溶液体积的变化)。
实验序号①②③④m(粉末样品)/g0.90 1.80 3.607.20m(反应后剩余固体)/g00.642。
486。
08请计算:(1)实验④的滤液中c(Fe2+)=______________ mol·L-1。
(2)原粉末样品中n(Fe)∶n(Cu)=____________.答案(1)1。
5 (2)1∶1解析(1)因为还原性Fe>Cu,所以此混合物与FeCl3溶液反应的先后顺序为 a.2Fe3++Fe===3Fe2+b.2Fe3++Cu===2Fe2++Cu2+实验④中FeCl3完全与Fe反应(此时Fe应剩余)n(Fe2+)=0.04×1×32mol=0。
06 molc(Fe2+)=错误!=1.5 mol·L-1(2)从第②组数据可以看出,FeCl3全部参与反应,假设只发生a反应,则溶解Fe的质量为m (Fe)=56×错误! g=1.12 g,1。


专题一过关检测(时间:45分钟满分:100分)可能用到的相对原子质量:H1C12O16Na23Mg24Cl35.5S32Cu64一、选择题(本题包括12个小题,每小题4分,共48分,每小题只有一个选项符合题目要求)1.分类法是研究化学的一种重要方法,下列乙中的物质与甲中的分类关系匹配的是()2.实验室配制1 mol·L-1盐酸250 mL,下列不需要用到的仪器是()A.250 mL容量瓶B.托盘天平C.胶头滴管D.烧杯3.某合作学习小组讨论辨析:①生活中使用的漂白粉和肥皂都是混合物②可用过滤法分离FeCl3溶液和氢氧化铁沉淀的混合物③冰、干冰、冰醋酸都是纯净物④醋酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物⑤水玻璃、有色玻璃和果冻都是胶体⑥汽油属于混合物,而液氯、醋酸均属于纯净物⑦豆浆是胶体。
上述说法中正确的是()A.①②③⑤B.①②③④⑥⑦C.②③④⑤D.③④⑤⑥4.下表中所示物质或概念间的从属关系符合下图的是()5.下列叙述正确的是()A.活泼金属元素的氧化物一定是碱性氧化物,非金属元素的氧化物一定是酸性氧化物B.将NaOH溶液逐滴加入到FeCl3溶液中可制备Fe(OH)3胶体C.黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质D.纯碱、烧碱、碳酸钙、氯化亚铁四种物质所属类别相同6.下列目的能达到的是()A.将58.5 g NaCl溶于1 L H2O中可得1 mol·L-1的NaCl溶液B.将标准状况下22.4 L HCl溶于1 L H2O中可得1 mol·L-1盐酸C.将25.0 g胆矾溶于水后配成100 mL溶液所得溶液中溶质的物质的量浓度为1 mol·L-1D.将78 g Na2O2溶于水,配成1 L溶液,其物质的量浓度为1 mol·L-17.下列说法正确的是()A.胶体的分散质粒子直径大小介于溶液与浊液之间B.PM2.5是指空气中直径≤2.5 μm的颗粒物,直径为2.5 μm的颗粒物分散在空气中形成胶体(1μm=10-6 m)C.胶体处于介稳定状态,所以在一定条件下放置一段时间后,会有沉淀生成D.氢氧化铁溶胶、水玻璃、淀粉溶液均具有丁达尔效应8.根据我国统一实行法定计量单位的规定,下列说法比较规范的是()A.98 g硫酸的摩尔数为1 molB.氧的摩尔质量为32 g·mol-1C.某硫酸溶液中H2SO4的质量分数为60D.阿伏加德罗常数约为6.021023个9.下述各物质所含原子数目按由大到小顺序排列的是()①5 mol NH3②标准状况下22.4 L He③4 ℃9 mL水④2 mol H3PO4A.①④②③B.④③②①C.②③④①D.①④③②1下列物质中,与3 mol H2O含相同氢原子数的物质是()A.3 mol HNO3B.3.6121023个HNO3分子C.1 mol H3PO4D.2 mol CH411.现有A、B、C三种化合物,各取40 g相混合,完全反应后,得到18.0 g B、49.0 g C、还有D生成,已知D的相对分子质量为106。
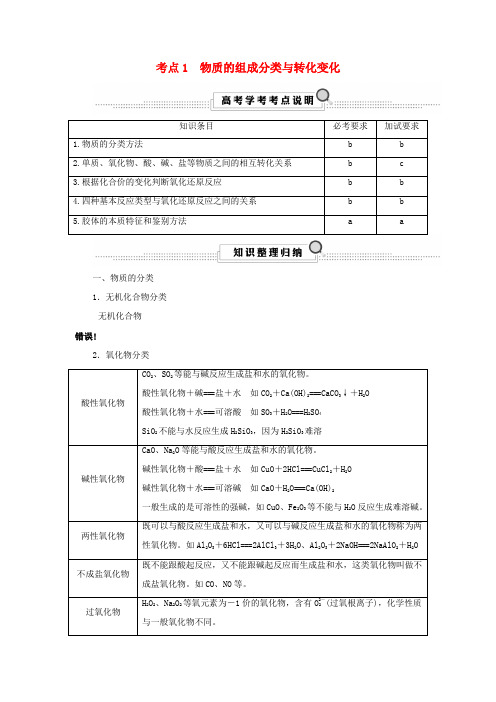
考点1 物质的组成分类与转化变化知识条目必考要求加试要求1.物质的分类方法 b b2.单质、氧化物、酸、碱、盐等物质之间的相互转化关系 b c3.根据化合价的变化判断氧化还原反应 b b4.四种基本反应类型与氧化还原反应之间的关系 b b5.胶体的本质特征和鉴别方法 a a一、物质的分类1.无机化合物分类无机化合物错误!2.氧化物分类酸性氧化物CO2、SO2等能与碱反应生成盐和水的氧化物。
酸性氧化物+碱===盐+水如CO2+Ca(OH)2===CaCO3↓+H2O 酸性氧化物+水===可溶酸如SO3+H2O===H2SO4SiO2不能与水反应生成H2SiO3,因为H2SiO3难溶碱性氧化物CaO、Na2O等能与酸反应生成盐和水的氧化物。
碱性氧化物+酸===盐+水如CuO+2HCl===CuCl2+H2O碱性氧化物+水===可溶碱如CaO+H2O===Ca(OH)2一般生成的是可溶性的强碱,如CuO、Fe2O3等不能与H2O反应生成难溶碱。
两性氧化物既可以与酸反应生成盐和水,又可以与碱反应生成盐和水的氧化物称为两性氧化物。
如Al2O3+6HCl===2AlCl3+3H2O、Al2O3+2NaOH===2NaAlO2+H2O 不成盐氧化物既不能跟酸起反应,又不能跟碱起反应而生成盐和水,这类氧化物叫做不成盐氧化物。
如CO、NO等。
过氧化物H2O2、Na2O2等氧元素为-1价的氧化物,含有O2-2(过氧根离子),化学性质与一般氧化物不同。
1.物质的性质与变化根据是否有新物质生成分为物理变化和化学变化。
应注意:升华、萃取、分液、蒸馏、吸附、盐析、金属导电、焰色反应、电离等都归为物理变化;脱水、蛋白质变性、水解、同素异形体互变、电解、熔融盐导电、电解质溶液导电等都是化学变化。
2.化学反应的分类四、胶体的性质与应用1.丁达尔效应可见光束通过胶体时,在与入射光垂直的角度可看见明亮的光路,可用此性质来鉴别溶液和胶体。

专题一 复习提纲(化学家眼中的物质世界)第一单元一、物质的分类及转化1、物质的分类:从不同的角度可以有不同的分类方法,最重要是从物质的组成上分类(2)、化合物还可以分为电解质和非电解质电解质: 非电解质:关于电解质要注意以下几个问题:1、电解质和非电解质都是化合物。
所以混合物(如溶液)、单质(如Cu 、石墨)等都既不是电解质也不是非电解质。
2、电解质能导电是在溶于水或熔融条件下。
所以固体NaCl 、固体K 2SO 4等是不导电的。
3、含金属阳离子的电解质在熔融条件下也能导电(如熔融NaCl 、熔融BaSO4、熔融Na 2O 等),而液态HCl 、纯净的液态硫酸等是不导电的。
4、盐酸、稀(浓)硫酸、NaCl 溶液等能导电但不是电解质而是电解质溶液。
5、会书写电解质的电离方程式(3)、电解质还可以分为强电解质和弱电解质强电解质 弱电解质(4)、物质的分散系分类1、常见分散系: 、 、 溶液、胶体、浊液是以分散质微粒的直径大小分类的 溶液:分散质直径 纳米 (即10-9m )胶体:1 纳米 分散质直径 100纳米 常见胶体: 浊液:分散质直径 纳米 2、胶体性质(1)丁达尔现象 在光的照射下形成光亮的通道 (2)胶体凝聚沉降 可用做净水剂2、化学反应的分类(1)从形式上分为四种基本类型、 、 、 (2)从是否有化合价升降的角度分为 、 氧化还原反应与 四种基本类型反应的关系纯净物 混合物:常见混合物如空气、溶液(如盐酸、稀硫酸、浓硫酸等)、 碱石灰(即CaO 和NaOH 的混合物)等 化合物 单质 (1)、物质无机化合物 有机化合物 化合物电解质酸: 碱: 盐: 金属氧化物:水 非电解质大部分有机物: 非金属氧化物: 其他:电解质强电解质 强酸: 强碱: 盐: 弱电解质 弱酸: 弱碱: 水:(3)氧化还原反应1.本质:2.判断依据:3.4.氧化还原反应中:化合价升高总数 = 化合价降低总数元素失电子总数 = 元素得电子总数(4)按是否有离子参加反应分: 、 离子方程式的书写: 1.写:2.拆:3.删:4.查: 离子共存问题:1. 离子之间是否生成难溶物或微溶物:2. 离子之间是否生成难电离的物质:3. 离子之间是否生成气体:4. 离子之间是否发生氧化还原反应:5. 溶液无色透明时,注意有色离子的排除:6. 强酸溶液中肯定不存在与H+起反应的物质7. 强碱溶液中肯定不存在与OH-起反应的物质二、物质的量2、各物理量之间的转化公式和推论(1)微粒数目和物质的量N A --- 。

专题1 化学家眼中的物质世界第一单元丰富多彩的化学物质一、物质的分类(1)从物质的组成分类:可以从混合物和纯净物、单质和化合物、非金属单质和金属单质、无机化合物和有机化合物等入手将物质进行分类。
纯净物与混合物的区别:(2)从物质的导电性分类:可将物质分为导体和绝缘体。
(3)从物质的状态分类:气体物质、液体物质和固态物质。
(4)从物质在水中的溶解能力分类:可将物资分为可溶、难溶。
另外,还可以从物质的用途、物质的来源等其他角度对它们进行分类。
二、物质的转化1.物质的性质及其变化(1)物质的性质化学性质物质在发生化学反应时表现出来的性质。
如:酸性、碱性、氧化性、还原性、可燃性、稳定性等(2)物质的变化物理变化定义物质发生状态或外形的改变,而没有生成新物质的变化。
如:水结成冰,蔗糖的溶解,酒精的挥发,金属通电,活性炭的吸附漂白等化学变化定义物质发生变化时生成了其他物质的变化。
在化学变化中常伴随有发光、热效应、变色、气体放出、沉淀生成等现象。
如:金属的腐蚀、物质的燃烧、食品的腐败变质、铵盐受热分解等类型按反应形式可分为:分解、化合、置换、复分解按反应的本质可分为:氧化还原反应、非氧化还原反应按参与反应的离子可分为:离子反应、分子反应按反应进行的程度可分为:可逆反应、不可逆反应2.无机化学反应一般规律(1)金属+非金属→无氧酸盐Mg+Cl2MgCl2(2)碱性氧化物+酸性氧化物→含氧酸盐CaO+CO2=CaCO3(3)酸+碱→盐+水2HCl+Ba(OH)2=BaCl2+H2O (4)盐+盐→两种新盐AgNO3+NaCl=AgCl↓+NaNO3一般参加反应的两种盐可溶,反应向生成更难溶物质的方向进行。
(5)金属+氧气→碱性氧化物2Cu+O22CuO (6)碱性氧化物+水→碱CaO+ H2O=Ca(OH)2一般生成的是可溶性的强碱,如CuO、Fe2O3等不能与H2O 反应生成相应的氢氧化物(碱)。
(7)碱+盐→新碱+新盐Ca(OH)2+Na2CO3=CaCO3↓+2NaOH(8)非金属+氧气→酸性氧化物S+ O2SO2(9)酸性氧化物+水→对应含氧酸SO3+ H2O=H2SO4(10)酸+盐→新酸+新盐CaCO3+2HCl=CaCl2+ H2O+CO2↑一般要符合强酸制弱酸或高沸点酸制低沸点酸(难挥发性酸制易挥发性酸)。
化学家眼中的物质世界(讲座)李仕才专题讲座一 学考第29题——化学计算题解题方法1.(2017·浙江11月选考,29)取7.90 g KMnO 4,加热分解后剩余固体7.42 g 。
该剩余固体与足量的浓盐酸在加热条件下充分反应,生成单质气体A ,产物中锰元素以Mn 2+存在。
请计算:(1)KMnO 4的分解率________。
(2)气体A 的物质的量________。
答案 (1)60%(或0.60) (2)0.095 mol 解析 (1)KMnO 4的分解率=分解的KMnO 4的物质的量KMnO 4总的物质的量。
题目已知KMnO 4共7.90 g ,物质的量为0.05 mol 。
加热分解后剩余固体为7.42 g ,损失的质量为O 2的质量0.48 g ,说明O 2的物质的量为0.015 mol 。
由2KMnO 4=====△K 2MnO 4+MnO 2+O 2↑,可知消耗KMnO 4 0.03 mol 。
所以KMnO 4的分解率为0.03 mol 0.05 mol×100%=60.0%。
(2)在整个反应过程前后,锰元素从+7价全部转化为+2价,说明整个反应过程中转移了0.05 mol×5=0.25 mol 电子。
剩余固体与浓盐酸反应生成气体A ,则A 应为氯气。
所以整个反应过程中只有氧元素和氯元素失电子。
氧元素失电子产生氧气,转移了0.015 mol×4=0.06 mol 电子。
根据电子守恒得知,氯元素必然转移0.19 mol 电子。
每产生1 mol 氯气就转移2 mol 电子,所以一定会产生0.19 mol÷2=0.095 mol 氯气。
2.(2017·浙江4月选考,29)分别称取2.39 g (NH 4)2SO 4和NH 4Cl 固体混合物两份。
(1)将其中一份配成溶液,逐滴加入一定浓度的Ba(OH)2溶液,产生的沉淀质量与加入Ba(OH)2溶液体积的关系如图所示。