- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.强电解质和弱电解质
栏目索引
3.电离方程式的书写
教材研读 栏目索引
(1)强电解质用“ ”;弱电解质用“ ”。
(2)多元弱酸分步电离,且第一步电离程度远远大于第二步,如碳酸:H2CO3
H++HCO3 ,HCO3
H++CO32 。
(3)多元弱碱的电离一步写出,如氢氧化铁:①
(4)酸式盐的电离
Fe(OH)3
1.电离平衡的建立 在一定条件(如温度、浓度)下,当弱电解质分子电离成离子的速率和离 子结合成弱电解质分子的速率相等时,达到了电离平衡状态。 2.电离平衡的特征
教材研读 栏目索引
3.影响电离平衡的因素 浓度、温度等因素对电离平衡有一定的影响。 (1)浓度 浓度降低(加水稀释),平衡向① 电离 方向移动。但弱电解质分子及 弱电解质电离出的离子浓度都降低。
教材研读 栏目索引
(2)温度 弱电解质的电离是一个② 吸热 的过程,升高温度,电离平衡向电离 的方向移动,弱电解质的电离程度增大。 (3)同离子效应 在弱电解质溶液中加入含有弱电解质电离产生的某种离子的物质,使离 子浓度增大,促使电离平衡逆向(即离子结合成分子的方向)移动,反之, 平衡正向(即电离方向)移动。
考点突破 栏目索引
(3)配制相同浓度的盐酸和醋酸溶液,分别测定两溶液的pH,醋酸溶液的 pH大。 (4)用已知浓度的盐酸和醋酸溶液分别配制pH=1的两种溶液,取相同体 积溶液并加入足量的锌,用排水法收集生成的氢气,醋酸产生氢气的量多。 Ⅱ.从影响弱电解质电离平衡的外界因素分析 把一定浓度的醋酸溶液分成两等份,其中一份加入醋酸钠固体,然后分别 加入形状相同质量相同的锌,未加醋酸钠固体的生成氢气的速率更快。
相等 ( √ )
教材研读 栏目索引
自测4 (1)电离平衡右移,电解质分子的浓度一定减小吗?离子的浓度 一定增大吗? (2)稀释一弱电解质溶液时,所有粒子浓度一定减小吗? 答案 (1)都不一定。如对于CH3COOH CH3COO-+H+,平衡后,加入 冰醋酸,c(CH3COOH)增大,平衡右移,根据勒夏特列原理可知,再次平衡 时,c(CH3COOH)比原平衡时大;加水稀释或加少量NaOH固体,都会引起 平衡右移,但c(CH3COOH)、c(H+)都比原平衡时要小。 (2)不是所有粒子浓度都减小。如弱酸HA溶液稀释时,c(HA)、c(H+)、c (A-)均减小,但c(OH-)会增大。
考点突破
考点突破
考点一 判断强、弱电解质的方法
栏目引
证明电解质为弱电解质的实验设计可从以下方面进行思考(以CH3 COOH为例): Ⅰ.从弱电解质的电离特点分析 (1)配制0.1 mol·L-1的醋酸溶液,测得该溶液的pH>1。 (2)配制浓度相同的盐酸和醋酸溶液,取相同体积的盐酸和醋酸分别加入烧 杯中,接通电源,观察灯泡亮度,接盐酸的灯泡更亮。
Ka= c(H ) c(CH3COO )
c(CH3COOH )
教材研读 栏目索引
(2)电离常数的意义 在一定条件下,根据电离常数数值的大小,可以估算弱电解质电离的程 度,K值越大,电离程度越大,弱酸酸性越强。如相同条件下常见弱酸的 酸性强弱:H2SO3>H3PO4>HF>CH3COOH>H2CO3>H2S>HClO。 (3)电离常数的影响因素 a.电离常数随温度的变化而变化。 b.电离常数与弱酸、弱碱的浓度无关,同一温度下,不论弱酸、弱碱的浓 度如何变化,电离常数是不会改变的。
教材研读 栏目索引
自测2 下列物质中,属于电解质的是
,属于非电解质
的是
,属于强电解质的是
,属于弱
电解质的是
。(填序号)
①H2SO4 ②盐酸 ③氯气 ④硫酸钡 ⑤酒精 ⑥铜 ⑦H2CO3
⑧氯化氢 ⑨蔗糖 ⑩氨气 CO2 NaHCO3
答案 ①④⑦⑧ ⑤⑨⑩ ①④⑧ ⑦
教材研读 栏目索引
二、弱电解质的电离平衡
Fe3++3OH- 。
强酸的酸式盐溶于水完全电离,如NaHSO4 Na++H++SO24 ;弱酸的酸
式盐中酸式酸根离子不完全电离,如NaHCO3的电离方程式:NaHCO3
Na++HCO3,② HCO3
H++CO32 。
教材研读 栏目索引
自测1 判断正误,正确的画“√”,错误的画“✕”。 (1)BaSO4难溶于水,其属于弱电解质 ( ✕ ) (2)强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 ( ✕ ) (3)强电解质溶液中不存在溶质分子,弱电解质溶液中存在溶质分子 ( √ ) (4)NH3通入水中,溶液导电性较强,故它是强电解质 ( ✕ ) (5)由0.1 mol/L一元碱BOH溶液的pH=10,可知溶液中存在BOH B++ OH- ( ✕ ) (6)冰醋酸溶于水的电离方程式为CH3COOH CH3COO-+H+ ( √ )
教材研读 栏目索引
(5)CH3COOH溶液加水稀释后,溶液中
c(CH3COOH ) c(CH3COO )
的值减小
(√)
(6)室温下,对于0.10
mol·L-1的氨水,加水稀释后,溶液中c(NH
4
)·c(OH-)变
大 (✕)
(7)稀醋酸加水稀释,醋酸的电离程度增大,溶液的pH减小 ( ✕ )
(8)中和等体积、等物质的量浓度的盐酸和醋酸溶液所消耗的n(NaOH)
教材研读 栏目索引
4.电离常数 (1)概念 在一定条件下,弱电解质在达到电离平衡时,溶液中电离所生成的各种 离子浓度的乘积跟溶液中未电离的分子浓度的比值是一个常数,这个常 数叫做电离常数,用K来表示(一般酸的电离常数用Ka表示,碱的电离常 数用Kb表示)。 如:CH3COOH H++CH3COO-
教材研读 栏目索引
自测3 判断正误,正确的画“√”,错误的画“✕”。 (1)稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 ( ✕ ) (2)25 ℃时,等体积、等浓度的硝酸与氨水混合后,溶液pH=7 ( ✕ ) (3)25 ℃时,0.1 mol·L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力 弱 (√) (4)25 ℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸<VNaOH ( ✕ )
栏目索引
第23讲 弱电解质的电离
教 一 电解质 材 研 读 二 弱电解质的电离平衡
总纲目录 栏目索引
总纲目录 栏目索引
考 点
考点一 判断强、弱电解质的方法
突
破
考点二 弱电解质的电离问题
教材研读
教材研读
一、电解质
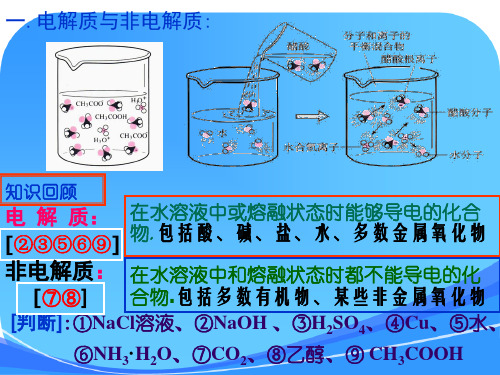
1.电解质与非电解质
(1)电解质:在水溶液里或熔融状态下能导电的化合物。
(2)非电解质:在水溶液里和熔融状态下都不能导电的化合物。