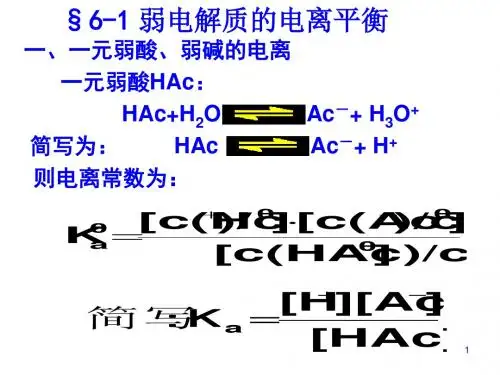
① 开 始 时 , v最( 大电
离)
0
v(结合)为
,而 。
②平衡的建立过程中,
v(电离>)
v(结
合)。 =
③ 当 v( 电 离 )
v( 结 合 ) 时 , 电 离 过
=
≠
3.外因对电离平衡的影响 (1)浓度:在一定温度下,同一弱电解质溶液,浓度越小,越易电 离。 (2)温度:温度越高,电离程度越大。 (3)同离子效应:参加与弱电解质具有相同离子的电解质时,可使 电离平衡向结合成弱电解质分子的方向移动。 (4)化学反响:参加能与弱电解质电离出的离子反响的物质时,可 使电离平衡向电离方向移动。
理解应用 分别画出冰醋酸加水稀释过程中溶液的电导率和pH随加水体积变化 的曲线。
答案
辨析易错易混∙正误判 断
(1)强电解质稀溶液中不存在溶质分子,弱电解质稀溶液中存在溶√质
分子( )
+4
(2)氨气溶于水×,当NH3·H2O电离出的c(OH-)=c(NH )时,说明
NH3·H2O电离处于平衡状态( )
质或采取的措施是
①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热 ⑥参加少
量MgSO4固体 A.①②③⑤
√ B.③⑥
C.③
D.③⑤
解析 假设在氨水中参加NH4Cl固体+4,c(NH )增大,平衡向左移动, c(OH-)减小,①不合题意; 硫酸中的H+与OH-反响,使c(OH-)减小,平衡向右移动,②不 合题意; 当在氨水中参加NaOH固体后,c(OH-)增大,平衡向左移动,③ 符合题意; 假设在氨水中参加水,稀释溶液,平衡向右移动,且c(OH-)减小, ④不合题意; 电离属吸热过程,加热平衡向右移动,c(OH-)增大,⑤不合题意; 参加少量MgSO4固体发生反响Mg2++2OH-===Mg(OH)2↓,溶 液中c(OH-)减小,⑥不合题意。