热力学函数的基本关系式
- 格式:ppt
- 大小:358.00 KB
- 文档页数:15





热力学基础中的热力学关系与偏导数热力学是研究能量转化和能量传递规律的一门学科,它是理解和描述自然界中许多现象和过程的基础。
在热力学中,我们经常面对各种热力学关系和偏导数的计算,这些关系和计算方法对于热力学分析和应用具有重要意义。
一、热力学基本关系式在热力学中,存在着几个基本的热力学关系式,它们是从热力学基本定律出发推导得到的。
这些关系式包括了内能、焓、熵、体积和温度之间的关系。
1. 内能和焓的关系:根据热力学基本定律,系统的内能变化等于传递给系统的热量与系统对外界做功之和。
即ΔU = Q - W。
通过对焓的定义H = U + PV,可以得到焓的变化与系统的热量和外界做功之间的关系,即ΔH = Q。
2. 熵和热量的关系:根据热力学第二定律,任何孤立系统的熵都不会减少。
对于可逆过程,熵的变化等于传递给系统的热量除以系统的温度,即ΔS = Q/T。
这个关系式揭示了熵与热量和温度之间的关系。
3. 温度和焓的关系:根据热力学基本定律和热容的定义,对于恒容过程,热容Cv等于系统的内能对温度的偏导数,即Cv = (∂U/∂T)v。
对于恒压过程,热容Cp等于焓对温度的偏导数,即Cp = (∂H/∂T)p。
这两个关系式揭示了温度与内能和焓之间的关系。
二、热力学关系的应用热力学关系的应用范围广泛,涉及到能量转化、功的计算、热力学循环等方面。
1. 热力学循环:热力学循环是指在各种设备和系统中完成能量转化的循环过程。
通过运用热力学关系,我们可以计算热力学循环中的功、热量和效率等参数,从而优化系统设计和提高能源利用效率。
2. 非平衡态热力学:非平衡态热力学是研究热力学系统远离平衡态时的行为和规律的分支学科。
通过热力学关系的应用,我们可以对非平衡态过程进行定量的描述和分析,揭示系统的演化路径和性质。
三、热力学关系的计算方法对于热力学关系的计算,我们经常使用偏导数来描述系统的性质和变化。
偏导数是多元函数在某一点上对某个变量的变化率。

热力学计算公式整理热力学是研究物质的热与能的转化关系的学科,是广泛应用于化学、物理、工程等领域的重要理论基础。
在热力学计算中,有一系列公式被广泛应用于热力学参数的计算和分析。
1.热力学基本方程:对于一个热力学系统,其内部能量U可以由其热力学状态变量来表示,常用的基本方程有:U=TS-PV+μN其中,U为内部能量,T为温度,S为熵,P为压力,V为体积,μ为化学势,N为摩尔数。
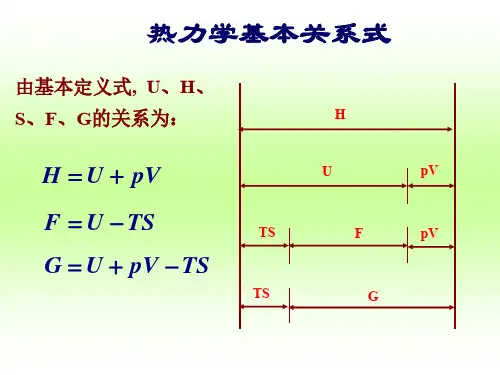
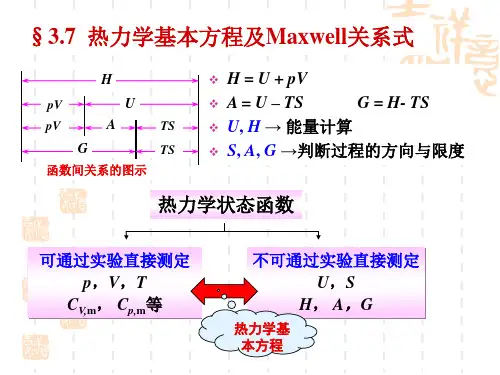
2.热力学函数的计算:(1)焓(H)的计算公式:H=U+PV其中,H为焓,U为内部能量,P为压力,V为体积。
(2)外界对系统做的功(W)计算公式:W=-∫PdV其中,W为功,P为压力,V为体积,积分为从初态到末态的过程。
(3)熵(S)的计算公式:dS=dQ/T其中,S为熵,dS为熵的微分,dQ为系统的热量变化,T为温度。
(4) Helmholtz自由能(A)的计算公式:A=U-TS其中,A为Helmholtz自由能,U为内部能量,T为温度,S为熵。
(5) Gibbs自由能(G)的计算公式:G=U-TS+PV其中,G为Gibbs自由能,U为内部能量,T为温度,S为熵,P为压力,V为体积。
3.热力学热力学参数的计算:(1)热容的计算公式:Cv=(∂U/∂T)V其中,Cv为定容热容,∂U/∂T为导数,V为体积。
Cp=(∂H/∂T)P其中,Cp为定压热容,∂H/∂T为导数,P为压力。
(2)趋近于绝对零度时的熵变ΔS的计算公式:ΔS = Cvln(T2/T1) + Rln(V2/V1)其中,ΔS为熵的变化,Cv为定容热容,T2和T1为温度的变化,R 为气体常数,V2和V1为体积的变化。
(3)等温过程中的吸热计算公式:q=ΔH=nCpΔT其中,q为吸热,ΔH为焓的变化,n为物质的摩尔数,Cp为定压热容,ΔT为温度的变化。
(4)等温过程中的做功计算公式:w=-ΔG=PΔV其中,w为做功,ΔG为Gibbs自由能的变化,P为压力,ΔV为体积的变化。



§均相封闭系统的热力学关系 3.1.1热力学函数的分类 3.1.2热力学函数的基本关系式 一、判断题7. 像dU =TdS -PdV 等热力学基本方程只能用于气体,而不能用于液体或固相。
( ) 3. 热力学基本关系式VdP TdS dH +=只适用于可逆过程。
( ) 二、选择题4. 对于一均匀的物质,其H 和U 的关系为( )。
A. H<UB. H>UC. H=UD. 不能确定 4. 关于热力学基本方程dU=TdS-pdV ,下面的说法中准确的是( )。
A. TdS 是过程热 B. pdV 是体积功 C. TdS 是可逆热 D. 在可逆过程中,pdV 等于体积功,TdS 即为过程热3. 对单位质量,定组成的均相流体体系,在非流动条件下有( )。
A. VdP TdS dH += B. VdP SdT dH += C. VdP SdT dH +-= D. VdP TdS dH --=4. 热力学第一定律的公式表述(用微分形式): 。
热力学第二定律的公式表述(即熵差与可逆热之间的关系,用微分形式): 。
4. 几个重要的定义公式:焓H=________;自由能A=___________;自由焓G=_________。
5. 几个热力学基本关系式:dU=_________;dH=_________;dA=_______;dG=________。
3.1.3Maxwell 关系式 一、判断题1. 理想气体的焓和热容仅是温度的函数。
( ) 1. 理想气体的熵和吉氏函数仅是温度的函数。
( )5. 理想气体的U 、C v 、H 、C p 虽然与p 无关,但与V 有关。
( ) 二、选择题4. 设Z 为x ,y 的连续函数,,根据欧拉连锁式,有( )。
A. 1x y z Z Z x x y y ⎛⎫⎛⎫∂∂∂⎛⎫=- ⎪ ⎪ ⎪∂∂∂⎝⎭⎝⎭⎝⎭B. 1y xZ Z x y x y Z ⎛⎫∂∂∂⎛⎫⎛⎫=- ⎪ ⎪ ⎪∂∂∂⎝⎭⎝⎭⎝⎭C. 1y x Z Z x y x y Z ⎛⎫∂∂∂⎛⎫⎛⎫= ⎪ ⎪ ⎪∂∂∂⎝⎭⎝⎭⎝⎭D. 1y Z xZ y y x x Z ∂∂∂⎛⎫⎛⎫⎛⎫=- ⎪ ⎪ ⎪∂∂∂⎝⎭⎝⎭⎝⎭ 5. 麦克斯韦关系式的主要作用是( )。